抽象的
背景
黄酮类化合物,次生代谢产物的主要群体之一,在生理学,生态学和植物的防御中发挥重要作用。其广泛的活动是包括多种官能团取代,包括羟基化的结构多样性的结果。在黄酮醇的6位上的芳羟基化是特别令人感兴趣的,因为它是由2-酮戊二酸依赖性双加氧酶(ODD),而不是细胞色素P450依赖性单加氧酶催化的。的ODD催化多种在次级代谢物生物合成牵连酶促反应。
结果
从黄酮醇中分离到一个编码部分甲基化黄酮醇6-羟化酶(flavonol 6-hydroxylase, F6H)的cDNA片段,并对其进行了表征Chrysosplenium americanum利用从本地植物蛋白中获得的内部肽序列信息。该克隆在原核和真核表达系统中均有功能表达,并表现出ODD活性。重组蛋白对辅因子和辅底物的需求是ODDs的典型特征,重组酶利用3,7,4'-三甲基槲皮素作为首选底物。编码这种酶的基因组区域在这类酶的保守位置上有两个内含子,并作为一个拷贝出现在c . americanum基因组。
结论
重组蛋白F6H已在分子水平上进行功能表达和表征。结果表明,其辅助因子依赖性、理化特性和底物偏好均优于天然酶。该蛋白的n端区域被认为在催化中起着重要作用,可能解释了6-羟基化反应位置特异性的差异。
背景
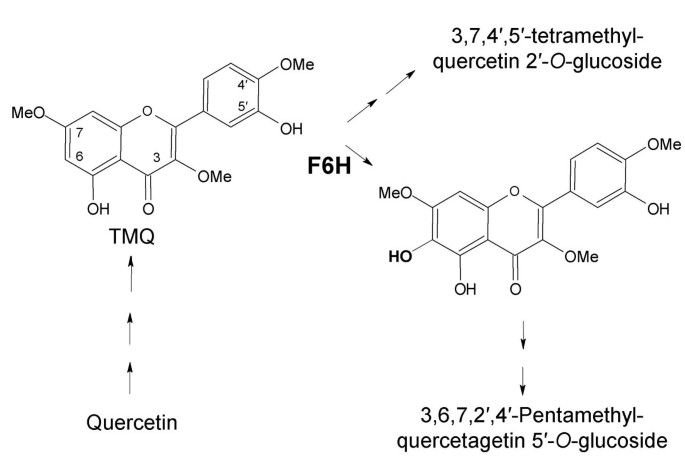
黄酮化合物构成了次生代谢物的主要组,并在植物开发,复制和防御中起重要作用。这种不同的活性谱由它们的结构多样性和各种功能组取代产生了[1].Chrysosplenium americanum(虎耳草科),半水生杂草,积累各种四和五甲基黄酮醇苷在黄酮醇环的各个位置取代[2].它们的生物合成从母苷元,槲皮素,是由许多步,底物特异性,定位催化O.- 甲基转移酶和两个截然不同O.-Glucosylyl转移酶以高度定义的序列(图1) [2].在它们的生物合成过程中,通过2-氧代氟化物依赖性的二恶英酶(奇数)将部分甲基化的中间体,3,7,4'-三甲基Qtercetin(TMQ)以6至3,7,4'-三甲基喹啉蛋白(TMQG)羟基化。(TMQG)(奇数),黄酮醇6-羟基化酶[3.].
植物ODDs (EC 1.14.11.-)构成了一类非血红素,含铁的胞质酶,利用氧酸作为辅助底物和活性铁部分的还原剂,通常是抗坏血酸。这类广泛存在的酶涉及多种植物代谢途径,包括一些氨基酸、激素、信号分子和各种次级代谢物的生物合成[4.].部分甲基化黄酮醇的6位羟基化是特别有趣的,因为它是由2-氧戊二酸依赖性双加氧酶而不是细胞色素p450依赖性单加氧酶催化的。
利用从纯化的植物蛋白中获得的肽序列信息[3.],设计简并引物筛选ac . americanumcDNA文库及F6H克隆的分离。通过对分离的cDNA克隆翻译后的氨基酸序列中的内肽序列进行鉴定,并通过F6H在原核和真核系统中的功能表达,确认了该克隆的身份。该基因的分子特征,包括其基因组组织和与其他参与植物次生代谢的ODDs的系统发育关系,有助于不断积累这类酶的信息。
结果与讨论
F6H的隔离和克隆
从天然蛋白的胰蛋白酶消化中获得了几种多肽,特别是Micro1 - DNGWILLHIGDSNGHR,显示出与其他已知类黄酮比值(如黄酮3-羟化酶(F3H))的显著相似性[5.]、黄酮醇合酶(FLS) [6.]和花青素合酶(ANS) [7.].另外两个肽序列Micro2 - KIVEACEDWG和Micro3 - TLMAGLACKLLGVL与这类酶具有有限的同源性。在使用的不同方法中,有两种方法可以从ac . americanum噬菌体表达库[8.].基于pcr的策略利用多个引物组合,分离出一个名为F6H·1的片段,该片段与类黄酮ODD基因具有显著的同源性。此外,F6H·1的部分氨基酸序列与微测序得到的另一个片段相匹配。随后,基于pcr的筛选方法扩增了一个1245 bp长的cDNA片段,称为cF6H它包含了这个推测的cDNA克隆的3'端,包括一个框内终止密码子(TAA)、一个推测的多聚腺苷酸信号(ATATAA)和一个短的多聚a尾(Accession # AY605048),尽管它缺少翻译起始位点。利用F6H·1序列衍生的寡核苷酸探针筛选了相同的cDNA文库。分离到推定阳性的克隆并对其进行了特征分析,但未获得一个完整的F6H cDNA克隆,但分离到几个与相关序列具有同源性的克隆F3H和氨基环丙烷羧酸氧化酶氧化酶(亚柯).进一步分离完整F6H ORF的尝试均不成功,包括使用反PCR和GenomeWalker技术(ClonTech)。
被截断的DNA片段,cF6H,转化为376 kDa的40.9和一的预测分子量个氨基酸长的序列π5.1。经过凝胶过滤或SDS-PAGE分析,天然蛋白的分子量分别为43 ~ 45 kDa [3.],表明cDNA片段缺乏〜10〜15的N-末端氨基酸残基。然而,保守区和催化重要的残基位于C-末端赔率的9.]都出现在译文中cF6H序列。与铁相关的氨基酸残基(His222, His285, Asp224)和α- kg结合(Arg295, Ser297)以及其他保守残基均存在于该蛋白中cF6H序列(图2).近全长cF6H,虽然在n端被截短,但被证实是编码F6H基因的真实片段,因为从天然蛋白中获得的内部肽序列存在于cDNA克隆的推导氨基酸序列中(图)2).ODD基因序列分析包括cF6H表明保守区域和催化作用重要的氨基酸主要位于这些蛋白质的c端,而保守程度较低的n端区域可能与底物结合或维持蛋白质的三级构象有关。考虑到n端固有的可变性,在某些情况下,它对ODD酶活性的贡献不显著,如去乙酰基vindoline 4-羟化酶Catharanthus roseus也叫[10,把剩下的碎片分离出来的一切可能性都已经用尽了cF6H将片段克隆到原核表达载体和真核表达载体中,测定其酶活性。
重组蛋白F6H的表达
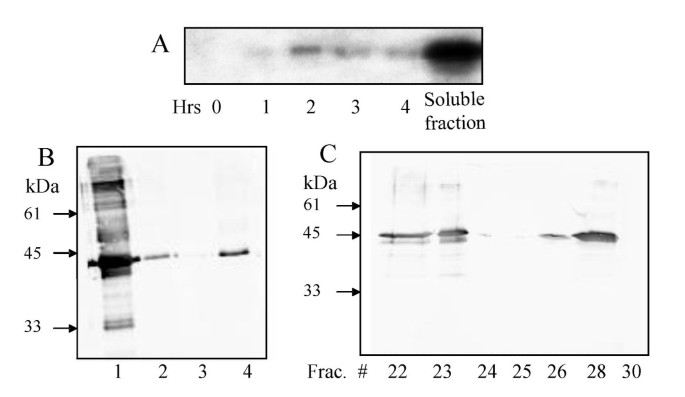
在4小时内评估细菌表达的F6H (rF6Hb)融合蛋白的诱导和溶解性,并测定重组F6H酶的活性。融合蛋白的表达水平由细胞裂解液的Western bolt分析,使用anti-(His)6.抗体。该抗体与诱导后携带PTRC-HIS-CF6H构建的细胞裂解物中的45kDa蛋白质带反应(图3.).这与重组蛋白的正确质量相符,因为(His)6.-tag和克隆过程中产生的外来氨基酸在融合结构中占额外的约3.5 kDa。ni - nta纯化的重组蛋白(图3.)的F6H活性为0.103 pkat/mg(表1).酶活性水平不受诱导时间和温度的影响。
为了测试(他)所产生的任何抑制作用6.-tag,融合蛋白经肠激酶(EK)孵育后裂解。与ni - nta纯化的rF6Hb相比,剪切蛋白的酶活性显著降低(见表2)1).活性的丧失是由于透析去除EK反应的抑制剂导致蛋白质的不稳定,然后在室温下与EK孵育。对照实验表明,6.-tag不能刺激整体重组酶的活性,因为与进行裂解的制备平行处理的完整rF6Hb表现出类似的酶活性降低。
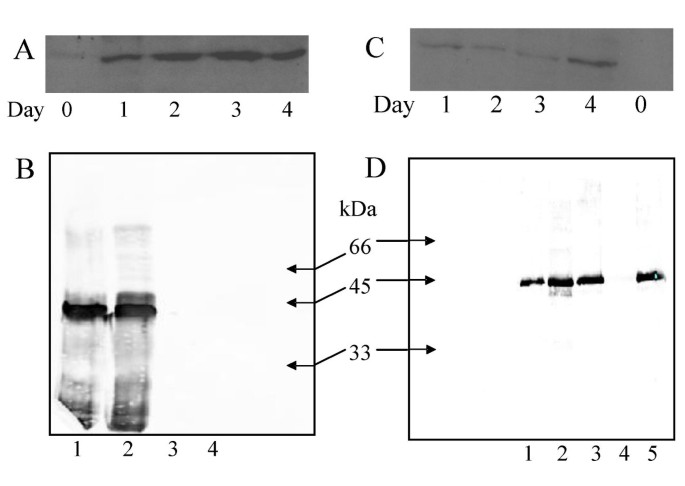
翻译后的cF6H序列具有两个潜在的糖基化位点在Ser139和Ser305,这可能有助于催化活性,可能通过稳定有利的三级构象或通过调节与其他蛋白质的相互作用。重组蛋白在真核表达系统中的表达考虑了这种翻译后修饰和蛋白质折叠的影响Pichia Pastoris..该系统是相对易于操作并且表现出许多的真核表达的优点,包括蛋白加工,折叠和修饰。重组蛋白表达为胞内(rF6Hy)和分泌(rF6Hys)。所选择的培养基(BMGY / BMMY)中含有特别的分泌蛋白蛋白稳定因子,如蛋白胨和酵母提取物,显示出减少蛋白水解,[11].蛋白表达,使用anti-(His) Western blot检测6.在细胞内和分泌系统中,抗体在诱导后3 - 4天达到最大值(图)4.),从Superose 12色谱柱上以约40 kDa的体积洗脱蛋白。镍亲和纯化的制剂对细胞内(rF6Hy)和分泌(rF6Hys)的比活性分别为0.21和0.11 pkat/mg。用尺寸排阻色谱代替或补充Ni-NTA纯化不能进一步提高其特异性活性(见表1)1).
用抗his抗体免疫印迹法检测rF6Hy/rF6Hys的表达(A) rF6Hy的时间历程诱导。(B)在Ni-NTA上纯化rF6Hy。Lanes: 1, Bound 2 (2ml洗脱液;5μg);2、Bound 1 (1 ml洗脱液;5μg);3、洗涤(10 μg);4、通流量(10 μg)。(C) rf6hy的时间历程诱导。(D) Ni-NTA纯化rF6Hys。 Lanes: 1, Bound 3 (3 mL eluate; 2 μg); 2, Bound 2 (2 mL eluate; 2 μg); 3, Bound 1 (1 mL eluate; 5 μg); 4, wash (10 μg); 5, flow-through (10 μg).
在原核和真核表达系统中,rF6H都是可溶的,表现出与天然蛋白相似的物理化学性质,不容易被蛋白水解降解。有趣的是,和天然植物蛋白一样[3.],重组F6H具有单体的功能,但也通过凝胶过滤来结合在体外(数字3 c).在天然F6H的情况下,这可能是由于在分离过程中与其他蛋白质的弱相互作用被破坏,特别是那些参与聚甲基化黄酮醇生物合成的蛋白质。翻译的疏水预测图cF6H(数据未显示)表明非极性区域的在蛋白质序列的最末端的存在,其可以参与二聚化或聚集方法。
重组F6H的底物特异性使用具有不同黄酮醇底物的Ni-NTA纯化的酶(测试表2).结果表明,虽然两种重组蛋白的总比活性均较天然蛋白降低,但rF6Hb和rF6Hy的首选底物均为3,7,4'-TMQ,两者均未显著接受槲皮素和3-甲基槲皮素。另一方面,3,7-二甲基槲皮素被rF6Hb和rF6Hy分别以56%和63%的活性接受。
鉴于这两种重组蛋白都没有利用柚皮素作为底物,因此F6H似乎不太可能催化F3H的副反应或F3H- fls的双功能活性温州蜜柑双官能加双氧酶(12].因此,该酶可以推定为窄特异性ODD [12].综上所述,这些结果表明ChrysospleniumF6H表现出涉及物种的聚甲基化黄酮化生物合成特性的部分甲基化黄酮类化合物的特异性。
细胞表达的重组蛋白的辅助因子要求与天然植物蛋白的蛋白质相似[3.].在亲和纯化的样品中,亚铁离子对酶活性和酶活性的影响最大,在5 mM EDTA孵育时酶活性被消除。表面的初步评估K.m黄酮醇底物(63 μM)的rF6Hb值表明,与天然蛋白(0.27 μM)相比,其结合亲和力降低了17倍[3.].相比之下,α-KG的结合位点仅受到轻微影响(78 μM而不是60 μM),表明共底物的结合位点没有发生明显改变。然而,由于n端截断和酶活性降低,重组蛋白没有进行详细的动力学分析。
芳族碳的羟基化可以是与活性位点内的氧化部分相关的基材定位的结果。Mehn和同事[13通过使用合成铁配合物,试图阐明co - substrate在ODDs活化氧中的作用,也证明了酚类底物的羟基化。此外,酚基团上取代基的性质,极大地影响反应速率。这些结果表明,底物的结构及其在活性位点内的位置在芳香族羟基化中起着至关重要的作用,而不是在反应机制上有更根本的差异。这可能解释了n端对F6H酶活性的重要性,特别是当它通过直接促进黄酮醇结合位点或维持合适的底物识别构象而参与底物结合时。与天然F6H相比,无论表达系统、纯化程度或多组氨酸标签的位置如何,rF6H都表现出较低的特异性活性,这一事实进一步证实了这一假设。
3.2分子特征
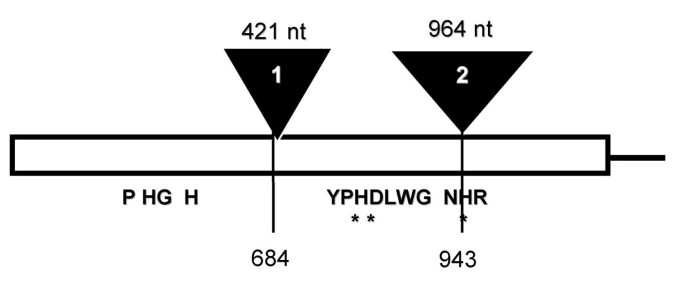
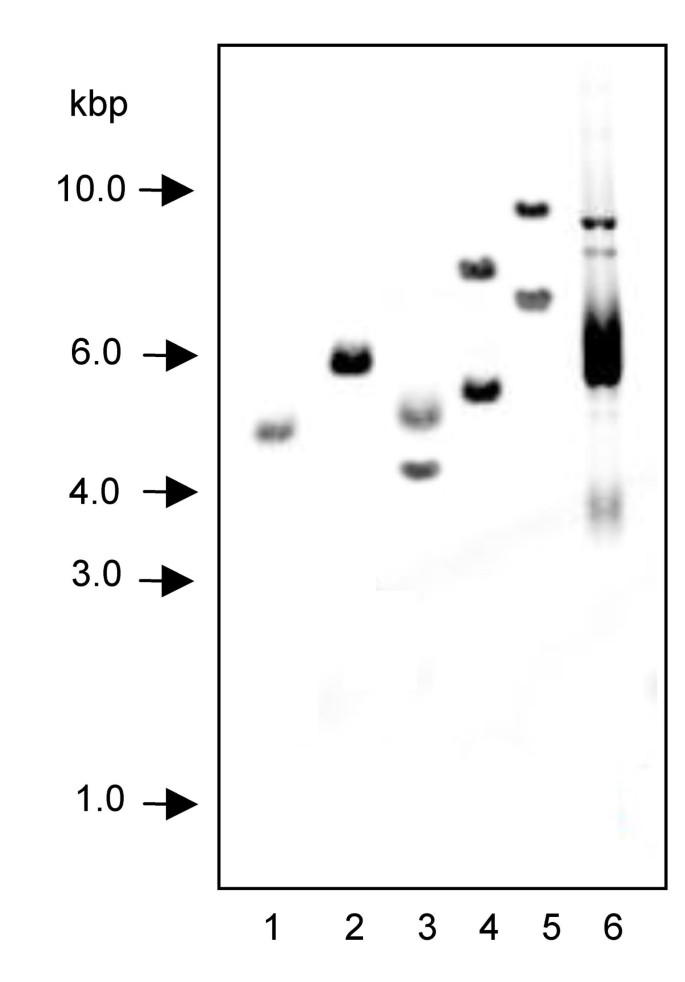
为了分离编码F6H的基因组区域,基因组c . americanum以DNA为模板,在DNA的最外层区域设计引物进行扩增反应cF6H序列。这产生了~3.1 kbp (gF6H),包含两个潜在的内含子序列(图5.).第一个内含子长421 bp,位于684位cF6H而第二个内含子明显较长,为964 bp,位于基因3'端943位。
南方基因组DNA分析,用探针cF6H部分ORF,产生单波带Bam你好,生态ri -酶切基因组DNA(图6.).内部序列gF6H不含上述酶的任何识别位点;然而,一个识别位点位于已知的序列kpn.我,以区域我,XHO.I.在这些通道中检测到两个主要波段,估计大小从4.3到10.0 kbp不等。这些结果表明F6H以单拷贝基因的形式存在于C.americanum,特别是因为潜在的串联F6H重复会导致观察到大于6.2 kbp的片段,而这些片段在lane 1中并不存在。在降低严格度的条件下,某些通道显示出比预期的两个条带更多的条带(数据未显示),表明基因组内存在相关序列。
用不同方法分离的克隆的orf序列相同,表明它们代表相同的蛋白质。这与南方分析得出的结果一致F6H以单一副本的形式出现在c . americanum基因组。的氨基酸序列cF6H与其他ODDs具有同源性,特别是在c端,这种保守性可以扩展到整个基因的组织。这一事实gF6H在ODDs的保守位置拥有两个内含子[14的研究表明,ODD序列是由于来自同一个祖先的差异而产生的。这种酶的单拷贝特性也表明在多甲基化黄酮醇生物合成中起调节作用,可能是重要的,与发生在TMQ中间体2'-位置的第二次羟化有关(图)1).最近报道了一个类似的反应,由细胞色素p450依赖的单加氧酶催化,涉及异黄酮的2'-羟基化Medicago Truncatula.[15].有人提出,参与金菊黄酮类化合物顺序甲基化的胞浆酶是在多酶聚集物的表面组织起来的,因此可以从整体上更有效地调控途径[16].F6H很可能是这种酶补体的一个组成部分,因为它在3,7,4'-三甲基槲皮素的第6位引入了一个羟基O.-甲基化,由黄酮醇6-O.甲基转移酶(F6OMT)。F6H和F6OMT两种酶的免疫定位应该为支持这一观点提供进一步的证据。
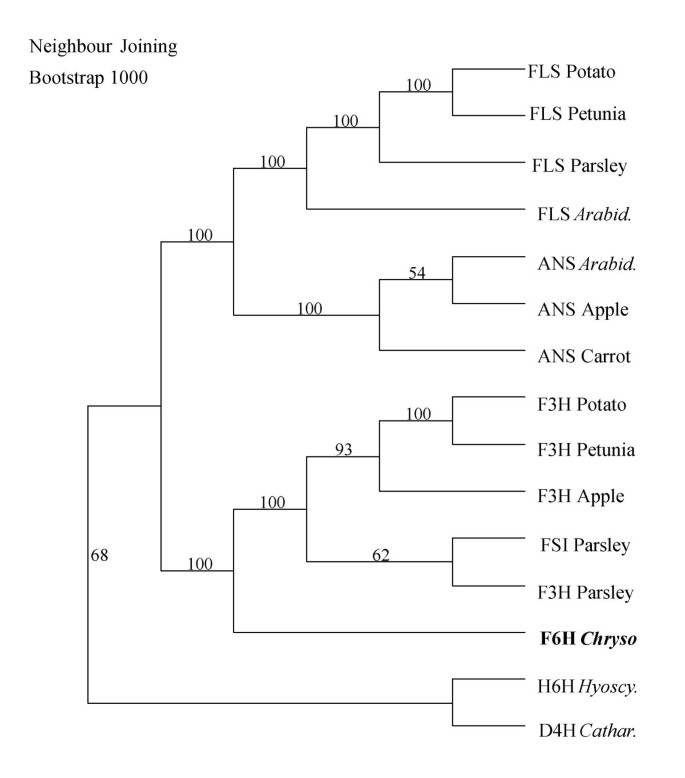
cF6H从c . americanum在氨基酸水平上表现出最高的相似性F3H同源染色体。系统发育学上,很明显,编码生化相关蛋白的同源基因在单个通路中被聚成相关的亚群(图)7.),这可能是基因复制和分化的结果。在给定的物种中,编码蛋白质的相同途径的基因,虽然不在同一亚群中,但预期比不相关的基因表现出更高的同一性。cF6H集群的F3H一组基因,尽管其位置远于其他物种的同源基因,因而表明与生物合成相关的酶的这一特定亚群的进化关系。从图中可以明显看出7.黄酮醇可能聚集成两个不同的分支;第一种由酶组成,具有较窄的底物特异性,包括F3H、FSI和F6H,而第二种由FLS和ANS组成,如前所述,它们都具有广泛的底物特异性[12那17那18].似乎基于生物化学和系统发育的考虑,ChrysospleniumF6H表现出高基板和位置特异性。
在系统发育水平,赔率包括超家族与众多子群的子集由在所编码的蛋白质基序共享,如那些参与类黄酮合成的定义。这些基序通常包括酶和/或用于底物和辅因子的结合结构域的活性位点。此外,编码双加氧酶与不同底物偏好基因之间的相似程度表明常见的反应机制。F6H和相关的ODD的分子表征可识别结构或反应机理潜在共性,以及揭示了基序或残基,其可确定反应的类型和/或底物偏好。当与相关序列进行比对,cF6H显示出铁和共底物结合所需的基元高度保守,而其他区域几乎没有或几乎没有同一性,并被推测,最有可能的是,促成底物特异性和/或反应类型的差异。这尤其适用于可变的n端,以及需要在ODD序列基序中插入缝隙以与其他类黄酮生物合成酶进行适当比对的区域。进一步证明这种差异的证据是,尽管F6H与类黄酮双加氧酶F3H聚类(图7.),就这组基因而言,它似乎是从一个共同的祖先旁速进化而来的。
结论
从黄酮类化合物中分离到一个参与部分甲基化黄酮醇的6-羟化反应的新ODD cDNAc . americanum.用重组F6H观察到的底物特异性与天然酶比较好[3.];显示部分甲基化黄酮醇第6位的特异性,首选底物为3,7,4'-三甲基槲皮素。事实上,它羟基化部分甲基化的黄酮醇芳香环A的位置6,与其他芳香羟基化形成对比,其他芳香羟基化通常由细胞色素P450单加氧酶催化,如黄酮醇8-羟化酶万寿菊patula[19]和大豆中参与异黄酮生物合成的类黄酮6-羟化酶[20.].考虑到天然和重组F6H都表现出对相对疏水性底物的偏好,进一步将该蛋白与迄今为止已知的接受相对极性类黄酮苷元的其他双加氧酶区分开来[21-24].这种明显的进一步证据是这样的事实cF6H集群的F3H类黄酮双加氧酶组(图7.),它出现在一个并系的方式已经发展相对于该组的基因。一般类黄酮合成可以从多功能双加氧酶的兴起,因为F3H和F6H似乎都有一个共同的祖先,但后来发生了显著差异导致这种新颖活动的发展。
一个具有全酶活性的克隆,可以根据cF6H提供新鲜组织序列是可用的,可以使用具有通过定点诱变相对于底物偏好,以评估这种酶的多功能性,以及评估在代谢工程其潜在的应用。
方法
材料
Chrysosplenium americanum(Schwein X胡克;虎耳草科),由圣阿尼塞,魁北克收集,并模拟关于光强度,温度和湿度其自然生境条件下保持在温室中。
黄酮醇底物来自我们的实验室收集。所有其他的化学品都是分析试剂级的。缓冲液:检测缓冲液,50 mM Tris-HCl (pH 7.3), 10 mM DTT, 150 mM NaCl, 10%甘油(v/v);洗涤液I, 2 × SSC, 0.1% SDS (w/v);洗涤液II, 0.1 × SSC, 0.1% SDS (w/v);封闭液,5% SDS (w/v), 125 mM NaCl, 25 mM磷酸钠(pH 7.2);印迹洗涤液,0.5% SDS (w/v), 12.5 mM NaCl, 2.5 mM磷酸钠(pH 7.2)。FPLC缓冲液经过过滤、脱气并在4°C保存。
分离F6H克隆
配体亲和纯化的F6H蛋白[3.]在哈佛大学微化学实验室(Harvard Microchemistry Facility)进行消化和测序,在Finnigan LCQ四极离子阱质谱仪上使用微毛细管、反相高效液相色谱纳米电喷雾串联质谱(MS/MS)。使用华盛顿大学开发的Sequest算法,获得的MS/MS光谱与已知序列相关联[25那26].
一种c . americanumcDNA Lambda UniZap XR文库通过PCR筛选,如[27]的cDNA文库为5 μL(代表1 × 10 .6.空斑形成单位)的反应。以下简并寡核苷酸引物来源于从天然蛋白中获得的两个内部肽序列Micro1和Micro2;
Micro1For-5 -GCTGGATCCTCCTTCATATA-3”;
Micro1REV-5' - (GC)GATAC(AT)GG(TC)AA(TC)(CG)TTAG(ATGG(CT)TATAC-3';
Micro2For-5 -AATTGTTGAAGCATGTGAAG-3”;
Micro2Rev-5”——(TC) GGGGTTAG (AG) AG (TC) GT (AC) CG (AG) AA-3 ';
T3 + 6 - 5'- gct CGA aat taa CCC tca cta aag gg-3 '
T7 + 6 - 5'- gaa TGG taa tac gac tca cta tag GGC g-3 '
引物组合:ⅰ)Micro1Rev和Micro2For;ⅱ)Micro1For和T3;ⅲ)Micro1Rev和T7;ⅳ)Micro2For和T3;V)Micro2Rev和T7。PCR产物克隆到pGEM-T载体(Promega)后进行DNA测序用于表征。DNA测序进行了使用双脱氧链终止法[28].使用混合引物组,T7和Micro1Rev扩增片段F6H·1,并包含底漆设计的肽序列,以及某些保守的奇体基序和第二肽序列。为了隔离全长推定的F6H克隆,将新的引物组特定于F6H·1序列的末端设计,并在严格条件下用载体引物重复筛选过程。或者,如[1中所述,筛选噬菌体cDNA文库。29, F6H·1片段(602 bp)作为寡核苷酸探针。被分离出的推断为编码F6H的近全长cDNA片段被命名cF6H.由于缺乏新鲜的c . americanum为了在5'- cDNA末端快速扩增(RACE)实验或引物延伸中使用,利用基因组dna技术,如反PCR和GenomeWalker (ClonTech),试图分离假定的F6H序列的剩余5'端。然而,这两种方法都没有成功。
分离基因编码的基因组区域cF6H那c . americanum基因组DNA(0.1至1.0μg)用作PCR的模板,用于PCR设计为末端的引物cF6H序列。将推定阳性片段克隆到pGEM-T载体中进行DNA测序。
确定的副本数F6H,基因组DNA (15 μg)在夜间被消化,并接受Southern分析,根据[30.].调查,cF6H,使用BioPrime Kit (Amersham)进行标记,该试剂盒用于制备生物素化核苷酸探针,以irdy800标记的链霉亲和素(Rockland Immunochemicals)作为检测系统进行印迹。使用UltraHyb-OS (Ambion)在42°C下预杂交2-3小时。用变性生物素化探针在新鲜的UltraHyb-OS中溶解,在42°C下过夜进行杂交。按照制造商的说明使用洗涤液I和II清洗膜。室温下用封闭液封闭膜1小时,然后用irdy800标记的链霉亲和素(1:10 000)在封闭液中室温封闭1小时。检测前用印迹清洗液冲洗3次,每次15分钟。
克隆与表达策略
编码近全长F6H的cDNA片段,cF6H被克隆到大肠杆菌表达系统(pTrc-His;利用基因特异性引物进行PCR扩增Bam你好,hDIII识别位点,分别。DNA插入物位于下游并且在帧与序列编码(His)的6.-TAG和肠胆碱酶切割识别位点。通过热冲击将PTRC-HIS-F6H构建体转化为前10个细胞,并在含氨苄青霉素(50μg/ ml)的培养基上选择。重组蛋白质生产大肠杆菌在37℃下添加1 mM异丙基-β- d -硫代半乳糖苷(IPTG) 4 h诱导菌株Top 10。细胞球经超声和离心后,上清液检测F6H酶活性或在Ni-NTA树脂(Qiagen)上纯化。亲和纯化的蛋白在250 mM咪唑的存在下被洗脱,并在PD-10色谱柱上与检测缓冲液交换。酶的测定和反应产物的分析如前所述[3.].
异种表达Pichia Pastoris.表达系统(EasySelect PPICZ-HIS; Invitrogen)可以是细胞内(PPICZ)或分泌(PPICZα),这取决于框架内信号肽的存在。这cF6H利用基因特异性引物进行PCR扩增kpn.我和囊II识别位点分别。对于pPicZ构建,起始ATG是酵母共识序列(AATA)的一部分ATGTCT)包含在5'基因特异性克隆引物中。pPicZα结构体克隆在具有n端信号序列和c端His-tag的框架内。pPicZ-cF6H和pPicZα-cF6H结构体转化为毕赤酵母属根据制造商说明书(Invitrogen公司),在含zeocin的培养基上选择推定的多拷贝重组体。
重组F6H的产生是由添加0.5%的甲醇(在没有葡萄糖的情况下)每24小时诱导的,持续3到4天。缓冲培养基(BMGY/BMMY;含100 mM磷酸钾,pH 8.0)的培养基用于细胞生长和蛋白诱导,以提高蛋白稳定性和限制酶失活。在生产细胞内重组蛋白的情况下,使用玻璃微珠裂解细胞,并根据制造商的说明书制备提取物(Invitrogen公司)。收集分泌蛋白,用硫酸铵沉淀(35 - 70%饱和)浓缩,用于脱盐后的活性测定或后续的亲和纯化。
从原核和真核表达系统中获得的重组蛋白经SDS-PAGE检测[31]和Western blot [32]化学发光(HRP;Amersham)或irdy800 (Li-Cor)检测。
系统发育分析
从PubMed和GenBank检索中筛选出15个与次生代谢相关的可获得生化信息的不同植物的ODD基因。氨基酸序列使用CLUSTAL-W[比对33和PHYLIP输出格式。数据被转移到MacClade 4.03 [34]在通过系统发育树建筑和分析程序分析之前的目视检查和手动编辑,PAUP 4.0,Beta 4 [35].用于距离方法的最优标准是邻近的[36].使用启发式搜索算法1000个无规加成序列的比对的氨基酸序列进行分析。自举分析是基于1000次重复与启发式搜索携带并且距离测量被设定为等于平均字符的区别。
缩写
- cF6H:
-
F6H cDNA
- F6H:
-
黄酮醇6-hydroxylase
- gF6H:
-
基因组F6H
- 奇怪的:
-
2-oxoglutarate-dependent加双氧酶
- α公斤:
-
α酮戊二酸
- 子:
-
开放阅读框
- rF6H:
-
重组F6H
- RF6HB:
-
重组F6h在细菌中表达(大肠杆菌)
- rF6Hy:
-
重组F6H在酵母中表达(p . pastoris)——细胞内
- rF6Hys:
-
重组F6H在酵母中表达(p . pastoris)——分泌
- TMQ 3:
-
7、4 -trimethylquercetin
- TMQg 3:
-
7,4'-trimethylqrquertagetin
参考文献
- 1.
Ibrahim Rk,Anzellotti D:类黄酮多样性的酶促基础。综合性植物化学:从乙烯单位到分子生态学。编辑:罗密欧JT。2003年,纽约,全国局,37:1-36。
- 2.
Ibrahim RK, De Luca V, Khouri H, Latchinian L, Brisson L, Charest PM:美国金菊中多甲基黄酮醇苷的酶学和区段划分。植物化学。1987,26:1237-1249。10.1016 / s0031 - 9422(00) 81789 - 6。
- 3.
基于2-氧戊二酸的新型黄酮醇双加氧酶:亲和纯化、表征和动力学性质。生物化学学报。2000,38(2):161-172。10.1006 / abbi.2000.2002。
- 4.
Prescott Ag,Lloyd MD:铁(II)和2-氧酸依赖性二氧化基酶及其在代谢中的作用。NAT产品批准。2000,17:367-383。10.1039 / A902197C。
- 5.
Lukacin R, Urbanke C, Groning I, Matern U:该单体多肽由矮牵牛的功能性黄酮3b-羟化酶组成。FEBS Lett. 2000, 467: 353-358。10.1016 / s0014 - 5793(00) 01116 - 9。
- 6.
WELLMANN楼Lukacin R,森口T,Britsch L,席尔茨E,Matern U:功能表达和从温州蜜柑黄酮醇合成酶的突变分析。EUR生物化学与。2002年,269:4134-4142。10.1046 / j.1432-1033.2002.03108.x。
- 7.
Saito K, Kobayashi M, Gong Z, Tanaka Y, Yamazaki M:花青素合成酶作为2-氧合戊二酸依赖的加氧酶的直接证据:紫苏红色形态cDNA的克隆和功能表达。植物学报,1999,17:181-189。10.1046 / j.1365 - 313 x.1999.00365.x。
- 8.
Gauthier A, Gulick PJ, Ibrahim RK: cDNA克隆和3'/5'- o -甲基转移酶的部分甲基化黄酮醇从chrysospium americanum。植物生态学报。1996,32(6):593 - 598。10.1007 / BF00041401。
- 9.
Lukacin R, Britsch L:矮牵牛花黄酮3b-羟化酶中严格保守的组氨酸和精氨酸残基的鉴定。中国生物化学杂志,1999,19(4):457 - 457。10.1111 / j.1432 1033.1997.t01 - 2 - 00748. x。
- 10.
Vazquez-Flota F, De Carolis E, Alarco AM, De Luca V: Catharanthus roseus (L.)中参与vindoline生物合成的2-氧戊二酸依赖性双加氧酶desacetoxyvindoline-4-hydroxylase的分子克隆和特性g .堂。植物生态学报,1998,32(4):593 - 598。10.1023 /: 1005894001516。
- 11.
作者:Clare JJ, Romanos MA, Rayment FB, Rowedder JE, Smith MA, Payne MM, Sreekrishna K, Henwood CA:酵母生产小鼠表皮生长因子:利用毕氏毕氏酵母菌株含有多个基因拷贝的高水平分泌。基因。1991,105:205-212。10.1016 / 0378 - 1119(91) 90152 - 2。
- 12.
Lukacin R, Wellmann F, Britsch L, Martens S, Matern U:柑橘黄酮醇合成酶是一种双功能双加氧酶。植物营养与肥料学报,2003,27(6):457 - 461。10.1016 / s0031 - 9422(02) 00567 - 8。
- 13.
引用本文:王志强,王志强,王志强,等。非血红素铁(II)配合物对氧的活化作用:酮-羧酸和羧酸。化学学报。2003,32(4):457 - 461。10.1021 / ja028867f。
- 14.
植物双氧合酶在植物代谢中的作用。植物营养与肥料学报,1996,27(4):495 - 503。10.1146 / annurev.arplant.47.1.245。
- 15.
刘建军,胡曼,刘建军。药用紫花苜蓿细胞色素p450 81E酶的区域特异性羟基化反应。植物学报,2003,36:471-484。10.1046 / j.1365 - 313 x.2003.01893.x。
- 16.
易卜拉欣:类黄酮缀合物的免疫定位。植物酚代谢。编辑:Stafford, H. and Ibrahim RK。1992年,纽约,全会出版社,25-61。
- 17.
黄酮类化合物2-氧戊二酸依赖性双加氧酶的进化。FEBS Lett. 2003, 544: 93-98。10.1016 / s0014 - 5793(03) 00479 - 4。
- 18.
Turnbull JJ, Nakajima J, Welford RW, Yamazaki M, Saito K, Schofield CJ:花色素合成酶、黄酮醇合成酶和黄酮3beta-羟化酶三种2-氧戊二酸依赖的类黄酮生物合成加氧酶的机理研究。中国生物医学工程学报。2004,29(6):516 - 524。10.1074 / jbc.M309228200。
- 19.
Halbwirth H,沃斯特楼Forkmann G,施蒂希K:在8位置黄酮醇的酶A环羟基化:;加拿大蒙特利尔。1999年,
- 20.
黄酮类化合物6-羟化酶(Flavonoid 6-hydroxylase, Glycine max L.)是一种新的植物P-450单加氧酶。中国生物医学工程学报。2001,27(3):457 - 461。
- 21.
Britsch L,格里斯巴赫H:纯化和(2S) - 黄烷酮从矮牵牛3-羟化酶的表征。EUR生物化学与。1986年,156:569-577。
- 22.
黄酮合酶I的纯化和性质,2-氧戊二酸依赖性去饱和酶。生物化学学报。1990,282:152-160。
- 23.
Holton Ta,Brugliera F,Tanaka Y:来自Petunia Hybrida的黄酮合成酶的克隆和表达。工厂J. 1993,4:1003-1010。10.1046 / J.1365-313x.1993.04061003.x。
- 24.
作者简介:王志强(1996 -),博士研究生,主要研究方向为拟南芥花青素合成酶的结构和机制。结构(综眼)。2002年,10:93 - 103。10.1016 / s0969 - 2126(01) 00695 - 5。
- 25.
Eng CM, Niehaus DJ, Enriquez AL, Burgert TS, Ludman MD, Desnick RJ:法布里病:23个突变,包括义和反义CpG改变和a-半乳糖苷酶a基因缺失热点的鉴定。《中国科学院院刊》1994年第3期。
- 26.
Chittum HS, Lane WS, Carlson BA, Roller PP, Lung FD, Lee BJ, Hatfield DL: Rabbit b-globin通过多重抑制和翻译阅读间隙扩展到UGA终止密码子之外。生物化学。1998,37:10866-10870。10.1021 / bi981042r。
- 27.
Friedman KD, Rosen NL, Newman PJ, Montgomery RR: lambda-gt11文库的筛选。PCR协议:方法和应用指南。1990,圣地亚哥,学术出版社,253-257。
- 28.
Sanger F, Nicklen S, Coulson AR:链终止抑制剂的DNA测序。中国科学(d辑:地球科学),1998,18(4):593 - 597。
- 29.
Seidman JD:重组DNA文库的筛选。关于分子生物学的当前方案。1994年,纽约,约翰瓦里和儿子,6.0.3-6.3.6。
- 30.
分子克隆:实验室手册。2001,《冷泉港》,冷泉港出版社,3
- 31.
Laemmli UK: T4噬菌体头部组装过程中结构蛋白的切割。《自然》,1970,227:680-685。
- 32.
ToTbin H,Staehelin T,Gordon J:从聚丙烯酰胺凝胶中的蛋白质的电泳转移到硝酸纤维素片:程序和一些应用。Proc Natl Acad SCI U S A. 1979,76:4350-4354。
- 33.
CLUSTAL W-通过序列加权、特定位置间隙惩罚和权重矩阵选择来提高累进多序列比对的灵敏度。核酸研究。1994年,22日:4673 - 4680。
- 34.
Maddison DR, Maddison WP: MacClade,版本4.03。2000年,马萨诸塞州桑德兰,西纳尔联合公司
- 35.
斯沃福德DL: PAUP。2000年,马萨诸塞州桑德兰,西纳尔联合公司
- 36.
王志强,王志强:系统发育树重建的一种新方法。生物科学进展,2017,32(4):457 - 461。
致谢
这项工作得到了加拿大自然科学与工程研究理事会和自然与技术基金会的资助,并获得了研究生奖学金
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
DA在项目中进行实验,参与了项目的设计和协调,以及稿件的撰写。RKI构思了这个项目,并为手稿的撰写做出了贡献。所有作者阅读并批准了最终的手稿。
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
黄酮醇6-羟化酶的分子特征及功能表达。BMC植物杂志4,20(2004)。https://doi.org/10.1186/1471-2229-4-20
收到了:
公认:
发表:
关键字
- 黄酮类动物
- 黄酮醇
- 真核表达系统
- 肽序列信息
- 内部肽序列