抽象的
背景
Arabidopsis SKP1样(Ask1)蛋白质作为SKP1-CUL1-F箱(SCF)E3泛素连接酶的亚基。以前的遗传研究表明,Ask1在拟南芥花发育和雄性分裂中起重要作用。然而,含有Ask1的SCF E3泛素连接酶(Ask1-E3s)对花卉蛋白质组和转录组的分子效果是未知的。
结果
在这里,我们通过比较野生型和野生型花芽蛋白质组,鉴定了可能受ASK1-E3s调控的蛋白质问1突变体植物。检测到超过200种蛋白质问1突变体但未在野生型中检测到,>300水平较高问1突变体的RNA水平与野生型无显著差异问1这表明,它们可能在蛋白质水平上受到ASK1-E3s的调控。花的蛋白质组学和转录组学的综合分析问1野生型未覆盖ASK1-E3功能的几个势各,包括转录调节剂,激酶,肽酶和核糖体蛋白的调节,并对ASK1-E3功能在花卉发育中的可能机制的影响。
结论
我们的结果表明,Ask1-E3S在花发育过程中拟南芥蛋白质降解起着重要作用。本研究开辟了对这些候选E3底物的进一步功能研究的新可能性。
背景
泛素-蛋白酶体系统(UPS)在靶向蛋白降解中发挥重要作用,从而调节多种细胞过程[1- - - - - -3.].泛素化反应是由E1泛素激活酶、E2泛素结合酶和E3泛素连接酶的顺序作用催化的。多个泛素分子可以附着在蛋白质底物上已有的泛素片段上形成泛素链,泛素化后的蛋白通常被26S蛋白酶体降解。
UPS调节植物中的许多过程,包括开发和生物/非生物应激反应[1,3.- - - - - -5].这种广泛的功能是由UPS中大量的基因编码组件实现的。植物通常含有少量的E1酶、数十种E2酶和数百种E3连接酶,它们决定了底物的特异性。因此,众多的E3连接酶可以潜在地泛素化许多蛋白质。此外,包括SKP1-CUL1-F-box (SCF)复合物在内的多重E3泛素连接酶的模块化设计极大地增加了可能被特异性泛素化的蛋白质的数量。SCF复合物的亚基是由多基因家族编码的,尤其是F-box蛋白,它是由植物中数百个基因编码的。因此,这些组分的结合可以形成各种SCF复合物,泛素化众多底物蛋白。
遗传研究表明,植物F箱蛋白涉及激素信号传导途径,自我不相容性,发育过程等。在对激素信号传导的重要性蛋白质中,运输抑制剂响应1(TiR1)是植物蛋白和SCF的受体Tir1.泛素连接酶促进AUX/IAA蛋白的降解,这是生长素诱导的基因表达的抑制因子[6- - - - - -9].F-box蛋白CORONATINE INSENSITIVE 1 (COI1)在茉莉酸(JA)信号调控中具有类似的机制;COI1是JA和SCF的受体COI1.使JAZ蛋白不稳定,从而释放转录因子MYC2以激活JAZ响应基因[10.- - - - - -12.].诸如乙烯,赤霉酸(GA)和脱落酸(ABA)的激素的其他信号途径也需要UPS的组分[5].此外,S-LOCUS F箱蛋白(SLF)用作自我不相容性的花粉特异性决定因素[13.- - - - - -16.].不同寻常的花器官(UFO)是重要的正常分生组织的身份和花器官的发展[17.- - - - - -19.].不明飞行物可以与叶子依法互动以激活AP3.表达式[20.- - - - - -22.].
酵母和人的拟南芥同源物SKP1.基因,这拟南芥skp1-like1(ASK1),编码桥接Cullin和F-Box蛋白的SCF子单元[23.].已经表明,Ask1可以与F-Box Proteins UFO相互作用[22.,24.], COI1 [25.],tir1 [6], 和别的 [24.,26.,27.].由于这些F盒蛋白质在不同的途径中具有重要作用,因此Ask1作为SCFS中的关键组分,可能在许多过程中具有至关重要的功能。这提出了之前的遗传研究问1突变体,在雄性减数分裂、花器官发育和营养生长方面有缺陷[23.,28.- - - - - -31.].尽管已经在拟南芥中鉴定了少数SCFS的底物,但它们主要是特定于上述研究的良好的F箱蛋白质。大量其他Ask1相互作用的F箱蛋白及其基材仍然难以捉摸,如含有ASK1的E3调节的生物途径一样。
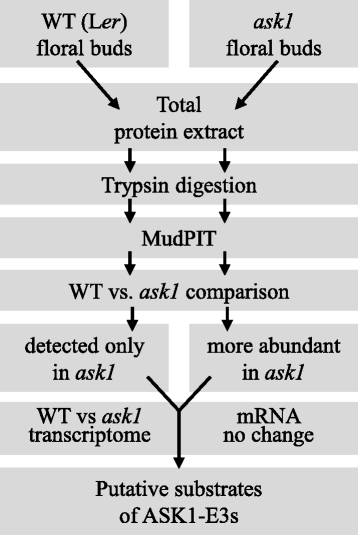
通过蛋白质 - 蛋白质相互作用方法鉴定大多数已知的泛素连接酶底物,通常当F箱蛋白有已知的功能时[10.,32.- - - - - -34.].最近,基于鉴别基因表达,翻译后修饰,疾病标志物发现的各种区域越来越多地应用了质谱(MS)的蛋白质组学方法,以及通过检测遍布泛素蛋白质来鉴定泛素连接酶基质的鉴定[35.,36.],或通过比较野生型(WT)和遍突蛋白连接酶突变体的蛋白质蛋白蛋白质[37.].在这项研究中,我们使用了蛋白质组学方法,多维蛋白质识别技术(Mudpit),以通过比较WT和WT的花芽蛋白质蛋白蛋白(Ask1)识别可能监管的花卉蛋白质问1突变体植物。此外,我们对WT和WT和的比较转录组分析进行了问1花芽来研究Ask1对基因表达的影响。集成的转录组和蛋白质组学分析显示,许多蛋白质可能通过Ask1-E3s调节。我们讨论了几种可能的方法,提问1可能调节蛋白质稳定性和进一步下游基因表达。
结果与讨论
L呃和问1花蕾
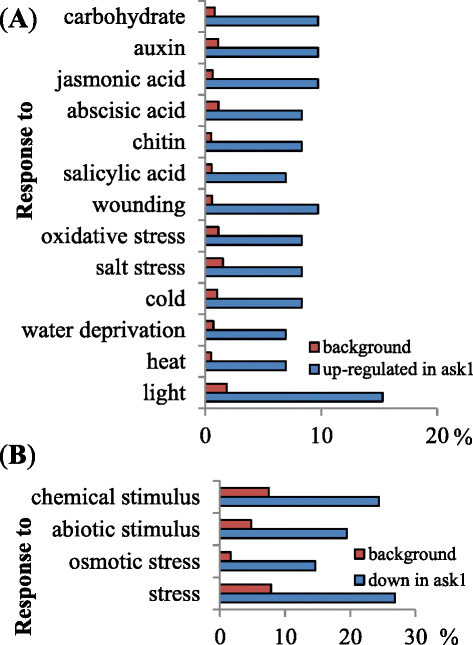
以确定其效果问1在花的转录组上突变,WT (L呃),问1使用GeneChip Arabidopsis Ath1基因组阵列分析了花芽转录om。来自l的平均值呃和问1比较微阵列以发现RNA水平差异至少2倍且学生t检验p值< 0.05的基因。我们发现,有74个基因表达上调,42个基因表达下调问1转录组与l相比呃(附加文件1和2).我们使用agriGO [38.],以确定某些基因类别是否在基因的上/下表达中过多问1.我们发现,对各种刺激或应激反应的氧化石墨烯类别的基因被富集(图。1).在42个下调基因中(包括ASK1)问1, 19个与生物/非生物信号通路相关的基因(表)1),包括激素,光/昼夜戒律,温度,盐和其他信号通路。在74个上调基因中问1, 39个基因被注释参与响应各种生物/非生物信号(见表)2).除了对刺激反应的证据外,大多数这些基因的分子函数还不太了解(例如,寒冷的-调节15A / 15B,暗诱导10,衰老1等),与特征明确的蛋白或蛋白结构域(如HAD超家族酸性磷酸酶、Jumonji域名包含5个,铜般的2等)。
然而,有几个基因已经在功能上表现,包括与生物钟相关的(CCA1),晚细长的幼杆子(LHY.),贾斯莫酸盐-结汇-域蛋白1(jaz1.),JAZ5。CCA1和LHY.编码协同调节拟南芥昼夜节律的myb样转录因子[39.因此,对于与外部环境提示协调内部生理活动非常重要。jaz.JA通过涉及Jaz蛋白和G盒结合MyC2:Jaz蛋白结合并抑制MyC2的活性在没有JA的情况下抑制基因。在JA的感知后,jaz蛋白质在通过SCF ubiquitation后降解COI1.释放的MYC2可以激活下游基因的转录,包括jaz.基因[40].根据这一反馈监管模式,预计会有问1突变会降低SCF活性,使JAZ蛋白积累并抑制MYC2活性,从而降低JAZ转录水平。然而,我们发现jaz1.和jaz5.转录水平意外更高问1突变比wt。该悖论表明,可以参与调节JA信号通路的不表达机制。例如,含有Ask1的SCF可能有助于去除具有诱导表达的能力的尚未识别的转录激活物jaz.在没有Ja的基因;什么时候ASK1被突变这种转录激活剂稳定,从而诱导下游基因的表达,包括jaz1.和jaz5..需要进一步研究来揭示这些监管网络的新方面。
然后,我们分析了在这些上调/下调基因的假定启动子区域中,顺式元件可能过度表达问1转录组。利用拟南芥信息资源(TAIR)的Motif Analysis工具,测定了500 bp和1000 bp假定启动子区域内6-mer Motif的频率(见表2)3.).G-Box(Cacgtg)在上序/下调基因的推定启动子区域中持久化,表明相应的基因可能受到G盒结合转录因子的调节,它们本身或其共同因素可能会受到调节Ask1-E3连接酶,类似于Jaz-Myc2模型。这些转录因素或共同因素中的一些可能是短暂的阻遏物;当它们在没有Ask1的情况下稳定时,然后将其靶基因下调。其他人可以用作不稳定的活化剂,其稳定在没有Ask1的情况下导致下游基因的上调。或者,一些转录因子可能具有双重函数,既有激活和镇压,对于myc2而言是真的[41.,42.].促进剂含有这些顺式元素的基因在转录中改变问1突变体表明相应转录因子的蛋白质水平变化问1.另一个主题,GATAAG(I盒),在下调基因中富集问1.I盒以前被发现在光调节基因的启动子中富集[43.]并是必需的Arabidopsis RBCS-1A表达式[44.].还需要进一步的实验来检验假定的顺式元件是否具有功能,并鉴定将ASK1-E3调控与转录变化联系起来的同源转录因子。
在转录组中的上/下调基因中的生物/非生物应激相关基因的富集问1突变花芽有几个可能的含义。首先,39个生物/非生物胁迫相关基因的上调问1植物的芽(表2)表明这种基因的表达可能严格限制,以避免不必要的表达,以确保对生殖器官的资源连续和最大分配。在WT花芽中,可以通过Ask1-E3介导的泛素灭绝阳性转录调节剂的降解,这些基因的表达可以截止,但胁迫可能阻断这种阳性调节剂的降解。其次,观察到作为压力响应的19个基因被响应于下调问1植物的芽(表1),表明它们参与了正常的花发育。虽然这些基因被解释为对生物/非生物信号有响应,但它们也可能由内源性信号触发,如程序性细胞死亡(如绒毡层退化)和/或花药和花粉发育后期的受控脱水[45.].然而,由于缺乏细胞类型特异性转录组信息,很难确定这些发育控制过程的转录组重编程在多大程度上类似于应激反应。综上所述,ASK1-E3s可能会破坏正常花发育或响应外界刺激时参与信号通路复杂调控的蛋白质的稳定性。
L呃和问1花蕾
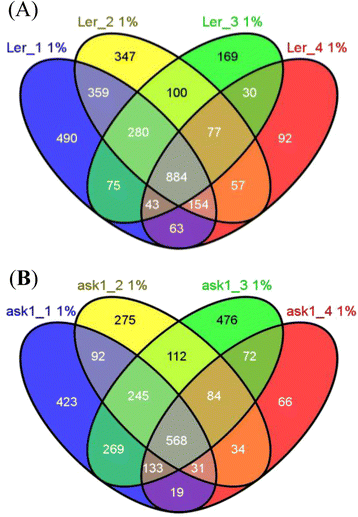
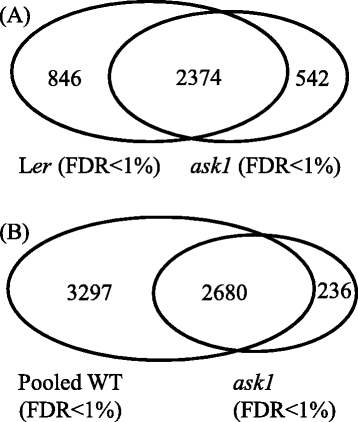
探究…的影响问1在花卉蛋白质组上并鉴定Ask1-E3s的潜在底物,我们使用了无标签的蛋白质组学方法,Mudpit,分析了花芽蛋白质问1突变和L呃(图。2).四L总蛋白提取物呃五问1将花芽样品用胰蛋白酶在溶液中消化,无需预先分离,以最大限度地消化具有不同性质(如疏水性和荷性)和区隔性(胞质、膜、核和细胞器)的蛋白质。泥浆坑运行的4l呃样品(左呃1 ~ L呃_4)分别检测出2348、2258、1658和1400个蛋白,假发现率(FDR) < 1%,(附加文件3.).当合并四个数据集时,将检测到总共3220个非冗余蛋白质。五个跑了五个问1样品(问1_1〜 问1_5)分别检测到1780、1441、1959、1007和363个蛋白,FDR < 1%,(附加文件3.),共2916个非冗余蛋白。的问1_5检测检测到较少的蛋白质,因为开始蛋白质量约为其他蛋白质,以测试较少量的输入蛋白质提取物是否可能导致蛋白质检测的不同效率。当改变原料的量时,试验结果没有显示出检测效率的巨大差异,即检测到的蛋白质的数量与起始蛋白质量成比例。在该测试运行中检测到的363个蛋白质包含在总数中问1蛋白质,但被排除在各个之间的比较,并在以下部分中使用光谱计数标准化。
基于质谱的蛋白质组学的随机采样和检测灵敏度导致了每次实验中整个蛋白质组的部分识别和不同质谱运行的部分重叠数据集。确实,L的分析呃和问1样品产生部分重叠的蛋白质组(图。3.): 3220个L中884个(27.5%)呃所有四个MS运行检测到蛋白质(FDR <1%),通过三毫秒的384(17.2%)蛋白,554(21.2%)蛋白,通过两个MS运行,1096(34.1%)蛋白仅检测一次。在2899中问1蛋白质(独特的蛋白质问1_5不包括在内)、568(19.6%)、493(17.0%)、598(20.6%)和1240(42.8%)蛋白分别用4、3、2和1个MS程序检测到。即使是曾经检测过的蛋白,由于非常严格的MS检测和搜索标准,也具有很高的可信度(FDR < 1%),因此视为已检测。
一些细胞成分类别的蛋白质(如膜蛋白)通常被认为在不使用洗涤剂的情况下很难被质谱检测到,在我们的L呃和问1蛋白质组(附加文件4),表明我们的方法能够检测定位于质膜,细胞器膜和核包围的蛋白质。最小化偏差的一个重要改进是通过胰蛋白酶消化总蛋白质提取物而不分离成可溶性或不溶性部分。虽然经常被认为是糖顽固的蛋白质对酶消化,广泛的超声处理,变性治疗和延长的胰蛋白酶消化似乎具有改善的检测效率。
与先前的蛋白质组学研究相比,检测额外的花蛋白
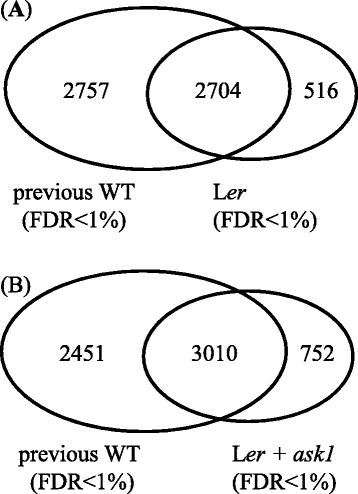
将我们的花芽蛋白质与先前公布的蛋白质组学数据进行比较,我们检测到许多额外的蛋白质(图。4).来自前两项研究的WT花芽蛋白[46.,47.]组合成一个数据集(名为“先前的WT”),其中包含5461个非冗余蛋白(FDR <1%)。与之前的WT相比,额外的516个蛋白仅在我们的升中检测到呃含有3220个非冗余蛋白和另外752个蛋白质的蛋白质组数据集被我们的L检测到呃 + 问1组合含有3762个非冗余蛋白的蛋白质组数据集。这些附加蛋白质的鉴定表明蛋白质组学检测尚未饱和。需要克服生物样品中巨大动态蛋白质的巨大动态范围的能力的开发是必要的,以进一步推动更接近饱和的蛋白质组学鉴定。在此之前,我们必须记住,对我们的蛋白质组学数据有很大的改进空间,并且在从当前数据中得出结论时,我们需要谨慎。
蛋白质只检测到问1或更高的问1
我们的比较问1和L呃蛋白质谱表明,仅发现了542个蛋白质问1(图。5A).这些蛋白质在问1但不是wt,表明他们可能会被推出的问1-E3底物。然而,这些蛋白质的积累仍然可能是间接效应问1突变。由于有限数量的MUDPIT运行不足以使蛋白质组饱和,因此我们不能排除仅在其中检测到某些蛋白质的可能性问1也可以在l中被检测到呃如果更多的MS运行已经完成。为了缩小推定的ASK1-E3基质,我们将我们的L结合在一起呃花芽蛋白质组数据与之前的WT数据[46.,47.得到了一个更大的WT花芽蛋白质组数据集,其中包含5977个蛋白质(汇集的WT)。这个汇集的WT数据集是目前利用MS方法获得的最全面的花芽蛋白质组。WT (L呃)花芽蛋白组数据集的WT聚合蛋白组约53.9%(3220/5977)。通过比较问1和Pooled WT蛋白组,我们发现236个蛋白只检测在问1(问1- 蛋白质);因此,这些更可能是Ask1-E3底物(图。5B.和附加文件5).
我们检测了它们的RNA水平问1-只有来自微阵列数据的蛋白质,以确定转录增加是否有助于这些蛋白质的积累。大多数基因的RNA水平在两组间无显著差异问1和L呃(不符合双折截止值和学生的T-Test P值<0.05)的标准,不同之处在于,11个基因缺乏在ATH微阵列芯片上缺乏探针(附加文件5).因此,在蛋白质水平上,至少有225个蛋白质似乎是由ASK1-E3s控制的。
因为我们使用的是无标记蛋白质组学方法,所以不能直接比较样品之间的蛋白质丰度。相对定量方法之一,光谱计数,已被证明具有更高的重现性,更大的动态范围,与相对蛋白丰度比序列覆盖、肽数和离子色谱方法更强的线性相关性[46.,48.- - - - - -51.].因此,使用报告的光谱计数方法标准化该研究的蛋白质组学数据集[46.]和L呃和问1找到322个丰度更高(截断值为1.5倍)的蛋白质问1(问1-更高;附加文件6).以前的WT数据不包括在内,因为它们由不同的蛋白质组学方法生成,并且难以与我们的数据定量比较。我们从微阵列数据中提取了RNA表达值的这些问1-higher蛋白质,以确定它们是否升高的蛋白质水平是由于转录水平增加(附加文件6).只有2G33380的RNA水平才能高2.2倍问1比L.呃.其他基因的RNA水平无显著差异问1和L呃,只有12个基因在微阵列芯片上没有探针,这表明至少309个问1-higher蛋白可能在蛋白质水平上调节。
ASK1在多个水平调节调节蛋白的丰度
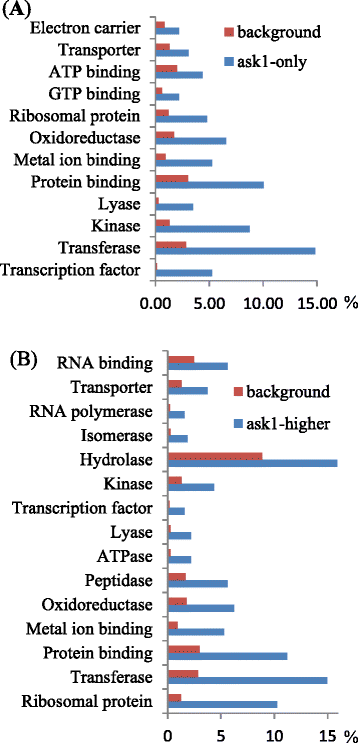
分类问1- 而且和问1-higher蛋白表明,一些分子功能类别是过度持久的(Fisher试验P值<0.05)(图。6).由于调节蛋白通常受到UPS的影响,因此某些类别特别感兴趣,包括转录调节剂,激酶和肽酶/蛋白酶。有趣的是,许多核糖体蛋白也被发现积累问1表明UPS在核糖体蛋白的翻译规则或外蛋白酶函数中的可能作用。
Ask1-E3S影响转录调节因素的水平
的问1突变影响了19种转录因子和染色质重塑者,包括一些功能信息(表4).其中一个是JAZ9,它可能在JA信号通路中作为MYC转录因子的抑制因子[52.],与财务报表一致COI1.JAZ蛋白的-依赖泛素化和随后对JA感知的降解[10.- - - - - -12.].另一种蛋白质检测到问1是碱性螺旋-环-螺旋(bHLH)转录因子MYC3,它与JAZ蛋白相互作用,并与MYC2和MYC4共同激活JA应答[53.,54.].MYC3与g -box结合[53.],可能会用G箱调节启动子,包括一些表现出改变表达的基因问1,g -box在基因启动子中表达的改变问1如第一节所述(表3.).JAZ9和MYC3在问1蛋白质组提出了jazs和mycs的蛋白质稳定性的可能性由UPS调节,在JA信号通路中添加另一层调节。此外,八种锌指转录因子和其他类型的转录因子(表4)也表现出升高的蛋白质水平问1,表明,通过Ask1-E3S对这些转录因子的破坏性可能对花卉发育可能很重要。
的问1突变还导致Polycomb组蛋白SWINGER (SWN)水平升高(见表1)4),与其他Polycomb组蛋白相互作用,抑制蛋白的表达开花基因座C.(方法)并控制endosperm发展的启动[55.- - - - - -57.].升高的SWN蛋白水平预计会抑制方法表达。虽然我们问1和L呃花芽转录组数据无显著差异方法表达,我们未发表的花药转录组数据显示,平均微阵列值方法是68和251(由R包RMA标准化的原始微阵列数据)问1和L呃花药转录组,分别,即方法水平较低问1花药比L呃花药(普通学生的t-test p-value = 0.04)。的下调方法在问1花药转录组表明,在显影化学物体中的SWN蛋白质的降解通常正在DEREPREST其靶基因包括方法.另一个受影响的染色质重塑蛋白质是早期开花6(REF6)的相对于组蛋白H3赖氨酸27去甲基酶[58.并正调控开花和油菜素内酯信号[59.].我们的研究结果表明,ASK1-E3s可能通过促进序列特异性DNA结合转录因子和染色质重塑因子的降解来调节基因的转录。
Ask1-E3会影响核糖体蛋白
有趣的是,许多核糖体蛋白仅鉴定或更高的水平问1(桌子5),表明ASK1-E3s也可能在翻译调控中发挥作用。已对几种核糖体蛋白进行了遗传学研究:60.];捎带1影响叶血管图案[61.];OLIGOCELLULA7参与核糖体生物发生和器官大小控制[62.];和pointerfirst LEAF2在早期叶片发育中起作用[63.].核糖体蛋白可以通过Ask1-E3s进行核糖体变换,或用于核糖体的转换,或用于外骨体调节目的。有人提出,核糖体蛋白可以通过自噬用于选择性降解核糖体[64.,65.].所以,核糖体蛋白的积累问1可能是由Ask1-E3s和随后的自噬失败的ubiquitination失败。先前的研究表明,在温度胁迫条件下,需要与ASK1相互作用的F型盒蛋白7(FBP7),但未确定该F箱蛋白的基材[66.].F-box蛋白,如FBP7,可能通过特定核糖体蛋白的泛素化调控翻译。我们的研究结果表明,ASK1-E3s可能广泛参与了翻译的调控。
或者,核糖体蛋白可以具有外蛋白酶官官能团,其通过前一种发现的例子,即几种核糖体蛋白可以阻断核糖体应激后肿瘤抑制器P53的泛素化[67.].因此,核糖体蛋白在问1可能作为调节蛋白,其自身可能受泛素介导的蛋白质水解调控。需要进一步研究核糖体蛋白和E3泛素连接酶之间的遗传和分子相互作用,以阐明UPS在翻译调控中的作用。
很难排除这些核糖体蛋白的积累可能是药物的副作用问1突变。自问1是一个稳定的突变体,长期和大规模的蛋白质降解干扰可能会施加胞内应激,进而影响核糖体的生物合成、活性或周转。因此,需要更多的研究来阐明蛋白质降解和核糖体蛋白功能之间的联系。
ASK1-E3s影响蛋白质活性调节因子
累积了许多激酶问1蛋白质组(表6),包括一些对植物对各种刺激的反应很重要的基因。其中,钙依赖蛋白激酶6 (CALCIUM-DEPENDENT PROTEIN KINASE 6, CPK6)是盐/干旱胁迫耐受性的正调节因子[68.,保卫细胞茉莉酸甲酯信号[69.]和ABA保护细胞离子通道的调节[70].此外,LYSM结构域受体样激酶1 (LYSM RLK1)参与几丁质介导的植物先天免疫[71.,72.]并映射激酶激酶2(MKK2)调节冷和盐应激信号和先天免疫[73.- - - - - -75.].我们的结果表明,在正常的花发育过程中,ASK1-E3s通常会使这些激酶不稳定,可能在缺乏刺激的情况下抑制生物/非生物胁迫反应。
还有影响的是两个细胞周期调节剂,细胞周期蛋白依赖性激酶细胞分裂控制2(CDC2)和Cyct1; 5。雄性配子需要CDC2 [76.].CYCT1;5是参与花椰菜花叶病毒感染、植物生长和发育的周期素依赖激酶C复合物的一个亚基[77.].细胞周期调节器的积累问1可能会影响有丝分裂和/或减数,如此调查结果所提出的问1突变植物的细胞数量减少,雄性减数分裂有缺陷[23.,28.- - - - - -31.].及时去除细胞周期调节剂可能是ASK1调控植物发育的重要功能之一。
我们还发现SNF1相关蛋白激酶1.2(SNRK1.2)/ SNF1激酶同源物11(KIN11),其据报道在磷酸盐饥饿期间降解[78.],积累在问1蛋白质组。SnRK1.2/KIN11也被证明与ASK1相互作用[79.].这些发现表明,ASK1可能在没有F-box蛋白的情况下直接将SnRK1.2/KIN11招募到Cul1,导致SnRK1.2/KIN11的泛素化和降解。另外,F-box蛋白也可能与ASK1和SnRK1.2/KIN11相互作用,形成一个泛素化SnRK1.2/KIN11的SCF复合物。
其他激酶在很大程度上是未知的,但可能在信号感知和转导中具有重要的功能。例如,AT5G43020和AT3G14350含有跨膜结构域,可能是膜受体激酶。综上所述,这些激酶水平的升高表明,ASK1-E3s负调控这些蛋白激酶的水平,从而控制细胞周期、植物免疫、激素信号转导等过程。
ASK1-E3影响蛋白质稳定性调节因子
肽酶在问1——蛋白质(表7),表明Ask1-E3s可以调节肽酶的降解,这反过来影响蛋白质加工或营业额。四种肽酶(AT1G53850,AT5G66140,AT1G77440和AT3G60820)是20S蛋白酶体α/β亚基的同种型,表明蛋白酶体核心复合物也可以由UPS调节。还检测到两种泛素特异性蛋白酶泛素特异性蛋白酶5(UBP5)和UBP6问1-更高的蛋白质,这表明去泛素酶,对抗蛋白质泛素化,可能也被UPS调控。BRI1 SUPPRESSOR 1 (BRS1)是一种分泌的丝氨酸羧肽酶,可能通过加工某些蛋白质参与油菜素内酯信号[80].除了来自表达和同源性的信息外,其他肽酶大部分是未知的。肽酶/蛋白酶在正常情况下可能受到ASK1-E3s的负调控,从而将肽酶介导的蛋白加工或降解与UPS耦合。
ASK1调控基因表达的可能方式
通过对转录组和蛋白质组数据的综合分析,我们发现,ASK1-E3s可能在转录、翻译和翻译后调控多个步骤中调控基因表达。ASK1-E3s可能会破坏转录抑制因子或激活因子的稳定性,从而分别抑制或失活基因转录(图1)。7A).在没有ASK1的情况下,这些转录抑制子或激活子的积累分别导致基因转录的下调或上调。然而,我们不能排除改变转录组和蛋白质组的可能性可能是间接后果问1突变。
蛋白质积累在问1可能是ASK1-E3的直接底物,也可能是由ASK1-E3底物稳定的(图1)。7B.).例如,泛素特异性蛋白酶UBP5和UBP6,它们在问1蛋白质组(表7),可能是Ask1-E3S的基质;UBP5和UBP6可以脱催,并防止泛素蛋白质的降解,其蛋白质水平随后增加问1.人类的一个例子是疱疹病毒相关的泛素特异性蛋白酶(HAUSP),它通过去泛素化来稳定肿瘤抑制因子p53 [81.].核糖体蛋白可能有一个相似的机制:核糖体蛋白在问1可能增加蛋白质合成;或者,如果核糖体蛋白具有外蛋白调节功能,它们可以以与人类稳定P53的那些类似的方式稳定一些蛋白质[67.].
在另一种可能的情况下,Ask1-E3s可能使一些蛋白水解酶(例如,E3泛素连接酶或肽酶)破坏,这可以降解其他蛋白质(图。7C.),形成双重负调控级联。蛋白质水解酶在体内的积累问1可能导致其蛋白水解基质的降低。蛋白酶体亚基和肽酶积聚在问1可能与它们底物蛋白的降解有关,在问1蛋白质组(附加文件7).然而,由于缺乏蛋白水解酶的功能信息,仍然难以鉴定这些蛋白水解基质。
受ASK1-E3s调控的蛋白质可能比本研究中发现的蛋白质更多。例如,研究充分的F-box蛋白TIR1和COI1的底物除JAZ9外未检测到4).一个可能的原因是,由于技术限制,MS可能没有发现低水平和/或时空限制表达的蛋白(例如,假定UFO基质,叶,主要表达在花序分生组织和花分生组织中[20.- - - - - -22.]),并且当F箱蛋白质的基板进行降解时。另一个重要原因是21的功能冗余问拟南芥家族成员。自ASK1基因在整个植物中表达,在种植体中较高,其突变预期在许多植物器官中引起更多缺陷。然而,实际缺陷比预期更温和,可能是由于冗余问家庭成员。的ASK2基因是最密切相关的基因ASK1.单个突变体ask2.类似于wt植物,但是问1 ask2双突变体在胚胎发育中有严重缺陷,在种子萌发后不久即致死[82.].这表明Ask1与Ask2的冗余和可能其他询问蛋白质可能已经掩盖了Ask1功能的一些方面。换句话说,一些ASK1-E3底物也可能被含有其他询问蛋白(例如Ask2-E3s)的SCFS泛染,因此将无法积累问1蛋白质组。这也可能解释为什么在我们的MS数据中没有识别出F箱蛋白(TiR1和Coi1)的大部分众所周知的底物。
例如,我们的Ask1功能的一个新方面是通过对女性生育率的分析来揭示的问1突变体,据报道,据据报道,以前的研究是女性肥沃[23.,28.- - - - - -31.].我们装载了过量的WT (L)呃)花粉到耻辱问1突变体,功能障碍Tapetum 1(dyt1)突变体(作为男性不育和女性不育的对照)[83.),和L呃(作为自我授粉控制),最后我们计算了每个SILIQUE的成熟种子(附加文件8).结果清楚地表明,授粉问1雌蕊产生的种子显着较少(平均地为16.0种子/硅基)呃(平均52.5粒/角果)dyt1(平均52.0种子/ Silique)(学生的T-Test P值<0.01);虽然授粉dyt1雌蕊产生了类似的种子作为l呃(学生t检验p值> 0.05)。这一发现表明了ASK1在拟南芥雌性生殖发育中的一个先前未被认识到的作用。研究ASK1功能的隐藏方面将需要多个组织特异性沉默问家庭成员,或组织特异性ASK1互补的问1 ask2双突变体或更高阶突变体。此外,通过对泛素化蛋白组的表征,可以识别E3泛素连接酶的潜在底物和每个蛋白的泛素化位点,为ASK1在相关过程中的功能提供额外的线索。
结论
蛋白质降解是各种生物过程的一个组成部分。由于它选择性地降解了蛋白质,因此UPS特别感兴趣,包括许多细胞途径的许多关键调节剂[1- - - - - -3.].然而,搜索E3泛素连接酶的特定底物难以造成底物蛋白的快速降解,一旦通过E3泛素连接酶多聚合,E3S和衬底之间的相对较弱的相互作用,较窄的时空窗口发生,即E3-Subdate相互作用,和别的。
在本研究中,我们利用一个缺乏功能的拟南芥突变体寻找潜在的E3底物ASK1编码SCF型E3泛素连接酶的关键组分的基因,具有发育缺陷,特别是在包括花瓣和花药的花动器官中[23.,28.- - - - - -31.].我们雇用了一种基于MS的方法,Mudpit,探索花芽蛋白质和检测到的2916和3220蛋白问1和WT蛋白组。通过对比问1通过聚合WT花芽蛋白质组(我们的WT花芽蛋白质组结合了两个已发表的WT花芽蛋白质组),我们发现了236个独特的蛋白质问1蛋白质组和322个蛋白质,水平较高问1蛋白质组。在没有ASK1-E3s的情况下,这些蛋白的积累表明,它们可能被ASK1-E3s作为目标蛋白在WT中降解问1和WT的花蕾表明,编码蛋白质中积累的蛋白质的基因的转录物问1蛋白质组没有明显的影响问1突变,表明这些蛋白质在蛋白质水平上调节,因此更可能是Ask1-E3s的候选底物。功能分类显示,ASK1-E3S的许多潜在底物涉及转录,翻译,蛋白质磷酸化和蛋白质降解的调节。这表明Ask1在调节植物开发方面的多方代作用。需要更多的工作来验证这些候选E3底物并调查其特定的分子功能。
方法
植物材料和生长条件
的拟南芥蒂利亚纳生态型Landsberg.erecta.(L.呃),问1L内的突变体呃背景 [23.使用过。植物在生长室中的土壤(地铁混合360,Sun Gro园艺,Bellevue,Wa)上生长,温度为23°C和漫长的一天条件(16小时光和8小时黑暗)。的问1突变体植株是从后代中选择的ASK1/问1杂合植物通过它们的异常表型,包括降低的植物大小与相同年龄的WT植物相比,降低数量和/或降低的花瓣,无菌花药,短细丝和短的单片机。来自主要花序的未开封的花蕾(从花序绩效到最大未开芽)的簇问1突变和L呃均采自约有5朵开放花的植物。
微阵列分析
l呃和问1使用Nucleospin®RNA植物套件(Macherey-Nagel,Bethlehem,PA)提取花芽总RNA。在Agilent 2100 BioAnalyzer(Agilent Technologies,Santa Clara,CA)上进行RNA质量分析,由Agilent 2100专家软件控制,使用RNA 6000纳米试剂盒协议的植物RNA纳米测定。在Penn State Genomics核心设施 - 大学公园,PA的GeneChip Arabidopsis Ath1基因组阵列(Affymetrix,Santa Clara,CA)进行了微阵列。三个生物复制问1和l的四个生物重复呃进行了(附加文件9).
如前所述,进行了数据分析,如前所述进行了一些修改[84.].MicroArray数据集(.cel文件)由R包RMA标准化,并导出为Excel文件。微阵列信号值从每个基因型的生物复制平均并比较问1和L呃寻找RNA水平差异至少2倍且p值< 0.05的差异表达基因(常规学生t检验)。GO分类采用agriGO的奇异富集分析(SEA) [38.].选择Affymetrix ATH1基因组阵列(GPL198)作为背景参考,其中包含22479个注释基因。统计检验为Fisher,显著性水平为0.05。
用三氯乙酸/丙酮法提取蛋白质
蛋白质提取方法是在以前的研究基础上改进的[85.].花芽用研钵和杵在液氮中彻底粉碎,粉末悬浮在-20°C的丙酮中,10% w/v三氯乙酸(TCA)和0.07% (v/v) β-硫醇(0.3 g组织粉1ml)。蛋白悬液-20℃孵育2 h(或过夜)后14000 rpm离心15-20 min。去除上清液,重悬蛋白颗粒,用1 ml -20℃含0.07% (v/v) β-巯基乙醇的丙酮洗涤,14000 rpm离心15-20分钟。重复这一洗涤步骤,直到颗粒几乎变成白色。将蛋白球真空干燥5-10分钟,-20℃保存或立即用于胰酶消化。
溶液中胰蛋白酶消化蛋白质提取物
将来自TCA /丙酮方法的约20-30mg粗蛋白质提取物重悬于1ml再水合缓冲液中[100mM NH4HCO3.使用Branson Sonifier s - 450a (Branson Ultrasonics, Danbury, CT),超声5次,每次20秒,占空比40%,功率3。蛋白在60°C下变性45-60分钟,在37°C下用50 mM碘乙酰胺烷化30分钟。加入40 μl 1 M DTT猝灭烷基化反应。将烷基化蛋白用20 μg质谱级胰蛋白酶金(Promega, Madison, WI)在37℃适度摇匀消化16-18 h。12,000 rpm离心10分钟,清除剩余不消化的碎屑。将上清液转移到新的1.5 ml管中,再次离心清除残留碎屑。将上清转移到新的1.5 ml试管中,用冰醋酸调节pH至3.0。肽溶液被真空完全干燥以蒸发掉nhh4HCO3.和乙腈。将颗粒重悬于200 μl H2真空干燥。共重复3次重悬干燥。最后,在宾夕法尼亚州立大学医学院的蛋白质组学和质谱核心设备中对这些肽进行分析。
质谱分析/ MudPIT
使用4800蛋白质组分析仪MALDI TOF/TOF串联系统(Applied biosystems),根据之前发布的2D LC-MALDI分离和分析程序,用MudPIT分析胰蛋白酶消化的肽样品[86.]除了几种修改。蛋白质页洛特软件版本4.2用于通过搜索包含包括的蛋白质数据库的MS光谱来进行蛋白质鉴定拟南芥蒂利亚纳蛋白质列表TAIR10_pep_20101214, 156种常见的人类和实验室污染物(absciex_污染物db_20070711),以及蛋白质数据库本身的反向“诱饵”版本(连接的反向诱饵数据库)。检测到的局部FDR < 1%的蛋白被接受(附加文件10.,11.,12.,13.,14.,15.,16.,17., 和18.).
蛋白质组学数据分析
我们结合了检测到的蛋白质问1样品进入问1蛋白质组,L中检测到的组合蛋白质呃到L呃蛋白质组。我们首先比较了问1和L呃发现蛋白质仅检测到的蛋白质问1样品。我们还获得了以前公布的野生型蛋白质组学数据拟南芥蒂利亚纳花蕾[46.,47.[将它们组合成含有5461个非冗余蛋白的“先前的WT”蛋白质组(FDR <1%)。我们的l比较呃和问1蛋白质组与先前的WT蛋白质组导致我们数据中的额外花卉蛋白质。我们结合了我们的l呃花芽蛋白质组与之前的WT蛋白质组[46.,47.转化为由5977个非冗余蛋白组成的“聚合WT”蛋白质组。我们的比较问1蛋白酶蛋白组导致鉴定被认为是“的蛋白质问1只有“蛋白质。
由于通过单独进行泥浆分析每个样品而没有标记和复用,因此在不同样品中不能直接比较每种蛋白质的丰度。相反,使用如前所述的光谱计数方法归一化样品中每种蛋白质的相对丰度[46.,48.- - - - - -51.,87.].用以下公式计算表示蛋白质归一化相对丰度的光谱计数值:
“蛋白质k的测量光谱”是实际检测到的MS光谱的数量与蛋白质K.
“数据集中所有蛋白质的测量光谱”是一个样品中蛋白质的测量光谱的总和。
“数据集中所有蛋白质的理论肽”是数据集中所有蛋白质的理论肽的总数在Silico.在一个样品中检测到的所有蛋白质的胰蛋白肽。的在Silico.胰蛋白酶消化是使用来自银河平台的“消化”工具(https://usegalaxy.org/).由于胰蛋白酶通常不切割赖氨酸(K)或精氨酸(R)残基后,如果它后跟脯氨酸(P),我们指定这些位点为非切割位点。部分酶切和含有一个以上潜在剪切位点的片段不包括在内。含有至少6个氨基酸残基的肽被认为是理论肽。
“蛋白质K的理论肽”是在上述“数据集中所有蛋白质的理论肽”中确定的蛋白质K的胰蛋白酶肽数。
对于在两者中检测到的蛋白质问1和L呃样本,其光谱计数值平均为问1和L呃分别样品。然后是蛋白质的平均光谱计数问1和L呃比较样品。平均光谱计数值的蛋白质问1样品在l中至少为1.5倍呃样本被认为是“问1——“蛋白质。
可获得的支持数据
支持本文结果的数据集包含在文章和其附加文件中。使用登录号GSE42841,原料微阵列数据集沉积在国家生物技术信息(NCBI)基因表达式综合征(Geo)中。
缩写
- ASK1:
-
拟南芥skp1-like1
- SCF:
-
SKP1-CUL1-F盒
- 问1-E3S:
-
含ask1的SCF E3泛素连接酶
- UPS:
-
Ubiquitin-proteasome系统
- TIR1:
-
转运抑制剂反应1
- COI1:
-
冠状素不敏感1
- JA:
-
茉莉酸
- GA:
-
赤霉酸
- 阿巴:
-
脱盐酸
- SLFs:
-
S-locus盒蛋白质
- 不明飞行物:
-
不寻常的花卉器官
- 多发性硬化症:
-
质谱分析
- Mudpit:
-
多维蛋白鉴定技术
- CCA1:
-
与生物钟相关的
- LHY:
-
晚细长的幼杆子
- Jaz1:
-
jasmonate-zim-域蛋白1
- TAIR:
-
拟南芥信息资源
- 罗斯福:
-
假发现率
- WT:
-
野生型
- bhlh:
-
基本螺旋循环螺旋
- SWN:
-
横吐
- 方法:
-
开花基因座C.
- REF6:
-
早开6的相对
- FBP7:
-
盒蛋白7
- CPK6:
-
钙依赖蛋白激酶6
- LYSM RLK1:
-
Lysm结构域受体样激酶1
- MKK2:
-
Map激酶激酶2
- CDC2:
-
细胞分裂周期2
- SnRK1.2:
-
SNF1相关蛋白激酶1.2
- KIN11:
-
SNF1激酶同源物11
- UBP:
-
泛素特异性蛋白酶
- BRS1:
-
BRI1抑制器1
- Hausp:
-
Herpesvirus相关的泛素特异性蛋白酶
- DYT1:
-
功能障碍Tapetum 1
- l呃:
-
兰茨贝格erecta.
- 海:
-
奇异富集分析
- NCBI:
-
国家生物技术信息中心
- 地理:
-
基因表达综合
- 柠檬酸:
-
三氯乙酸
- DTT:
-
二硫苏糖醇
参考文献
- 1。
Smalle J,Vierstra Rd。泛素26S蛋白酶体蛋白水解途径。Annu Rev植物Biol。2004; 55(1):555-90。
- 2。
Sorokin AV, Kim ER, Ovchinnikov LP。蛋白质降解和加工的蛋白酶体系统。生物化学(莫斯科)。2009; 74(13): 1411 - 42。
- 3.
许维海默,刘伟杰,杜曼等。蛋白质稳定性及其与植物生长发育的关系。方法:中华医学杂志2009;479:147-71。
- 4.
Drieher K,Callis J.泛素,激素和植物生物胁迫。Ann Bot。2007; 99(5):787-822。
- 5。
石材SL,Callis J.泛素连接酶通过促进蛋白死亡来调解生长和发展。CurrOp植物BIOL。2007; 10(6):624-32。
- 6。
灰色WM,Del Pozo JC,Walker L,Hobbie L,Risseeuw E,Banks T等人。鉴定生长素响应所需的SCF泛素 - 连接酶复合物拟南芥蒂利亚纳.基因开发。1999; 13(13):1678-91。
- 7。
灰色wm,kepinski s,rouse d,Leyser o,Estelle M.植物素调节SCFTir1.- Aux / IAA蛋白的依赖性降解。自然。2001; 414(6861):271-6。
- 8。
拟南芥F-box蛋白TIR1是一种生长素受体。大自然。2005;435(7041):446 - 51。
- 9。
Dharmasiri N,Dharmasiri S,Estelle M. F-Box蛋白TiR1是一种植物受体。自然。2005; 435(7041):441-5。
- 10。
Thines B,Katsir L,Melotto M,Niu Y,Mandaokar A,Liu G,等。Jaz Repressor Proteins是SCF的目标COI1.复杂的茉莉酸信号。大自然。2007;448(7154):661 - 5。
- 11.
徐丽华,刘福强,李志强,马辉,等。自洽场的COL1.乌比特蛋白 - 连接酶复合物是拟南芥中的己酸酯反应所必需的。植物细胞。2002; 14(8):1919-35。
- 12.
王志强,王志强,王志强,等。COI1连接茉莉酸信号和育性到拟南芥的SCF泛素连接酶复合物。植物j . 2002; 32(4): 457 - 66。
- 13。
华Z,孟X,高钍。相对比矮牵牛灌输S-Locus F-box蛋白(Pi SLF)具有类似于Pi SLF的蛋白,揭示了其在S-RNase自交不亲和中的独特功能。植物细胞。2007;19(11):3593 - 609。
- 14。
华诗,高钍。鉴定和表征含有含有S-RNase的自相色谱的含有诱导的诱饵S-LOCUS F箱F箱的组分的组分。植物细胞。2006; 18(10):2531-53。
- 15。
王宁,华志,孟X,高天祥。Petunia inflata S-locus F-box蛋白PiSLF2和pislf样蛋白PiSLFLb-S2之间的两个嵌合蛋白的功能特征。acta botanica sinica(云南植物学报),2010;47(3):457 - 461。
- 16。
赖Z,MA W,Han B,梁L,张Y,Hong G等。与Antirrhinum的自相相同相关的F型箱基因特异性在花粉和绦虫中表达。植物mol biol。2002; 50(1):29-42。
- 17。
Ingram GC,Goodrich J,Wilkinson MD,Simon R,Haughn GW,Coen Es。平行之间不寻常的花卉器官和Fimbriata这些基因控制着拟南芥和金鱼草的花发育。植物细胞。1995;7(9):1501 - 10。
- 18。
威尔金森MD,Haughn GW。不寻常的花卉器官控制拟南芥的分发形式和器官原序命运。植物细胞。1995年; 7(9):1485-99。
- 19。
莱文jz,梅耶罗茨em。不明飞行物:一种参与花分生组织和花器官发育的拟南芥基因。植物细胞。1995;7(5):529 - 48。
- 20.
Chae E,Tan Qk,Hill Ta,爱尔兰VF。拟南芥F箱蛋白作为调节花卉发育的转录配偶因子。发展。2008; 135(7):1235-45。
- 21.
李我,沃尔夫ds,nilsson o,weigel d。a叶子co-regulator编码的不寻常的花卉器官.咕咕叫医学杂志。1997;7(2):95 - 104。
- 22.
Samach A,Klenz Je,Kohalmi Se,Risseeuw E,Haughn GW,Crosby WL。的不寻常的花卉器官基因拟南芥蒂利亚纳是普通图案化和花卉公司生长所需的F箱蛋白。工厂J. 1999; 20(4):433-45。
- 23.
杨敏,胡颖,罗迪,马海峰拟南芥skp1-like1基因在雄性减数分裂中起重要作用,并可能控制同源物的分离。中国科学(d辑:地球科学)1999;96(20):11416-21。
- 24。
Takahashi N,Kuroda H,Kuromori T,Hirayama T,Seki M,Shinozaki K,等。表达与相互作用分析拟南芥Skp1- 相关的基因。植物细胞生理。2004; 45(1):83-91。
- 25。
acta optica sinica, 2010, 31(3): 362 - 362 .戴丽,徐丽,黄东,李昕,罗凯,关春华。拟南芥雄性不育所需COI1的物理作用。中国科学C辑:生命科学,2002;45(6):631-6。
- 26。
Woo HR,Chung Km,Park JH,Oh Sa,Ahn T,Hong Sh,等。Ore9,一种调节拟南芥叶片衰老的F箱蛋白。植物细胞。2001; 13(8):1779-90。
- 27。
Han L, Mason M, Risseeuw EP, Crosby WL, Somers DE. SCF的形成ZTL适当调节昼夜时机需要复杂。工厂J. 2004; 40(2):291-301。
- 28。
赵d,yu q,陈m,ma h.的ASK1基因调节B函数基因表达与合作不明飞行物和叶子在拟南芥中。发展。2001; 128(14):2735-46。
- 29.
赵丹丹,杨旭,全立,马海涛,等。ASK1,一个SKP1.在拟南芥减数分裂过程中,核重组、突触前同源物的并列和内聚蛋白的合理分布是必需的。植物学报。2006;62(1-2):99-110。
- 30.
赵D,杨米,索拉瓦j,ma h.的ASK1基因调节发展并与之互动不明飞行物基因控制拟南芥花器官身份。dev genet。1999年; 25(3):209-23。
- 31。
赵德,汉T,risseeuw e,crosby wl,ma h.保护和差异ASK1和ASK2雄性减数分裂时期的基因功能拟南芥蒂利亚纳.植物mol biol。2003; 53(1-2):163-73。
- 32。
Jin J,Ang XL,Shirogane T,WADE HARPER J. F箱蛋白基材的鉴定。方法酶。2005; 399:287-309。
- 33。
陈明敏,林慧杰,陈志强。SCF(FBXO22)通过靶向组蛋白去甲基化酶KDM4A介导的蛋白酶体降解,调控组蛋白H3赖氨酸9和36的甲基化水平。细胞生物学杂志。2011;31(18):3687-99。
- 34。
一个f,赵q,ji y,li w,姜z,yu x等。乙烯诱导的乙烯短敏感3和EIN3样的稳定化通过Ein3结合F箱1和2的蛋白酶体降解介导,所述丙烯盒1和2中需要拟南芥ein2。植物细胞。2010; 22(7):2384-401。
- 35。
Igawa T,Fujiwara M,Takahashi H,Sawasaki T,Endo Y,Seki M,等。拟南芥幼苗中泛素相关蛋白的分离与鉴定。J Exp Bot。2009; 60(11):3067-73。
- 36。
MAOR R,JONES A,NUHSE TS,Studholme DJ,Peck SC,Shirasu K.多维蛋白质识别技术(Mudpit)植物中染色蛋白质的分析。Mol细胞蛋白质组学。2007; 6(4):601-10。
- 37。
Burande CF,Heuze ML,Lamsoul I,Monsarrat B,UttenWeiler -Joseph S,Lutz PG。无标记的定量蛋白质组学策略,用于鉴定靶向蛋白酶体降解的E3泛素连接酶底物。Mol细胞蛋白质组学。2009; 8(7):1719-27。
- 38。
杜Z,周X,Ling Y,Zhang Z,Su Z. Agrigo:农业社区的GO分析工具包。核酸RES。2010; 38(Web服务器问题):W64-70。
- 39。
张晓东,张晓东,张晓东,等。拟南芥昼夜节律钟ASSOCIATED1和LATE longated HYPOCOTYL在拟南芥昼夜节律钟中的协同作用[j]。植物杂志。2009;150(2):834 - 43。
- 40.
陈志强,陈志强,陈志强,等。JAZ家族的阻遏子是茉莉酸信号通路中缺失的一环。自然。2007;448(7154):666 - 71。
- 41.
Yadav V, Mallappa C, Gangappa SN, Bhatia S, Chattopadhyay S.拟南芥中一个基本的螺旋-环-螺旋转录因子MYC2,作为蓝光介导的光形态形成生长的抑制因子。植物细胞。2005;17(7):1953 - 66。
- 42.
薛广平,薛广平,王志强,等。MYC2在拟南芥中不同程度地调节茉莉酸依赖的功能。植物细胞。2007;19(7):2225 - 45。
- 43.
Giuliano G,Pichersky E,Malik VS,Timko MP,Scolnik Pa,Cashmore AR。植物光调节基因上游的一种进化蛋白质结合序列。Proc Natl Acad Sci U S A. 1988; 85(19):7089-93。
- 44.
唐纳德rg,cashmore ar。G盒或i盒子序列的突变深刻地影响来自的表达Arabidopsis RBCS-1A启动子。Embo J. 1990; 9(6):1717-26。
- 45.
罗杰斯HJ。在花卉器官中编程的细胞死亡:如何以及为什么花病?Ann Bot。2006; 97(3):309-15。
- 46.
等。公司蛋白质组学揭示了拟南芥蒂利亚纳基因模型和蛋白质组动力学。科学。2008;320(5878):938 - 41。
- 47.
冯波,李玲,周晓霞,马海涛。拟南芥花蛋白组分析:2000多个蛋白的检测和翻译后修饰的证据。acta botanica yunnanica(云南植物研究). 2009;51(2):207-23。
- 48。
Washburn MP,Wolters D,Yates 3RD JR。多维蛋白质识别技术大规模分析酵母蛋白质组。NAT BIOTECHNOL。2001; 19(3):242-7。
- 49。
刘H,Sadygov Rg,Yates第3 Jr。霰弹枪蛋白质组学中相对蛋白质丰度的随机抽样与估算模型。肛门化学。2004; 76(14):4193-201。
- 50。
Florens L,Carozza MJ,Swanson Sk,Fournier M,Coleman Mk,Workman JL等。使用霰弹枪蛋白质组学分析染色质改造复合物,归一化光谱丰度因子。方法。2006; 40(4):303-11。
- 51。
Paoletti AC,Parmly TJ,Tomomori-Sato C,Sato S,Zhu D,Conaway RC等。不同型光谱丰度因子的不同哺乳动物介质复合物的定量蛋白质组学分析。Proc Natl Acad Sci U S A. 2006; 103(50):18928-33。
- 52。
Mosblech A, Thurow C, Gatz C, Feussner I, Heilmann I.通过COI1感知茉莉酸涉及到肌醇聚磷酸盐拟南芥蒂利亚纳.工厂J1111; 65(6):949-57。
- 53。
Fernandez-Calvo P,Chini A,Fernandez-Barbero G,Chico JM,Gimenez-Ibanez S,Geerinck J,等。拟南芥BHLH转录因子Myc3和Myc4是Jaz阻遏物的目标,并在激活茉莉酸盐的反应中与MyC2加剧。植物细胞。2011; 23(2):701-15。
- 54。
程志强,孙磊,齐涛,张斌,彭伟,刘勇,等。bHLH转录因子MYC3与茉莉酸zim结构域蛋白相互作用,介导拟南芥茉莉酸反应。摩尔。2011;4(2):279 - 88。
- 55。
Wood CC, Robertson M, Tanner G, Peacock WJ, Dennis ES, Helliwell CA拟南芥蒂利亚纳vernalization响应需要多种蛋白质复合物,该蛋白质复合物还包括春化不敏感3. Proc Natl Acad Sci U S A. 2006; 103(39):14631-6。
- 56。
王D,泰森MD,杰克逊SS,Yadegari R.两种设定域多元蛋白的部分冗余功能在拟南芥中控制种子发育的启动中。Proc Natl Acad Sci U S A. 2006; 103(35):13244-9。
- 57。
Chanvivattana y,bishopp a,schubert d,股票c,moon yh,sung zr等。拟南芥开花的多元组蛋白的相互作用。发展。2004; 131(21):5263-76。
- 58。
卢福林,崔旭,张书森,詹奴温,曹晓芳。拟南芥REF6是一个组蛋白H3赖氨酸27去甲基化酶。Nat麝猫。2011;43 (7):715 - u144。
- 59。
Yu X,Li L,Guo M,Chory J,Yin Y.拟拟拟拟合中的Jumonji域蛋白质ELF6和REF6的芸苔类固醇调节基因表达的调节。PROC NATL ACAD SCI U S A. 2008; 105(21):7618-23。
- 60。
Portereiko Mf,Sandaklie-nikolova L,Lloyd A,Dever Ca,Otsuga D,Drews Gn。核融合缺陷1编码拟南芥RPL21M蛋白,是雌配子体发育和受精过程中核生殖所必需的。植物杂志。2006;141(3):957 - 65。
- 61。
Pinon V, Etchells JP, Rossignol P, Collier SA, Arroyo JM, Martienssen RA, et al.;三个肩扛特别影响叶子图案的基因编码核糖体蛋白质。发展。2008;135(7):1315 - 24。
- 62。
Fujikura U,Horiguchi G,Ponce Mr,Micol JL,Tsukaya H.细胞增殖和细胞扩增的协调介导的核糖体相关过程中的叶片拟南芥蒂利亚纳.植物j . 2009; 59(3): 499 - 508。
- 63。
通过转座子介导的突变破坏拟南芥细胞质核糖体蛋白s13同源基因导致异常生长和发育。植物j . 2000; 22(3): 257 - 64。
- 64.
成熟核糖体在饥饿时通过自噬途径选择性降解,需要Ubp3p/Bre5p泛素蛋白酶。细胞生物学杂志。2008;10(5):602-10。
- 65.
Tagwerker C,Flick K,Cui M,Guerrero C,Dou Y,Auer B等人。在完全变性条件下进行两步纯化的串联亲和标签:在泛素分析和蛋白质复合物鉴定中的应用结合体内交联。Mol细胞蛋白质组学。2006; 5(4):737-48。
- 66.
关键词:拟南芥,F-box, AtFBP7,温度胁迫,翻译基因。2007;392(1 - 2):106 - 16。
- 67.
周X,Hao Q,Liao J,Zhang Q,Lu H.核糖体蛋白S14在核糖体应力下的MDM2-P53环中解。oncogene。2013; 32(3):388-96。
- 68.
徐吉,田益,彭罗,熊,朱湾,金XF等。ATCPK6,一种功能冗余和正稳压器,涉及拟南芥盐/干旱胁迫耐受性。Planta。2010; 231(6):1251-60。
- 69.
拟南芥钙依赖蛋白激酶CPK6在保卫细胞中起茉莉酸甲酯信号转导的正调节作用。植物杂志。2011;155(1):553 - 61。
- 70.
王玉峰,杨勇,王玉峰,等。CDPKs CPK6和CPK3在ABA调控保卫细胞s型阴离子和Ca(2+)渗透通道和气孔关闭中的作用。公共科学图书馆。2006;4(10),e327。
- 71.
Gimenez-Ibanez S, Ntoukakis V, Rathjen JP。拟南芥中LysM受体激酶CERK1介导细菌感知。植物学报。2009;4(6):539-41。
- 72.
Iizasa E,Mitsutomi M,Nagano Y.直接结合植物Lysm受体样激酶,Lysm Rlk1 / Cerk1,对甲壳素体外.J Biol Chem。2010; 285(5):2996-3004。
- 73.
王志强,王志强,王志强,等。MKK2通路介导拟南芥的冷和盐胁迫信号。摩尔细胞。2004;15(1):141 - 52。
- 74。
MAP激酶MKK2激酶对拟南芥抗病能力的影响。植物营养与肥料学报。2007;20(5):589-96。
- 75。
高敏,刘军,毕东,张震,程飞,陈胜,等。MEKK1、MKK1/MKK2和MPK4共同作用于丝裂原激活的蛋白激酶级联,调节植物的天然免疫。细胞研究》2008;18(12):1190 - 8。
- 76。
Iwakawa H,Shinmyo A,Sekine M. Arabidopsis CDKA; 1,CDC2同源物,控制男性配子发生中的生成细胞的增殖。工厂J. 2006; 45(5):819-31。
- 77。
Cui X,Fan B,Scholz J,Chen Z.拟南芥系依赖激酶C复合物在花椰菜马赛克病毒感染,植物生长和发育中的作用。植物细胞。2007; 19(4):1388-402。
- 78。
Fragoso S,Espindola L,Paez-valencia J,Gamboa A,Camacho Y,Martinez-Barajas E等。SNRK1同种型Akin10和Akin11在磷酸盐饥饿下在拟南芥植物中差异调节。植物理性。2009; 149(4):1906-16。
- 79。
Farras R,Ferrando A,Jasik J,Kleinow T,Okresz L,Tiburcio A等人。SKP1-SNRK蛋白激酶相互作用介导植物SCF泛素连接酶的蛋白酶体结合。2001年EMBO J. 2001; 20(11):2742-56。
- 80.
Li J,Lease Ka,Tax Fe,Walker JC。BRS1,丝氨酸羧肽酶,调节BRI1信号拟南芥蒂利亚纳.Proc Natl Acad Sci U S A. 2001; 98(10):5916-21。
- 81.
李敏,陈东,石世洛,罗杰,秦军,等。HAUSP对p53的去泛素化作用是p53稳定的重要途径。大自然。2002;416(6881):648 - 53年。
- 82.
刘F,Ni W,Griffith Me,Huang Z,Chang C,Peng W等人。的ASK1和ASK2基因对于拟南芥早期发展是必不可少的。植物细胞。2004; 16(1):5-20。
- 83。
张W,Sun Y,Timofejeva L,Chen C,Grossniklaus U,Ma H.拟议剂量斑块的调节拟计占状Tapetum1(DYT1)的调节,编码推定的BHLH转录因子。发展。2006; 133(16):3085-95。
- 84。
冯波,卢德华,马晓鹏,孙玉英,宁光,等。DYT1调控拟南芥花药转录组对花粉发育的影响植物j . 2012; 72(4): 612 - 24。
- 85。
双向电泳技术的改进提高了小麦幼苗蛋白的遗传变异水平。电泳。1986;7(1):52-4。
- 86。
赵志,张伟,史丹利,阿斯曼。功能蛋白质组学拟南芥蒂利亚纳保护细胞揭示了新的气孔信号通路。植物细胞。2008; 20(12):3210-26。
- 87。
朱镕基,史密斯JW,黄厘米。基于质谱的无标记定量蛋白质组学。j生物医学生物技术。2010; 2010年:840518。
致谢
我们感谢安妮斯坦利(蛋白质和质谱核心研究设施,宾夕法尼亚州立医学院,Hershey,PA)进行质谱技术服务;和克雷格·普劳(Penn国家基因组学核心设施 - 大学公园,PA)为微阵列技术服务。这项工作得到了美国能源部(DE-FG02-02ER15332)的支持。由生物学哈克生命科学系,宾夕法尼亚州立大学(大学公园,帕)和复旦大学(中国上海)。
作者信息
从属关系
通讯作者
额外的信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
DL和HM构思和设计了实验。DL和WN进行了实验。DL和BAC分析了数据。DL编写并修订了手稿和HM编辑了手稿。所有作者阅读并认可的终稿。
附加文件
附加文件1:
基因差异在问1与L相比突变体微阵列er。
附加文件2:
基因下调在问1与L相比突变体微阵列er。
附加文件3:
在单个蛋白质组学样本中检测到的蛋白质,具有FDR <1%。
附加文件4:
三种膜蛋白在检测的L中有很好的代表性呃和问1蛋白质(FDR <1%)。
附加文件5:
问1-只有具有微阵列值的蛋白质。
额外的文件6:
问1- 具有光谱计数和微阵列值的高脂蛋白。
额外的文件7:
问1-降低蛋白质的光谱计数和微阵列值。
额外的文件8:
的问1突变体具有减少的女性生育能力。
额外的文件9:
三种生物复制的标准化微阵列数据问1和l的四个生物重复呃花蕾。
附加文件10:
质谱数据问1以.zip文件的形式导出。_1样本。
附加文件11:
质谱数据问1_2样例导出为。zip文件。
附加文件12:
质谱数据问1_3示例导出为.zip文件。
附加文件13:
质谱数据问1_4示例导出为.zip文件。
附加文件14:
质谱数据问1_5样本导出为。zip文件。
附加文件15:
L的质谱数据er_1示例导出为.zip文件。
附加文件16:
L的质谱数据er_2样例导出为。zip文件。
附加文件17:
L的质谱数据er_3示例导出为.zip文件。
附加文件18:
L的质谱数据er_4示例导出为.zip文件。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Lu,D.,Ni,W.,Stanley,B.A.等等。拟南芥花蕾的蛋白质组学和转录组学分析揭示了Arabidopsis Skp1-Lim的重要功能。BMC植物BIOL.16,61(2016)。https://doi.org/10.1186/s12870-015-0571-9.
已收到:
接受:
发表:
关键词
- 拟南芥
- ASK1
- E3泛素连接酶
- 质谱分析
- 蛋白质的降解
- 蛋白质组学
- 转录组