抽象的
背景
多种植物病原体将效应器传递到植物细胞中以改变宿主的过程。卵菌病原体编码大量推测的RxLR效应体,这些效应体可能在操纵植物防御反应中发挥作用。检查参与组成分泌腺的的Plasmopara viticola(葡萄霜霉病)至少包含162个候选RxLR效应体,但它们在感染和致病性中的作用尚不明确。在这里,我们深入描述了推测的RxLR效应之一,PvRxLR16,它已经被报道诱导细胞死亡烟草benthamiana在我们以前的研究中。
结果
核定位,w / y / l主题和推定NPvRxLR16 c端-糖基化位点是诱导细胞死亡活性的关键。在PvRxLR16触发的细胞死亡反应中,Skp1的g - 2等位基因抑制子(SGT1)、热休克蛋白90 (HSP90)和Mla12抗性(RAR1)所必需的,而不是体细胞胚胎发生受体样激酶(SERK3)所必需的n benthamiana.一些丝裂原活化蛋白激酶和转录因子也参与了PvRxLR16的感知n benthamiana.PvRxLR16还能显著增强植物对黄萎病的抗性疫霉capsici这种能力需要核定位。然而,其他一些PvRxLR效应子可以抑制PvRxLR16诱导的防御反应和抗病能力,提示在自然条件下,PvRxLR16可能不会触发宿主细胞死亡或免疫应答。
结论
这些数据表明PvRxLR16可能被细胞核内的内源性蛋白识别并触发免疫应答n benthamiana,这又可以被其他PVRXLR效应器抑制。
背景
在自然界中,植物会受到各种病原体的攻击,并通过复杂的天然免疫监视系统来保护自己[1- - - - - -3.].植物免疫系统的第一层被称为PAMP触发的免疫(PTI),并且已经进化以检测病原体(病原体或微生物相关分子模式(PAMPS / MAMPS)和PRR介导的免疫力的进化守恒的分子签发[4,5].反过来,成功的病原体可以分泌效应蛋白进入宿主细胞,干扰PTI,导致效应诱发易感性(ETS)。植物免疫系统的第二层是效应体触发免疫(ETI),植物抗性(R)蛋白直接或间接识别病原体效应体,导致局部细胞死亡,称为超敏反应(HR)。这些效应蛋白被R寄主植物的基因产物被认为是无毒(Avr)蛋白[4,6,7].
oomycetes是一类大型破坏性植物病原体,其中17个属含有超过800种柔软的霉菌病原体(Peronosporaceae.),以及超过120种物种Phytophthora.属(8,9].卵菌也像其他病原体一样,向植物细胞内传递多种效应物,破坏宿主免疫[10].到目前为止,越来越多的AVR.已从不同卵菌中鉴定出基因,包括Phytophthora sojae.,5种和Hyaloperonospora arabidopsidis[11- - - - - -24].有趣的是,卵菌中所有的Avr蛋白,除了一个(ATR5)外,都包含一个n端信号肽,可以将效应体引导到病原体外部,随后是RxLR-EER基元,负责将效应体运输到宿主细胞内部[23,25].这些携带RxLR基元的效应器被定义为近年来被广泛研究的RxLR效应器[26].oomycetes中RxLR效应器的重要发现已经加快了无流动基因的鉴定过程[12].
新兴证明表明RXLR效应器靶向植物细胞的各种亚细胞隔室以进行其功能。例如,效应器avh241p .突变定位到质膜上,并且定位是其活性诱导细胞死亡所必需的[27].功能分析显示H. Arabidopsidis.效应器HarxL17显着增强了植物敏感性,该植物敏感性定位于未感染的细胞中的调色剂,并在受感染细胞的Haustoria周围膜[28].在另一项研究中,我们发现AVRblb2的效应因子p . 5通过阻止宿主木瓜样半胱氨酸蛋白酶C14向质外体分泌,在吸器周围积累,提高宿主的易感性[29].同样,p . 5RxLR效应体AVR2在吸器周围与宿主靶蛋白BSL1(一种假定的磷酸酶)聚集,促进BSL1与R2的关联,从而触发HR [30.].植物细胞核也被认为是RXLR效应蛋白的主要靶标之一。最近关于植物和Oomycete病原体之间相互作用的研究表明,RXLR效应靶向宿主核以改性宿主细胞生理学。RXLR效应器PI04089来自马铃薯枯萎病原体p . 5定位于寄主细胞核,以假定的马铃薯k -同源(KH) rna结合蛋白StKRBP1为靶点,以增强定植。它的核本土化是加强殖民的必要条件p . 5[31].Pi04314,另一个RxLR效应器p . 5,还积累在宿主细胞核中,并能够损害茉莉和水杨酸响应基因的诱导,以增强叶片定植p . 5[32].
超敏反应(HR)样细胞死亡是ETI中常见的程序性细胞死亡(PCD)最引人注目的表现之一[33].一些宿主免疫反应在HR之前,包括蛋白水解,离子助熔剂的变化,反应性氧物质(ROS)的积累,含有含有丝肠 - 活化蛋白激酶(MAPK)级联的激活和激活偶联蛋白激活的激活[34].HR在寄主植物中的及时诱导似乎为病原体定植建立了一个强大的屏障,特别是对必须从活的寄主细胞中吸收营养的生物营养生物。例如ATR1,是一种H. Arabidopsidis.,可以诱发HR和RPP1存在时对病原体的耐药性反应[23].而且,avirulence效应子avr1p . 5当AVR1/R1对位于细胞核时,激活R1介导的超敏反应和宿主防御[35].在通过直接或间接识别的模式识别受体(PRRS)识别时,PAMP也可以引起编程的细胞死亡。PCINF1 ELITININ来自p . capsici,被认为是oomycete pamps,在胡椒中触发细胞死亡(甜椒L.),显然通过结合细胞表面受体SRC2-1 [36].
迫使生物养殖oomycetePlasmopara viticola([Berk。et rict。] berl。et de toni)导致世界各地葡萄牙剧烈的剧烈霉菌疾病。这种病原体需要从葡萄树的活细胞中获得所有营养,以完成其整个生命周期[37].然而,分子间相互作用的基础p . viticola并且葡萄霍维林宿主并不顺利。目前,通过转录组测序分析预测了葡萄霜霉病的秘密,然后确定了51例RXLR效应候选者[38].有趣的是,这些效果PVRXLR16中的一个可以直接触发细胞死亡n benthamiana这在晚期感染阶段(72 HPI)高度表达。但是,许多其他PVRXLR效应器完全阻止了PVRXLR16引发的编程的细胞死亡[39].该效应器的功能验证对于识别潜在的毒力或无流动因子特别感兴趣。
在本研究中,我们旨在进一步表征效应蛋白PVRXLR16的功能n benthamiana.序列分析显示W/Y/L基序的存在和推测N糖基化的网站。这些基序的缺失或突变消除了PvRxLR16诱导细胞死亡的活性。一些参与免疫信号通路的关键蛋白是PvRxLR16触发的细胞死亡反应所必需的。除了细胞死亡外,PvRxLR16还能诱发其他基础防御反应,包括ROS的积累和防御相关基因的表达,从而导致对疾病的抗性n benthamiana反对p . capsici.然而,PvRxLR16引发的免疫反应可以被其他RxLR效应体成功消除p . viticola.
方法
植物材料及生长条件
的种子拟南芥(Col-0)从拟南芥信息资源(TAIR)中购买,在40 ~ 60%湿度条件下,在22°C光照16 h、20°C黑暗8 h条件下培养。烟草benthamiana植物(由中国农业大学瞿桂琴教授提供)在25°C、每天光照16 h的温室中生长。洋葱(洋葱是在当地一家超市买的。
质粒建设
用于下列质粒结构的引物见支持信息附加文件1S1:表。的各种变种PvRxLR16使用附加文件中记录的引物组合扩增PVX检测1S1:表。PCR产物被切割Xma我和Sal I.限制性内切酶和连接到PVX::国旗向量。对于GFP融合结构,PvRxLR16,PvRxLR16:新经济学院和PVRXLR16:NES.用修饰Gateway (Invitrogen) attB重组位点的基因特异性引物扩增。通过BP反应将PCR扩增片段克隆到进入载体pDONR222 (Invitrogen)中,然后利用Gateway LR重组技术将扩增片段重组到二元载体pH7FWG2, 0中。构建病毒诱导基因沉默(VIGS)的结构体n benthamiana的cDNA中扩增出目的基因部分序列n benthamiana然后连接到pTRV2载体Xma我和KPN I.限制的网站。所有生成的质粒均由Majorbio, Inc.(中国上海)进行测序验证。本研究中使用的结构示意图见附加文件2:图S1。
农药过滤和感染测定
Agroinfiltration化验的n benthamiana按照我们之前的研究所述进行[39].用离体游动孢子悬液滴接种(100游动孢子/μL)进行感染试验N.Benthamiana.叶子。如前所述制备动物孢子[40].杆菌(由Daolong Dou教授提供,南京农业大学)含有质粒构建体的细胞渗透N.Benthamiana.叶子。24 h后,分离叶片,在叶片背面接种游动孢子悬浮液。在36和48 hpi下测量感染区域的直径,并在紫外光下36小时拍照。将至少三个生物学重复的数据进行了组合。
原生质体制备答:芥并转染
孤立答:芥叶片原生质体和聚乙二醇介导的转染如下所述进行[41].简而言之,将膨胀的叶片切割成0.5-1毫米叶条,并浸入含有1.5%纤维素'onozuka'R10和0.4%MeRoerozyme R10(Yakult Pharmaceutical)的酶溶液中的酶溶液。在30分钟的真空渗透和室温下在黑暗中进行3小时消化后,用75mm尼龙网过滤酶 - 原生质体混合物。随后,用W5缓冲液洗涤原生质体两次,悬浮在MMG缓冲液中至密度为2×105细胞/ ml。每次转染反应使用10μg质粒和100μl原生质体悬浮液。然后用W5缓冲液停止转染过程。最后,将原生质体在室温下在黑暗中在W1缓冲液中孵育12-16小时,用于基因表达。
粒子轰击测定
将PvRxLR16质粒与GFP融合,GFP载体分别与美国Bio-Rad公司的gold power混合。然后用He / 1000颗粒输送系统(Bio-Rad, USA)在1100 psi的压力下将它们转化成洋葱表皮细胞。42].洋葱表皮细胞在Murashige-Skoog (MS)培养基中21℃黑暗培养18 h后观察。
共聚焦显微镜
从洋葱表皮细胞中切割斑块并农根冻结n benthamiana叶子。然后用尼康C1 Si/TE2000E共聚焦激光扫描显微镜对载片和拟南芥原生质体进行成像。GFP的激发波长和发射波长分别为488 nm和505-530 nm。
Vigs测定n benthamiana
农杆菌在含有适当的抗生素的LB中含有PTRV1和PTRV2-基因的菌株在含有适当的抗生素中,收获,悬浮在渗透培养基中[10mM MgCl2, 10 mM MES (pH 5.7)和200 μM acettosyringone],以1:1的比例与OD混合600= 0.5每个应变。将共培养物用不需要的注射器在3周龄的黄叶背面渗透n benthamiana.然后在细胞死亡测定前生长农鸡冻结植物约3周。通过定量逆转录(RT)-PCR检查基因沉默水平。
RNA提取和实时定量RT-PCR
总RNAn benthamiana按照推荐的协议使用商业试剂盒(RNA simple Total RNA kit, Tiangen)分离叶片。所有的cDNA合成和定量RT-PCR反应均按照之前的方法进行[43].的EF1α基因n benthamiana用作内部参考基因以确定相对表达值。引物由Primer 5.0软件(Premier Biosoft International,Canada)设计了默认设置。
蛋白质提取和Western印迹
农业滤冻n benthamiana叶片在2 dpi下收获,并在液氮中均质。然后蛋白质提取缓冲(1毫升)包含4 - 50毫米(2-hydroxyethyl) 1-piperazineethanesulfonic酸(玫瑰),150毫米氯化钾,1毫米ethylenediaminetetraacetate (EDTA) (pH值8.0),0.1% triton x - 100, 1毫米dl-dithiothreitol(德勤),和1×蛋白酶抑制剂鸡尾酒(σ)添加到500毫克的每个样本。样品混合,4℃,12000 rpm离心15 min。上清液用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转移到硝酸纤维素印迹膜上。使用抗cflag过氧化物酶结合物(Sigma- Aldrich)进行Western blot分析。
台盼蓝染色
细胞死亡n benthamiana叶用台盼蓝染色。在2.5 dpi下收获浸渍过的叶片,浸泡在沸腾的台台蓝溶液中[10 mL乳酸,10 mL甘油,10 mL ddH2然后在2.5 g/mL水合氯醛溶液中脱色,以清除背景并拍照。
氧气突发检测
根据H2O2染色后积累n benthamiana3, 3 ' -二氨基联苯胺(DAB) [44].简而言之,农业食品n benthamiana叶片在72 hpi下脱落。然后用1 mg/mL ddH的DAB溶液浸泡叶片2O),并在25°C下维持8 h。用95%乙醇煮沸15分钟,直到所有叶绿素完全漂白。漂白后的样品在三氯乙醛2.5 g/mL溶液中浸泡,进一步去除背景。H2O2通过Image J(美国国家卫生学院)和Photoshop(Adobe Systems Software Ireland Ltd)量化水平。所有实验均重复三次。
电解液泄漏检测
细胞死亡n benthamiana通过如前所述从叶片漏液确定离子泄漏进行测定[27].对于每个样品,将5个直径为8mm的叶盘放入含有5ml无菌双蒸馏水的10ml试管中,在室温(RT)下保存3小时。然后用电导率仪(DDS-307, Rex Shanghai, China)测量浴液的电导率EC1。电解液泄漏量(%)= 100 × EC1/EC2。这些实验重复了三次。
加入号码
本研究的所有序列信息都可以在其他文件中列出的登录号中的国家生物技术信息中心(NCBI)的Genbank数据库中找到3.S2:表。
结果
RxLR16从p . viticola诱导细胞死亡n benthamiana
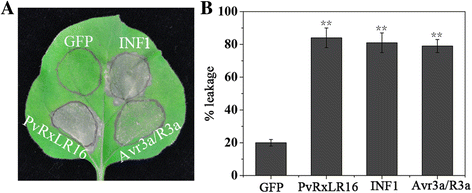
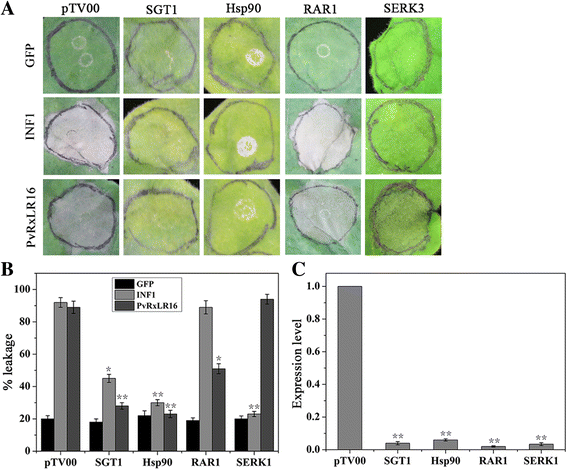
我们之前的分析确定了51个候选RxLR效应器来自p . viticola只有几种推测的效应物被用于抑制BAX和inf1诱导的细胞死亡[38].为了识别防御响应Elicitor蛋白,我们通过PVX载体的农药瞬时表达所有这些RXLR蛋白,并测定它们用于诱导细胞死亡n benthamiana叶子。INF1来自p . 5和AVR3a/R3a,已知它们能诱导细胞死亡n benthamiana,作为阳性对照[18,45].在51个RxLR效应器中,只有PvRxLR16发展出可见的表型,诱导HR inn benthamiana5D渗透后[39],表现出与INF1和AVR3a/R3a诱导的症状相似(图。1和b).作为阴性对照,在gfp渗透的叶片中没有观察到HR表型(图。1和b).我们也表达PvRxLR16拟南芥和番茄。但是,表达了PvRxLR16没有触发这两种植物的细胞死亡(数据未显示)。这些结果表明,PvRxLR16可能被一种内源性抗病蛋白识别,从而导致其毒力n benthamiana.
PvRxLR16需要核定位来触发细胞死亡
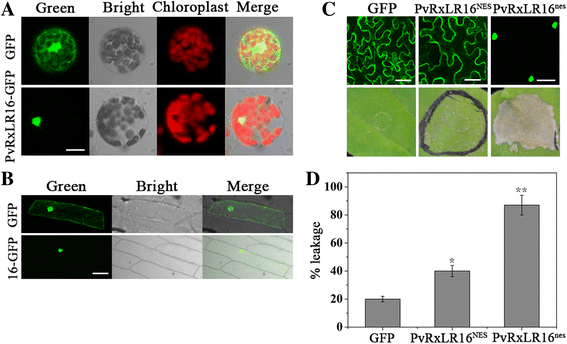
以确定PvRxLR16是否定位于不同植物的核n benthamiana[39],在CaMV 35S启动子的控制下与GFP的N端融合,瞬时表达于拟南芥原生质体和洋葱表皮细胞。结果表明,绿色荧光几乎完全聚集在细胞核内拟南芥原生质体,同时在细胞质和细胞核中检测到控制GFP(图。2).当我们将PvRxLR16- gfp融合蛋白与pH7FWG2,0载体在洋葱表皮细胞中瞬时表达时,PvRxLR16蛋白也位于细胞核中(图)。2 b).结合这两个实验的结果,可以清楚地得出PvRxLR16定位于细胞核。
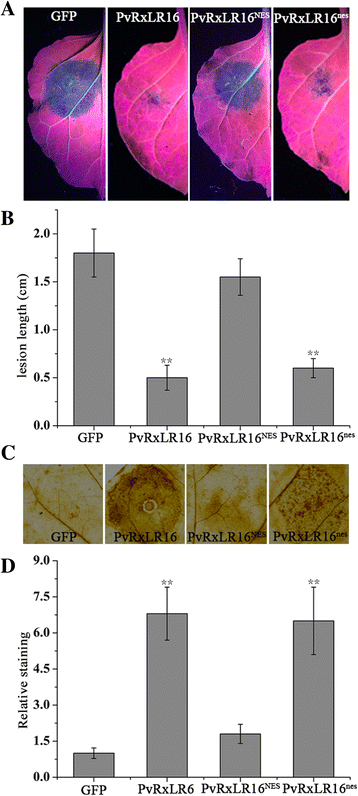
为了研究PVRXLR16是否需要核定位,以引发细胞死亡,合成网元(核排斥信号)和NES(非功能NES)[46]分别添加到PvRxLR16的C端。融合蛋白通过农业渗透在水稻中异位表达n benthamiana.PvRxLR16新经济学院从核中排除,始终未能在5 dpi下诱导细胞死亡,而pvrxlr16新经济学院强烈诱导的细胞死亡作为保留在细胞核中的野生型(图。2摄氏度和d).因此,我们推断PvRxLR16触发细胞死亡需要细胞核定位。
PvRxLR16的功能基序
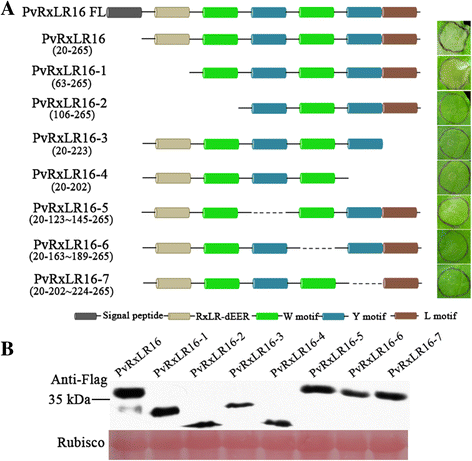
序列分析表明,PvRxLR16编码265个氨基酸,包含一个预测信号肽(SP) (aa 1-18)和一个RxLR-dEER基序(aa 46-61)。此外,预计PvRxLR16包含W/Y/L motif使用HMMER v3.0包[47].为了鉴定PVRXLR16的潜在功能基序,用于诱导细胞死亡,使用农药进入分析PVRXLR16的缺失突变体n benthamiana.除RxLR-dEER基序缺失突变体PvRxLR16-1外,所有缺失突变体均不能诱导细胞死亡(图2)。3).免疫斑分析表明,PVRXLR16的所有缺失突变体累积到可比程度n benthamiana叶子(图。3 b).这些数据表明,诱导细胞死亡所需的所有W / Y / L基序。
识别推定NPvRxLR16诱导细胞死亡所需的-糖基化位点。
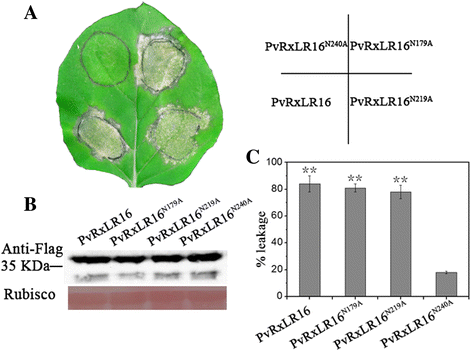
分泌蛋白经常发生N-链接糖基化,这是最普遍的翻译后修饰之一。据报道N-糖基化对在丝状真菌发病机制中发挥重要作用的效应蛋白的结构和功能至关重要[48].使用NetNGlyc1.0(可在网上找到http://www.cbs.dtu.dk/services/NetNGlyc/),预计PVRXLR16是一种具有三个推定的糖蛋白N- 位于Asn-170(Ngss),Asn-219(N1TT)和Asn-240(巢)的糖基化位点。为建立对细胞死亡诱导活性的贡献,将特定于特定的突变引入三个推定NPVX-PvRxLR16-3xFLAG构建的-糖基化位点。然后它们在树叶中短暂地表达出来N.Benthamiana..显然pvrxlr16都是pvrxlr16N170A和pvrxlr16.N219A在浸润5天后,诱发野生型PvRxLR16可见的细胞死亡反应(图。4).尖锐的,pvrxlr16n240a.几乎不能诱导任何细胞死亡症状(图。4).PvRxLR16的所有突变体均成功表达n benthamiana(无花果。4 b).通过测量离子泄漏量化细胞死亡[49(图。4摄氏度).这一发现突出了预测的重要性N-糖基化位点Asn-240对PvRxLR16细胞死亡诱导活性的影响。
PVRXLR16-触发的细胞死亡n benthamiana取决于SGT1, Hsp90和RAR1,而不是Serk3/Bak1
已知SGT1、Hsp90和RAR1通过调节R蛋白复合物的稳定性在R蛋白介导的HR中发挥重要作用[50,51].受体样激酶SERK3/BAK1被确定为各种PTI反应的关键因素,包括INF1诱导的程序性细胞死亡[52].为了确定SGT1、Hsp90、RAR1和Serk3在PvRxLR16诱导细胞死亡中的作用,我们对PvRxLR16中的这些基因进行了VIGS检测n benthamiana.然后用PvRxLR16或INF1对沉默植株进行农业渗透处理。结果显示,PvRxLR16未能触发细胞死亡SGT1.-,一半- - -RAR1.- 沉默的植物,而它仍然能够诱导细胞死亡Serk3沉默植物(图。5和b).逆转录-定量PCR (RT-qPCR)分析证实,与pTV00相比,沉默植株中目的基因的表达量明显减少,证实沉默成功(图2)。5度).这些结果表明pvrxlr16触发的细胞死亡依赖于SGT1、Hsp90和RAR1,而不依赖于Serk3/Bak1。
促丝裂解剂蛋白激酶(MAPK)级联的参与
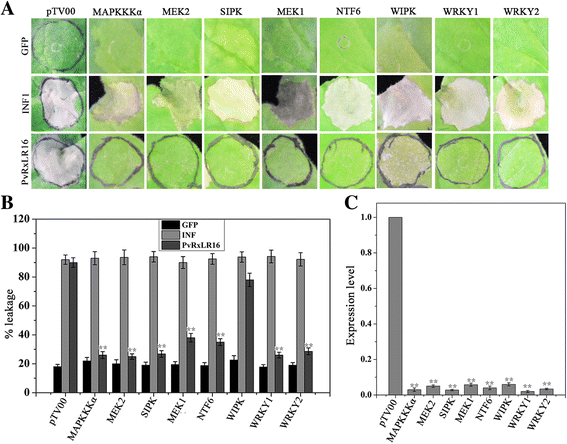
MAPK级联在PTI和ETI中都发挥着非常重要的作用[53].已经表征了一系列激酶和转录因子,在植物和病原体之间的相互作用期间发挥着植物免疫和细胞死亡诱导的重要作用,包括丝裂原激活的蛋白激酶激酶激酶(Mapkkkα),Map激酶激酶2(MEK2),水杨酸酸诱导的蛋白激酶(SIPK),MAP激酶激酶1(MEK1),NTF6,伤口诱导的蛋白激酶(WIPK),Wryk1和Wrky2 [54- - - - - -56].为了研究这些蛋白质在PVRXLR16诱导的细胞死亡中的可能作用,它们中的每一个都沉默n benthamiana通过VIGS和PvRxLR16效应进行挑战。INF1被选为阳性对照,它独立于这些激酶和转录因子触发细胞死亡。在所有基因沉默的植物中,细胞死亡受到影响,只有一个例外(WIPK)。6和b).数字6摄氏度在沉默中展示了目的基因的成绩单丰富n benthamiana,验证成功的沉默。这些结果表明,本研究检测的大多数丝裂原活化蛋白激酶和转录因子参与了PvRxLR16的感知n benthamiana.
PvRxLR16诱导抗病n benthamiana并促进ROS积累
以确定PvRxLR16是否可以激活其他防御反应n benthamiana,分别用PvRxLR16、PvRxLR16浸种新经济学院,或者PvRxLR16新经济学院,GFP用作控制。最终浓度农杆菌将悬浮液调整为OD600在2.5 d时不能诱导细胞死亡(附加文件)4:图S2)。然后24小时后,接种渗透区域p . capsici以36 hpi测量病变直径来评估游动孢子和疾病的发展。通过与PvRxLR16相似的GFP表达结构,病害症状在农业渗透的叶片上可见新经济学院,而pvrxlr16和pvrxlr16新经济学院-渗透的叶片被保护以防止病原菌侵染(图。7一个).确定p . capsici病变直径(图。7 b)显示PvRxLR16和PvRxLR16新经济学院减少p . capsici增长显着。
探讨PVRXLR16抗病抗性增加的机制,H2O2用二氨基联苯胺(DAB)染色分析。PvRxLR16和PvRxLR16感染区相对染色明显较高新经济学院与PVRXLR16中的相比新经济学院和GFP控制(图。7 c和d),提示PvRxLR16需要靶向植物核来促进H2O2积累。综上所述,这些数据表明PvRxLR16需要核定位来激活植物防御和防止病原体定植。
PvRxLR16增强了防御相关基因的表达n benthamiana
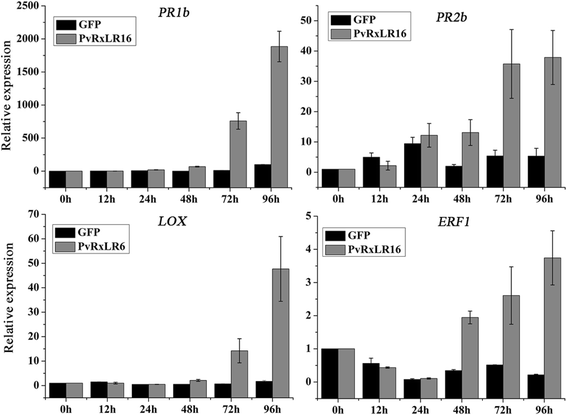
为了进一步了解PvRxLR16在植物防御反应中的作用,我们利用实时定量rt - pcr分析了防御相关基因的转录水平。由于水杨酸(SA)-、茉莉酸(JA)-和乙烯(ET)介导的信号转导途径在抗病病原体中起着关键作用[57[分析了每种途径的标志物基因的表达水平。的PR1a / PR2b,ERF1和液态氧分别是水杨酸盐、乙烯和茉莉酸盐介导信号通路的标记基因[58- - - - - -60].与GFP相比,在瞬时表达PVRXLR16的叶片中显着上调这些防御相关基因的表达水平(图。8).这些结果表明PVRXLR16的表达可以增强防御相关基因的表达水平n . benthamiana导致抗病性。
pvrxlr16引发的免疫可被其他PvRxLR效应物抑制
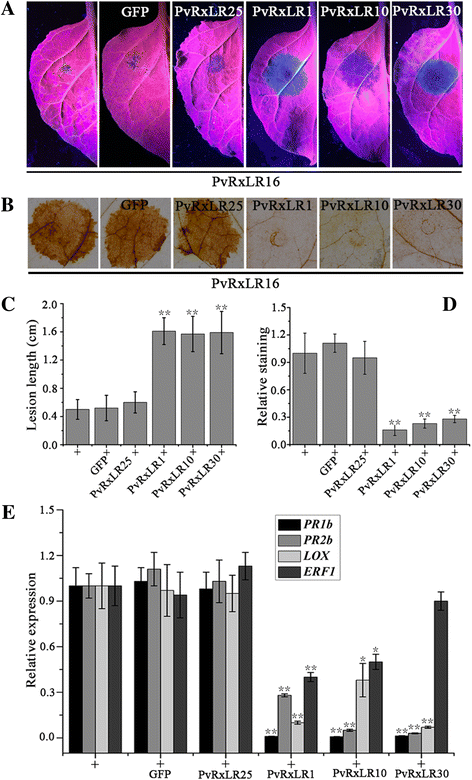
虽然单个效应剂可以触发强烈的防御反应,但其他一些RxLR效应剂能够抑制防御反应,包括效应剂触发的免疫[61].以往的数据表明,大多数检测的PvRxLRs可以抑制PvRxLR16诱导的细胞死亡[39].为了进一步确定PVRXLR16诱导的防御反应除了细胞死亡之外还可以通过PVRXLR效应抑制,我们测定了PVRXLR16激活的抗病,ROS产生和与抗辩相关基因是否可以通过瞬时表达来压抑PvRxLR1,PvRxLR10,PvRxLR30和PvRxLR25在n benthamiana.使用农毒滤液表达每种PVRXLR或GFP后,用PVRXLR16构建体渗透叶子。在表达PVRXLR16后,通过染色叶72小时来检测ROS积聚。对于疾病发展测定,渗透叶被接种p . capsici游动孢子(10 μl, 100 μl)−1),在36 hpi测量疾病的病变直径。结果表明,PVRXLR1,PVRXLR10和PVRXLR30抑制了PVRXLR-16诱导的抗病性抗性(图。9A和c)和活性氧的积累(图9B.和d),与阴性对照PvRxLR25和GFP比较。QRT-PCR分析显示,这3个pvrxlr也能在一定程度上减少PvRxLR16对防御相关基因的引入(图)。9e.).因此,对n benthamiana可以通过其他PVRXLR效应器有效地抑制PVRXLR16。
PVRXLR效应抑制PVRXLR16诱导的抗病性和免疫应答n benthamiana.一个病变的n benthamiana表达指示基因的叶片接种p . capsici在36 HPI。使用农毒滤液表达每种PVRXLR或GFP后,用PVRXLR16构建体渗透叶子。然后接种渗透叶p . capsici在PVRXLR16表达后48小时。代表图片在36 HPI后感染p . capsici.bDAB染色n benthamiana留在3 dpi表达3PvRxLR16.PvRxLR效应器(PvRxLR1, 10和30)和GFP瞬时表达n benthamiana在渗透PVRXLR16之前,通过农毒素排放12小时叶。c病变直径n benthamiana树叶(* *P< 0.01,邓尼特氏测试)。dDAB染色的相对水平。基于Dunnett测试的显着差异由此表示星号(**P<0.01)。这些实验被复制三次,每种生物复制六片叶子。e相对表达水平PR1b,PR2b,液态氧,ERF1PVRXLR16诱导的基因被其他PVRXLRS(PVRXLR1,10和30)抑制n benthamiana.PvRxLR效应器(PvRxLR1, 10和30)和GFP瞬时表达n benthamiana在渗透PVRXLR16之前,通过农毒素排放12小时叶。在3 dpi表达中检测到与防御相关基因的相对转录物水平PvRxLR16(+)。EF1a用作内源性控制。显示了三个独立复制的手段和标准错误。基于Dunnett测试的显着差异由星号表示(**P<0.01,*P<0.05)
讨论
在植物病原体相互作用中,RXLR的效果在建立病原体感染方面发挥着至关重要的作用,并相反在植物防御中的作用[26].近年来,通过基因组测序或RNA-seq,在各种卵菌病原体中预测了数百种RxLR效应物[25,38,62- - - - - -66].来自候选RXLR效应的大规模功能调查p . 5,p .突变和H. Arabidopsidis.揭示了他们中的大多数可以抑制细胞死亡和免疫力,而少数可能引发细胞死亡或免疫反应[21,61,67].一些细胞死亡诱导效应,如PsAvh163和psavh41p .突变,已被证明能激活植物中的ETI或PTI [27,68].候选效应PvRxLR16被鉴定为唯一能引起细胞死亡的效应n benthamiana在一项调查中p . viticola效应器(39].在这里,我们还证明,除了细胞死亡外,它还能诱导其他免疫反应。由PvRxLR16触发的防御反应具有阻止感染的潜力n benthamiana经过p . capsici,而与此同时,其他PvRxLR效应器有能力抑制pvrxlr16触发的免疫反应。
物种特异性细胞死亡和PVRXLR16的抗病诱导表明它似乎用作典型的无流动蛋白n benthamiana.PvRxLR16仍然可以引发细胞死亡BAK1(Serk3)-Silenced.n benthamiana,表明它独立于细胞表面模式识别受体的检测。然而,触发细胞死亡的n benthamiana需要SGT1,HSP90和RAR1,表明PVRXLR16依赖性细胞死亡可能来自ETI而不是PVRXLR16的非特异性毒性。另外,MAPK和转录因子基因的沉默表明PVRXLR16诱导的细胞死亡需要所有测试基因,其中一个例外WIPK,这是从PAMP受体鞭毛蛋白敏感2(FLS2)的信号转换信号所需的[27].综上所述,我们推测PvRxLR16可能针对植物ETI途径的上游成分,可能是内源性的R蛋白。负责检测的内源性蛋白可能已经进化到在霜霉病病原体中识别PvRxLR16的同源基因尼古利亚娜物种(如。Peronospora Tabacina.亚当)。
越来越多的证据表明,植物细胞核是卵菌病原菌效应体的主要靶标。最近的一项研究调查了亚细胞定位模式H. Arabidopsidis.植物中RxLR效应候选物发现66%的RxLR效应物可以靶向宿主细胞核[28].此外,CRN效应器的功能分析Phytophthora.证实它们中的大多数以细胞核为目标[40,69,70].作者表明,在几个CRN效应体中,核靶向信号的改变阻止了它们诱导细胞死亡的活动。在这项研究中,我们证明PvRxLR16的核定位是诱导细胞死亡和防御反应所必需的。报告了一个类似的病例p . 5其中AVR1的毒性因子也必须存在于细胞核中才能激活Rgene-mediated电阻(35].因此,我们有理由相信PvRxLR16的细胞核定位对于内源性蛋白识别和免疫应答至关重要。
效应触发免疫(ETI)通常与病原体抗性、诱导ROS爆发、离子内流和防御相关基因表达水平升高有关[71].在本研究中,我们观察到PvRxLR16在n benthamiana增强抵抗力p . capsici防御相关基因的ROS积累和表达水平增加。这些防御反应与ETI一致。值得注意的是,SA、JA和ET信号通路均被PvRxLR16效应体激活。PvRxLR16可能通过诱导多种防御途径来抑制病原体的生长。SA、JA和ET是经典的免疫激素,在植物防御病原菌中发挥关键作用。一般来说,SA信号对于抗生物营养素或半生物营养素的免疫是至关重要的,而JA和ET信号对于抗坏死营养素的免疫通常是重要的,尽管也有例外[57].pvrxlr16诱导的免疫是否能抑制不同病原体的入侵将是非常有趣的n benthamiana.
虽然植物具有检测和响应RXLR效应的能力,但成功的病原体已经明确地发展了复杂的机制,以超越主持人的免疫应答[72].在多个系统中报告了通过病原体分泌的效应器干扰PTI和ETI [34].一个复杂的候选RxLR效应剧目被鉴定p . viticola,表达模式可分为四大类。不同表达谱组的18个PvRxLR效应子均能抑制PvRxLR16诱导的细胞死亡n benthamiana除个别例外外[39].所有这些RxLR效应子都能抑制BAX、INF1、PsojNIP、PsCRN63和Avr3a/R3a诱导的细胞死亡,表明它们都可能靶向介导植物细胞死亡和防御反应的共同途径。特别是这些效应器中的一些PvRxLR1,PvRxLR10,PvRxLR30,在感染早期中表达或高表达,表达模式与PvRxLR16相似[39,提示这些RxLR效应器可能先发制人地抑制宿主对PvRxLR16的应答能力。然而,当PvRxLR16在植物中已经高表达时,这些效应剂不能抑制PvRxLR16触发的免疫反应,而这三种RxLR效应剂尚未被诱导(数据未显示)。因此,植物对PvRxLR16的响应能力可能会对效应体的表达水平设置一个上限p . viticola.隔离PvRxLR16从几个生理小种p . viticola未发现序列多态性PvRxLR16(数据没有显示)。然而,这种效应体虽然能诱导细胞死亡和防御反应,但似乎并没有发生多样化的选择n benthamiana.目前未知PVRXLR16是否可以在其宿主的自然条件下激活细胞死亡,葡萄树。PVRXLR16可能在生理感染期间可能不会触发细胞死亡,减轻选择压力本身变化。不幸的是,因为p . viticola由于其典型的专性生活方式,很难进行基因改造,很难确定PvRxLR16是否对致病性至关重要p . viticola在感染期间。
结论
这是第一次报告推定的RXLR效应器的研究p . viticola被植物免疫系统识别,甚至可能作为一个无毒基因在n benthamiana.PVRXLR16触发细胞死亡的能力对于利用ATTA非常有用(根癌土壤杆菌- 介导的瞬态表达式),Vigs或其他工具N.Benthamiana..此外,它还可用于识别新的防御相关基因p . viticola或其他卵菌类,它们将为新的疾病控制策略提供关键的见解。
缩写
- 阿塔:
-
根癌土壤杆菌介导的瞬时表达
- AVR:
-
无毒性
- 轻拍:
-
3,3'-二氨基苯胺
- 德勤:
-
dl-dithiothreitol.
- EDTA:
-
ethylenediaminetetraacetate
- 等:
-
乙烯
- 指数:
-
效应触发的免疫力
- ets:
-
Effector-triggered易感性
- FLS2:
-
Flagellin-sensitive 2
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 玫瑰:
-
(4) - 2-hydroxyethyl 1-piperazineethanesulfonic酸
- 人力资源:
-
过敏的反应
- HSP90:
-
热休克蛋白90
- 是:
-
茉莉酸酸
- 磅:
-
Luria-Bertani
- MAPK:
-
增殖蛋白激酶
- MAPKKKα:
-
丝裂原激活蛋白激酶激酶激酶激酶
- MEK1:
-
地图激酶激酶1
- MEK2:
-
地图激酶激酶2
- 多发性硬化症:
-
Murashige-skoog.
- NCBI:
-
国家生物技术信息中心
- 新经济学院:
-
非功能性核排除信号
- 新经济学院:
-
核排斥信号
- pamp / mamp:
-
病原体或微生物相关的分子模式
- 纤毛运动:
-
编程细胞死亡
- PRRS:
-
模式识别受体
- PTI:
-
PAMP触发的免疫力
- RAR1:
-
MLA12电阻所需
- ROS:
-
反应性氧气
- SA:
-
水杨酸
- sds - page:
-
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
- SERK3:
-
体细胞胚胎发生受体样激酶
- SGT1:
-
Skp1的g - 2等位基因抑制子
- SIPK:
-
水杨酸诱导蛋白激酶
- SP:
-
信号肽
- TAIR:
-
拟南芥信息资源
- 中收取:
-
病毒诱导基因沉默
- WIPK:
-
Wound-induced蛋白激酶
参考文献
- 1.
琼斯·达,Takemoto D.植物先天免疫 - 直接和间接识别一般和特异性病原菌相关分子。Currogin Immunol。2004; 16(1):48-62。
- 2.
Nürnberger T, Brunner F, Kemmerling B, Piater L.植物和动物的先天免疫:惊人的相似和明显的差异。Immunol启2004;198(1):249 - 66。
- 3.
Chisholm ST, Coaker G, Day B, Staskawicz BJ。宿主-微生物的相互作用:塑造植物免疫反应的进化。细胞。2006;124(4):803 - 14所示。
- 4.
Jones JD, Dangl JL。植物的免疫系统。大自然。2006;444(7117):323 - 9。
- 5.
Dodds PN, Rathjen JP。植物免疫:植物-病原体相互作用的综合观点。[j] .地理科学进展,2010,27(8):539-48。
- 6.
Dangl JL, Jones JD。植物病原菌与感染的综合防御反应。大自然。2001;411(6839):826 - 33所示。
- 7.
五月K,Whisson S,Zwart R,Searle I,Irwin J,Maclane D,Carroll B,Drenth A. 11植物中11个无流动基因的遗传和测绘。真菌遗传学Biol。2002; 37(1):1-12。
- 8.
erwin dc,ribeiro好。全世界的植物病疾病。圣保罗:美国植物病理学会(APS媒体);1996年。
- 9.
Clark J,Spencer-Phillips P. Downy Middews。微生物学的百科全书。2000; 2:117-29。
- 10.
泰勒BM。进入和突破:卵菌植物病原体的毒力效应蛋白。细胞Microbiol。2009;11(1):13-20。
- 11.
单伟,曹敏,梁德,戴志伟。的Avr1b轨迹Phytophthora sojae.在携带抗性基因的大豆植株上编码必需的诱导子和调控子rp 1 b.植物营养与肥料学报。2004;17(4):394-403。
- 12.
董某,Qutob D,Tedman-Jones J,Kuflu K,Wang Y,Tyler BM,Gijzen M.的Phytophthora sojae.无毒性轨迹Avr3c在病原体菌株中编码一个具有序列多态性的多拷贝RXLR效应。《公共科学图书馆•综合》。2009;4 (5):e5556。
- 13.
Qutob D, Tedman-Jones J, Dong S, Kuflu K, Pham H, Wang Y, Dou D, Kale SD, Arredondo FD, Tyler BM。的拷贝数变异和转录多态性Phytophthora sojae.RXLR效应基因Avr1a和Avr3a.Plos一个。2009; 4(4):E5066。
- 14.
窦丁,Kale SD,刘涛,唐强,王旭,Arredondo FD, Basnayake S, Whisson S, Drenth A, Maclean D.不同领域的研究Phytophthora sojae.Avr4/6被大豆抗病基因识别数4和rp 6.Mol植物微生物相互作用。2010; 23(4):425-35。
- 15.
董胜,尹伟,孔光,杨旭,曲托布,陈强,羽衣甘蓝,隋勇,张智,窦东。Phytophthora sojae.Avr3b是一种分泌的NADH和adp -核糖焦磷酸化酶,调节植物免疫。公共科学图书馆Pathog。2011;7 (11):e1002353。
- 16.
Dong S, Yu D, Cui L, Qutob D, Tedman-Jones J, Kale SD, Tyler BM, Wang Y, Gijzen M.序列变异Phytophthora sojae.RXLR效应器AVR3A / 5在大豆中的RPS3A和RPS5差异识别。Plos一个。2011; 6(7):20172。
- 17.
宋涛,Kale SD, Arredondo FD, Shen D, Su L, Liu L, Wu Y, Wang Y, Dou D, Tyler BM。大豆疫霉菌RxLR的两个毒力基因测定大豆Rps 1k介导的抗病能力。植物与微生物学报。2013;26(7):711-20。
- 18.
Armstrong Mr,Whisson Sc,Pritchard L,Bos Ji,Verter E,Avrova Ao,Rehmany Ap,Böhmeu,Brooks K,Cherevach I.祖先oomycete洛杉矶含有晚期枯萎的无流动基因Avr3a,编码在宿主细胞质中识别的蛋白质。Proc Natl Acad SCI U S A. 2005; 102(21):7766-71。
- 19.
范波佩尔总理,郭杰,范德旺德沃特,荣格,白桦公关,惠森,Govers F. The5种非病原性基因AVR4.编码RXLR-DEER效应器。Mol植物微生物相互作用。2008; 21(11):1460-70。
- 20.
Vleeshouwers V, Rietman H, Krenek P, Champouret N, Young C, Oh S-K, Wang M, Bouwmeester K, Vosman B, Visser RG。效应基因组学加速发现马铃薯抗病和功能分析5种非病原性基因。《公共科学图书馆•综合》。2008;3 (8):e2875。
- 21.
OH S-K,Young C,Lee M,Oliva R,Bozkurt,Cano LM,Win J,Bos Ji,Liu H-Y,Van Damme M.在Planta表达屏幕中5种RXLR效应揭示了不同的表型,包括激活茄属植物bulbocastanum抗病蛋白Rpi-blb2。植物细胞。2009;21(9):2928 - 47。
- 22.
Allen RL, Bittner-Eddy PD, Grenville-Briggs LJ, Meitz JC, Rehmany AP, Rose LE, Beynon JL。拟南芥与霜霉病的宿主-寄生虫共同进化冲突。科学。2004;306(5703):1957 - 60。
- 23.
Rehmany AP,Gordon A,Rose Le,Allen RL,Armstrong Mr,Whisson SC,Kamouns,Tyler BM,Birch Pr,Beynon JL。差异识别高度不同的柔软霉菌的霉菌血液异丙酶等位基因RPP1.来自两个拟南芥线的抗性基因。植物细胞。2005; 17(6):1839-50。
- 24.
Bailey k,Çevikv,holtonn,Byrne-Richardson J,Sohn Kh,Coate M,Woods-TörA,Aksoy HM,Hughes L,Baxter L. Atr5emoy2的分子克隆来自透明孢子瘤拟南芥的分子克隆,触发器触发rpp5介导的无流动决定蛋白拟南芥防御。Mol植物微生物相互作用。2011; 24(7):827-38。
- 25.
蒋rh, Tripathy S, Govers F, Tyler BM。在两种疫霉菌中,RXLR效应库由一个快速进化的超科(超过700个成员)主导。中国科学院院刊。2008;105(12):4874-9。
- 26.
安德森rg,deb d,fedkenheuer k,mcdowell jm。RXLR效应研究中的最新进展。Mol植物微生物相互作用。2015; 28(10):1063-72。
- 27.
于晓霞,唐建军,王强,叶伟,陶凯,段胜,陆超,杨旭,董胜,郑旭,等。大豆疫霉RxLR效应体Avh241需要质膜定位才能诱导植物细胞死亡。新植醇。2012;196(1):247 - 60。
- 28。
Caillaud M-C,Piquerez SJM,Fabro G,Steinbrenner J,Ishaque N,Beynon J,Jones JDG。HPA RXLR效应器ReperoIre的亚细胞定位鉴定了一种蛋白化相关的蛋白质Harx117,其赋予了增强的植物易感性。工厂J. 2012; 69(2):252-65。
- 29。
Bozkurt to,Schornack S,Win J,Shindo T,Ilyas M,Oliva R,Cano LM,Jones Am,Huitema E,Van der Hoorn Ra。5种效应体AVRblb2阻止吸器界面上植物免疫蛋白酶的分泌。中国科学院院刊。2011;108(51):20832-7。
- 30.
Saunders DG, Breen S, Win J, Schornack S, Hein I, Bozkurt TO, Champouret N, Vleeshouwers VG, Birch PR, Gilroy EM.宿主蛋白BSL1与5种RXLR效应器AVR2和Solanum Demissum.免疫受体R2介导疾病抗性。植物细胞。2012; 24(8):3420-34。
- 31.
王X,Boevink P,Mclellan H,Armstrong M,Bukharova T,Qin Z,Birch Pr。宿主KH RNA结合蛋白是由RXLR效应器旨在促进晚期枯萎病的敏感因素。莫尔植物。2015; 8(9):1385-95。
- 32.
boevink pc,王x,mclellan h,他q,naqvi s,阿姆斯特朗先生,张w,hein i,gilroy em,tian z. a5种RXLR效应靶向促进晚疫病的植物PP1c亚型。Nat Commun.2016; 7:10311。doi:10.1038 / ncomms10311.
- 33.
Qutob D, Kemmerling B, Brunner F, Küfner I, Engelhardt S, Gust AA, Luberacki B, Seitz HU, Stahl D, raauhut T. Nep1-like蛋白诱导的植物毒性和先天性免疫应答。植物细胞。2006;18(12):3721 - 44。
- 34.
Thomma BP,NürnbergerT,乔塞肯MH。PAMP和效果:模糊的PTI-ETI二分法。植物细胞。2011; 23(1):4-15。
- 35.
Du Y,Berg J,Gouge F,Bouwmeester K.由晚期抗性蛋白R1介导的免疫激活需要R1和效应AVR1的核定位。新植物。2015; 207(3):735-47。
- 36.
刘Z-Q,邱A-L,Shi L-P,Cai J-S,黄X-Y,杨S,王B,沉L,黄M-K,MOU S-L。通过作为PCINF1的相互作用伴侣,PCINF1诱导的辣椒免疫需要SRC2-1。J Exp Bot。2015; 66(13):3683-98。
- 37.
Gessler C,Pertot I,Perazzolli M.Plasmopara viticola:综合血腥霉菌和有效疾病管理知识综述。Phytopathol Mediterr。2011; 50(1):3-44。
- 38.
尹玲,李旭,向杰,曲娟,张勇,Dry IB,陆军Plasmopara viticola通过Novo转录组分析。physiol mol植物疗法。2015; 91:1-10。
- 39.
Xiang J,Li X,Wu J,Yin L,Zhang Y,Lu J.研究Plasmopara viticola RXLR效应抑制植物免疫的机制。前微生物。2016; 7:709。
- 40。
马建军,马辉,张敏,徐建军,何锋,叶涛,沈东,陈勇,Rajput NA, Dou D.辣椒疫霉毒力必需CRN效应因子抑制辣椒疫霉的宿主防御并诱导细胞核细胞死亡。《公共科学图书馆•综合》。2015;10 (5):e0127965。
- 41。
刘志强,刘志强,刘志强,等。拟南芥叶肉原生质体的瞬时基因表达分析。Nat Protoc。2007;2(7):1565 - 72。
- 42.
Mare C,Mazzucotelli E,Crosatti C,Francia E,Cattivelli L. HV-Wrky38:涉及大麦冷和干旱反应的新转录因素。植物mol biol。2004; 55(3):399-416。
- 43.
吴建军,张颖,张华,黄洪,黄洪,陆建军葡萄属amurensis利用Solexa测序技术对霜霉病的葡萄反应。植物学报。2010;10(1):234。
- 44.
张志强,魏勇,张志强。H2O2在植物中。H2O2大麦与白粉病互作过程中乳突的积累和超敏反应。植物j . 1997; 11(6): 1187 - 94。
- 45.
关键词:本氏烟草;抗性5种是通过识别Elicitor蛋白质INF1的介导的。植物细胞。1998; 10(9):1413-25。
- 46.
Shen Q-H,Saijo Y,Mauch S,Biskup C,Bieri S,Keller B,Seki H,ülkerb,somssich IE,Schulze-Lefert P.MLA免疫受体的核动物活性与孤立特异性和基础疾病抵抗的联系。科学。2007; 315(5815):1098-103。
- 47.
Finn Rd,Clement J,Eddy SR。HMMER Web服务器:交互式序列相似性搜索。核酸res..2011; 39:W29-W37。
- 48.
陈X-L,Shi T,Yang J,Shi W,Gao X,Chen D,Xu X,Xu J-R,Talbot NJ,Peng Y-L。用α-1,3-甘露糖基转移酶的乳蛋白酶蛋白的N-糖基化是稻瘟病真菌的α-1,以逃避宿主先天免疫。植物细胞。2014; 26(3):1360-76。
- 49.
Mittler R, Herr EH, Orvar BL, Van Camp W, Willekens H, Inzé D, Ellis BE。对活性氧中间体解毒能力降低的转基因烟草植株对病原体感染高度敏感。中国科学(d辑:地球科学)1999;96(24):14165-70。
- 50。
Shirasu K,Schulze-Lefert P.复杂的形成,滥交和多功能性:抗病途径中的蛋白质相互作用。趋势植物SCI。2003; 8(6):252-8。
- 51。
Shirasu K.用于NLR免疫传感器的HSP90-SGT1伴侣络合物。Annu Rev植物Biol。2009; 60:139-64。
- 52。
Heese A, Hann DR, Gimenez-Ibanez S, Jones AM, He K, Li J, Schroeder JI, Peck SC, Rathjen JP。类受体激酶SERK3/BAK1是植物先天免疫的中枢调节因子。中国科学(d辑:地球科学)2007;104(29):12217-22。
- 53.
植物防御中的MAPK级联信号网络。植物学报。2009;12(4):421-6。
- 54.
张H,李d,王男,刘俊,腾W,郑B,黄强,王男,宋W,董S的本塞姆氏裂原活化蛋白激酶级联和WRKY转录因子参与nep1Mo触发植物响应.Mol植物微生物相互作用。2012; 25(12):1639-53。
- 55.
Menke Fl,Kang H-G,Chen Z,Park JM,Kumar D,Klessig DF。烟草转录因子Wrky1由地图激酶Sipk磷酸化,并在烟草中介导HR样细胞死亡。Mol植物微生物相互作用。2005; 18(10):1027-34。
- 56.
Del Pozo O,Pedley Kf,Martin GB。Mapkkkα是与植物免疫和疾病相关的细胞死亡的阳性调节因子。禁止J. 2004; 23(15):3072-82。
- 57.
生物营养与坏死营养病原体防御机制的比较。植物病理学杂志2005;43:205-27。
- 58.
Lee S,Ishiga Y,Clermont K,Mysore Ks。冠状氨酸抑制气孔闭合并延迟非强化细菌病原体诱导的过敏反应细胞死亡。peerj。2013; 1:E34。
- 59.
在植物防御过程中,乙烯响应因子1整合了来自乙烯和茉莉酸途径的信号。植物细胞。2003;15(1):165 - 78。
- 60.
王超,Zien CA ., Afitlhile M ., wilti R ., Hildebrand DF ., Wang X. phospholipase D在拟南芥茉莉酸伤害诱导积累中的作用。植物细胞。2000;12(11):2237 - 46。
- 61。
王Q,韩C,Ferreira Ao,Yu X,YE W,Tripathy S,Kale Sd,Gu B,Sheng Y,Sui Y等。在中的转录编程和功能交互Phytophthora sojae.RXLR效应曲目。植物细胞。2011;23(6):2064 - 86。
- 62。
作者:张旭东,张晓东,张晓东,姜rh, Aerts A, Arredondo FD, Baxter L, Bensasson D, Beynon JL。Phytophthora.基因组序列揭示进化起源和发病机制。科学。2006; 313(5791):1261-6。
- 63。
Haas Bj,Kamous,Zody Mc,江Rh,手机Re,Cano LM,Grabherr M,Kodira Cd,Raffaele S,Torto-Alalibo T.基因组序列和分析爱尔兰马铃薯饥荒病原体5种.大自然。2009;461(7262):393 - 8。
- 64。
Baxter L,Tripathy S,Ishaque N,Boot N,Cabral A,Kemen E,Thines M,Ah-Fong A,Anderson R,Badejoko W.适应迫使生物养学的签名Hyaloperonospora arabidopsidis基因组。科学。2010; 330(6010):1549-51。
- 65。
Pseudoperonospora cubensis多药物转运体的选择性剪接产生RXLR效应蛋白,诱导细胞快速死亡。《公共科学图书馆•综合》。2012;7 (4):e34701。
- 66.
Sharma R, Xia X, Cano LM, Evangelisti E, Kemen E, Judelson H, Oome S, Sambles C, van den Hoogen DJ, Kitner M.向日葵病原体的基因组分析单轴霉属halstedii为霜霉和霜霉的效应器进化提供见解Phytophthora..BMC基因组学。2015;16(1):741。
- 67.
Fabro G, Steinbrenner J, Coates M, Ishaque N, Baxter L, Studholme DJ, Körner E, Allen RL, Piquerez SJ, Rougon-Cardoso A.来自卵菌病原体的多个候选效应体Hyaloperonospora arabidopsidis抑制宿主植物免疫。公共科学图书馆Pathog。2011;7 (11):e1002348。
- 68.
安德森RG,Casady Ms,Fee Ra,Vaughan MM,Deb D,Fedkenheuer K,Huffaker A,Schmelz EA,Tyler BM,McDowell JM。来自的同源RXLR效应器Hyaloperonospora arabidopsidis和Phytophthora sojae.抑制远亲植物的免疫力。工厂j . 2012, 72(6): 882 - 93。
- 69.
Schornack S, van Damme M, Bozkurt TO, Cano LM, Smoker M, Thines M, Gaulin E, Kamoun S, Huitema E。中国科学院院刊。2010;107(40):17421-6。
- 70。
关键词:大豆疫霉,宿主细胞质效应体,防御机制,致病机制植物杂志。2011;155(1):490 - 501。
- 71。
Cui H,Tsuda K,Parker Je。效应触发的免疫:从病原体感知到强大的防御。Annu Rev植物Biol。2015; 66:487-511。
- 72。
YIN W,DONG S,ZHAI L,Lin Y,Zheng X,Wang Y.植物滴黄素AVR1D基因在病原体菌株中的存在和不存在多态性编码RXLR-鹿效应。Mol植物微生物相互作用。2013; 26(8):958-68。
确认
我们非常感谢教授。大奇福(中国农业大学),余芳王和大龙窦(南京农业大学)提供材料和技术支持。
资金
中国天然科学基金(Grant No.11471754),中国农业研究系统(Grant No.Cars-30-Yz-2)和上海交通大学的启动基金(WF107115001)支持这项工作。
可用性数据和材料
本研究过程中生成或分析的数据集可由通讯作者根据合理要求提供。本研究的序列数据可在NCBI的GenBank数据库(https://www.ncbi.nlm.nih.gov/),在附加文件中列出的接入号下。
作者的贡献
所有作者都证实了他们的贡献,阅读并批准了这份手稿。构思和设计了实验:JX,XLL,LY,YLZ,JL。执行实验:JX,XLL,YXL,JJQ。分析了数据:JX,LY,JL。写了稿件:JX,JL。
利益争夺
两位作者宣称他们没有相互竞争的利益。
同意出版物
不适用。
伦理批准和同意参与
不适用。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
作者信息
从属关系
相应的作者
附加文件
附加文件1:表S1。
本研究使用的引物。(多克斯24 kb)
附加文件2:图S1。
本研究中使用的构念示意图。(TIFF 1018 kb)
附加文件3:表S2。
Genbank登录基因数量n benthamiana本研究中使用的PVRXLR效应器。(DocX 14 KB)
附加文件4:图S2。
PVRXLR16和GFP的瞬态表达n benthamiana。代表n benthamiana用各种浓度渗透叶子(OD600= 0.4, 0.2, 0.1)的农杆菌含有PVX-PvRxLR16或PVX-GFP的悬浮液。上图,浸润后2.5 d直接拍摄。下图为台班蓝染色后2.5 d拍摄。(TIFF 1612 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Xiang,J.,Li,X.,Yin,L.等等。候选RXLR效应器Plasmopara viticola能引起免疫反应吗烟草benthamiana.BMC植物杂志17,75(2017)。https://doi.org/10.1186/s12870-017-1016-4
收到了:
接受:
发表:
关键词
- Plasmopara viticola
- 小道消息
- RxLR效应
- 烟草benthamiana细胞死亡
- 免疫反应