- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发布:GydF4y2Ba
在植物中高水平的水解单宁酸会抑制过氧化物酶介导的花青素退化和维护的背面红叶GydF4y2BaExcoecaria CochinchinensisGydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba19GydF4y2Ba文章编号:GydF4y2Ba315GydF4y2Ba(GydF4y2Ba2019年GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
背面深阴影下层植物花青素叶子戏对环境适应重要的生态意义。与在其他植物的瞬态色素,花青素永久在这些背面红叶呈现,但是,对于颜料维护机制仍不清楚。在本研究中,我们调查了可能会影响色素的稳定性和降解含酚代谢物GydF4y2BaExcoecaria cochinchinensisGydF4y2Ba(一种叶子背面长期呈红色的灌木),通过与GydF4y2Ba桂花雀族GydF4y2Ba(近红叶的灌木丛)。GydF4y2Ba
结果GydF4y2Ba
高水平的没食子酸花青素被鉴定GydF4y2BaExcoecariaGydF4y2Ba但不在GydF4y2Ba桂花GydF4y2Ba植物。没食子酰化花青素表现出比两种非没食子酰化的花青素略高的稳定性,而所有的3种颜料通过体外过氧化物酶(POD)快速降解。水解鞣质[主要galloylglucoses /鞣花单宁(GGS / ETS)]的高含量的鉴定GydF4y2BaExcoecariaGydF4y2Ba但是没有一个在GydF4y2Ba桂花GydF4y2Ba.GGS / ETS对POD显示抑制作用,IC50范围为35.55至83.27μm,与检测到的明显降低的豆荚活动相关联GydF4y2BaExcoecariaGydF4y2Ba比在GydF4y2Ba桂花GydF4y2Ba.结果表明,GGs/ETs和花青素具有较强的共色素作用,非没食子苷化的花青素溶液的红色强度增加了30%以上。在叶片组织中,可水解的单宁与花青素共定位在叶片的背面GydF4y2BaExcoecariaGydF4y2Ba叶片中POD活性较低,酸度增加,组织红强度增加。GydF4y2Ba
结论GydF4y2Ba
结果表明,GydF4y2BaExcoecariaGydF4y2Ba酚类代谢产物在叶片的背面层积累,主要是GGs/ETs,阻止花青素的降解,提高色素的稳定性,从而导致红叶的永久维持。GydF4y2Ba
背景GydF4y2Ba
花青素是植物界的主要色素,是光合组织免受光损害的保护者,是花和水果吸引授粉者和种子传播者的信号[GydF4y2Ba1GydF4y2Ba,GydF4y2Ba2GydF4y2Ba,GydF4y2Ba3.GydF4y2Ba,GydF4y2Ba4GydF4y2Ba].一般来说,色素在其作用完成后会短暂地积累和降解[GydF4y2Ba5GydF4y2Ba,GydF4y2Ba6GydF4y2Ba],然而,在许多下垫层植物的背面红色叶片中发现了色素的永久存在。相对于对深荫蔽植物中背轴花青素的生态学意义的深入研究,色素维持的机制却很少被剖析。GydF4y2Ba
花青素的积累通常发生在许多植物的幼叶中,那里的光合机构没有充分的功能,超过光合能力的光会导致细胞损伤[GydF4y2Ba7GydF4y2Ba,GydF4y2Ba8GydF4y2Ba].花青素主要位于叶子的上表皮和/或下表皮,作为一种有效的防晒霜,保护光合叶肉细胞[GydF4y2Ba9GydF4y2Ba].因此,在自然光下,许多花青素(红色)种的叶片受光抑制较少,表现为较低的非光化学猝灭(NPQ)和总叶黄素对叶绿素(VAZ/Chl)值[GydF4y2Ba10.GydF4y2Ba,GydF4y2Ba11.GydF4y2Ba,GydF4y2Ba12.GydF4y2Ba,GydF4y2Ba13.GydF4y2Ba,GydF4y2Ba14.GydF4y2Ba].此外,植物叶片中花青素的生物合成在应对各种胁迫时上调,如高紫外线辐射、低温[GydF4y2Ba15GydF4y2Ba],这是减轻应力和增强植物容差的影响的机制的一部分[GydF4y2Ba16GydF4y2Ba].由于叶子成熟和发展保护蜡,或者被转移到阴影或环境应力消失,花青素迅速下降,叶子完全变绿[GydF4y2Ba1GydF4y2Ba,GydF4y2Ba6GydF4y2Ba,GydF4y2Ba17GydF4y2Ba].花青素的降低大概是对应于用于光保护的需要减少,以允许叶片以利用较高的光强度[GydF4y2Ba1GydF4y2Ba,GydF4y2Ba18GydF4y2Ba,GydF4y2Ba19GydF4y2Ba].GydF4y2Ba
另外,花青素在叶子中的存在可能是永久性的[GydF4y2Ba20.GydF4y2Ba],并在这些叶子花青素是最常见的背面[GydF4y2Ba20.GydF4y2Ba,GydF4y2Ba21GydF4y2Ba].永久着色叶的植物通常起源于森林下层,表面有不同的颜色图案,称为叶斑,可以作为观赏植物,例如,GydF4y2Ba仙客来purpurascensGydF4y2Ba[GydF4y2Ba22GydF4y2Ba],GydF4y2Ba秋海棠fimbristipulaGydF4y2Ba[GydF4y2Ba23GydF4y2Ba),GydF4y2BaExcoecaria cochinchinensisGydF4y2Ba不悦之色。这些植物的背面花青素被认为是在间歇性暴露于高强度阳光(即太阳斑)时,通过减弱绿光来保护光合叶肉细胞[GydF4y2Ba23GydF4y2Ba,GydF4y2Ba24GydF4y2Ba,GydF4y2Ba25GydF4y2Ba].花青素的这种光保护作用是由花青素(红色)叶片中较高的叶绿素含量和较低的Chl a/b比值支持的GydF4y2Ba秋海棠heracleifoliaGydF4y2Ba(cham。和schltdl。)[GydF4y2Ba24GydF4y2Ba].相对于对背面红叶生态相关性的深入研究,花青素在遮荫下保持和避免花青素降解的机制多年来一直受到研究者的关注,但尚未被阐明[GydF4y2Ba26GydF4y2Ba,GydF4y2Ba27GydF4y2Ba].GydF4y2Ba
花青素在植物组织中的浓度是由植物体内色素的生物合成、降解和稳定性决定的。与生物合成方面的深入知识相比[GydF4y2Ba28GydF4y2Ba,GydF4y2Ba29GydF4y2Ba[植物组织中的花青素降解和稳定性尚不知晓[GydF4y2Ba6GydF4y2Ba,GydF4y2Ba30.GydF4y2Ba,GydF4y2Ba31GydF4y2Ba].酶的降解被认为是植物中花青素分解的原因[GydF4y2Ba6GydF4y2Ba,GydF4y2Ba30.GydF4y2Ba],导致色素浓度降低,红色褪色。根据多酚氧化酶(PPOs)降解水果或果汁中的色素的能力,推测其具有降解花青素的活性[GydF4y2Ba32GydF4y2Ba,GydF4y2Ba33GydF4y2Ba,GydF4y2Ba34GydF4y2Ba].在植物中,PPOs位于胞质和质体中[GydF4y2Ba32GydF4y2Ba,提示PPOs可能不是在体内降解液泡中花青素的酶GydF4y2Ba.GydF4y2Ba在我们之前的研究中,我们从荔枝果皮中纯化了一个花青素降解酶(ADE),并鉴定为漆酶(ADE/LAC)。该酶被证实位于液泡中并降解花青素,并伴有表儿茶素氧化[GydF4y2Ba35GydF4y2Ba].最近,一种碱性过氧化物酶,BcPrx01,被发现负责在体内降解花青素GydF4y2BaBrunfelsia calycinaGydF4y2Ba.BcPrx01具有降解复杂花青素的能力。在花瓣液泡这些颜料它共定位,并且BcPrx01的mRNA和蛋白水平平行大大诱导花色素苷的降解GydF4y2Ba36GydF4y2Ba].据报道,一些环境因素,例如高温和低密度的光,通过激活花青素降解过氧化物酶活性来增强花青素的降解[GydF4y2Ba15GydF4y2Ba,GydF4y2Ba31GydF4y2Ba].GydF4y2Ba
叶片中的花青素维持也可能受到青少年素稳定性的影响,这些稳定性受其分子结构的影响[GydF4y2Ba37GydF4y2Ba,GydF4y2Ba38GydF4y2Ba]、眼孔内pH值和共色素沉着[GydF4y2Ba6GydF4y2Ba,GydF4y2Ba39GydF4y2Ba].在pH <3.0时,不仅增强了花青素的红色颜色,而且颜料的稳定性增加[GydF4y2Ba40GydF4y2Ba].相反,衰老组织液泡pH值的升高可能会降低花青素的稳定性,导致其降解[GydF4y2Ba41GydF4y2Ba,GydF4y2Ba42GydF4y2Ba].研究发现,花青素与液泡中共存的无色类黄酮组分相互作用,阻止了花青素核的水合作用,实现了颜色的稳定[GydF4y2Ba28GydF4y2Ba,GydF4y2Ba43GydF4y2Ba].这种相互作用,也称为共色素沉着,能够增加颜料色强度和稳定性[GydF4y2Ba44GydF4y2Ba,GydF4y2Ba45GydF4y2Ba].GydF4y2Ba
本研究主要探讨了花色素苷的保持机制GydF4y2BaExcoecaria cochinchinensisGydF4y2Ba作为材料。GydF4y2BaExcoecariaGydF4y2Ba在整个热带亚洲分发[GydF4y2Ba46GydF4y2Ba],野生的,也被作为药用灌木和园林灌木栽培,其特征是叶片几乎相反,上面是深绿色,下面是紫红色[GydF4y2Ba47GydF4y2Ba].我们选择了另一个花园灌木,GydF4y2Ba桂花雀族GydF4y2Basemperfloren变种,叶成熟时花青素快速降解[GydF4y2Ba48GydF4y2Ba],作为参试植物,研究花青素维持的机制GydF4y2BaExcoecariaGydF4y2Ba.在本研究中分析了花青素的组分,花青素降解相关酶(ADE)的活性,以及影响两种植物中颜料稳定性的因素。发现高水平的可水解单宁[主要是戈兰甘油葡萄糖/壳蛋白酶(GGS / ETS)]被发现与叶片中的花青素共局限GydF4y2BaExcoecariaGydF4y2Ba.这些物质抑制过氧化物酶介导的花青素降解,增加了色素的色密度,可能是背面红叶永久维持的主要因素之一。GydF4y2Ba
结果GydF4y2Ba
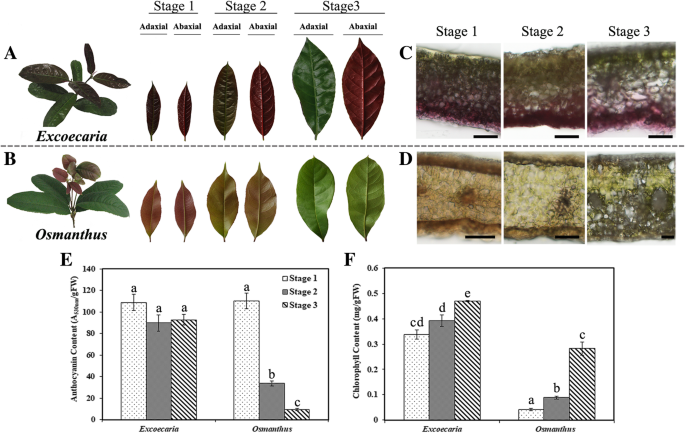
ExcoecariaGydF4y2Ba在叶成熟过程中,叶背面保持红色GydF4y2Ba
嫩叶GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba在正面和背面都展开红色。近轴面发生完全绿化GydF4y2BaExcoecariaGydF4y2Ba叶子,而叶片的叶片表面在叶成熟过程中保持着红色(图。GydF4y2Ba1GydF4y2Ba一种)。GydF4y2Ba桂花GydF4y2Ba树叶渐渐失去了红色和两侧(图完全变成绿色。GydF4y2Ba1GydF4y2Ba在本研究中,第1、2和3阶段被用来指示两个物种在红色、绿色和完全正面绿色阶段的叶片(图。GydF4y2Ba1GydF4y2BaA和B).叶片横截面的显微观察显示,大量花青素主要分布在叶片的背面GydF4y2BaExcoecariaGydF4y2Ba叶片在3个阶段(图。GydF4y2Ba1GydF4y2BaC)。相反,位于叶片1和2的叶子的叶子的Adaxial / Babaxial表面的花青素GydF4y2Ba桂花GydF4y2Ba,第3阶段未观察到花青素(图。GydF4y2Ba1GydF4y2BaD).为了研究两种植物叶片的颜色模式是否与花青素的变化有关,我们测定了叶片成熟过程中色素的含量。110年左右一个GydF4y2Ba530海里GydF4y2Ba/ g在阶段的两种植物中检测到FW花青素。相反,记录的花青素含量的减少约为90%GydF4y2Ba桂花GydF4y2Ba叶片1 ~ 3期花青素含量未见下降GydF4y2BaExcoecariaGydF4y2Ba叶子(图。GydF4y2Ba1GydF4y2Ba随着叶片变绿,叶绿素含量分别从0.34 ~ 0.47和0.05 ~ 0.3 mg/g FW增加GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba(无花果。GydF4y2Ba1GydF4y2BaF)。这些结果表明,在叶成熟期间,保持了花青素GydF4y2BaExcoecariaGydF4y2Ba,不像大花青素降解在GydF4y2Ba桂花GydF4y2Ba叶子。GydF4y2Ba
叶成熟期间的颜色和花青素水平的变化GydF4y2BaExcoecaria cochinchinensisGydF4y2Ba和GydF4y2Ba桂花雀族GydF4y2Ba.GydF4y2BaA-B.GydF4y2Ba叶的图像GydF4y2BaExcoecariaGydF4y2Ba(一)和GydF4y2Ba桂花GydF4y2Ba(B).第1至3阶段分别表明两个物种的幼叶、绿叶和成熟叶为红色。GydF4y2Ba光盘GydF4y2Ba叶片的横截面GydF4y2BaExcoecariaGydF4y2Ba(c)和GydF4y2Ba桂花GydF4y2Ba(d)观察为花青素位置。Scale bars indicate 50 μm.EGydF4y2Ba叶成熟过程中变化的花青素含量。GydF4y2BaFGydF4y2Ba叶片成熟过程中叶绿素含量的变化。这些值是三个单独提取的测量值的平均值。误差棒表示数值的平均标准误差(SEM)。不同字母表示未配对t检验值有显著差异(GydF4y2BapGydF4y2Ba< 0.05),而共用字母表示值之间无显著差异GydF4y2Ba
高水平的没食子酸花青素被鉴定GydF4y2BaExcoecariaGydF4y2Ba但不是在GydF4y2Ba桂花GydF4y2Ba叶子GydF4y2Ba
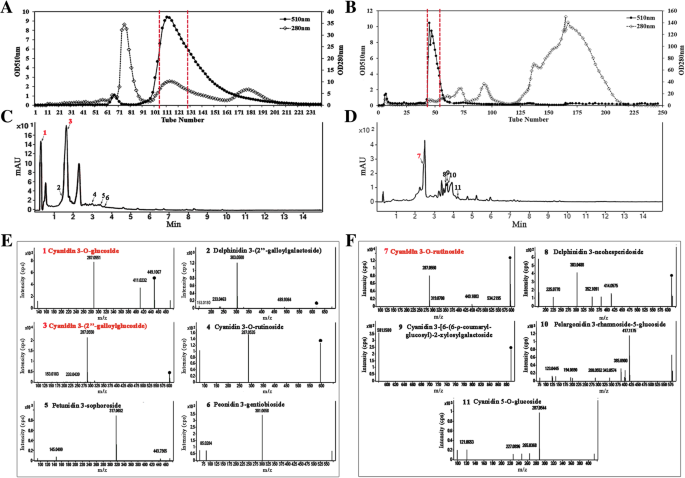
鉴定花青素分子GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba叶子,花青素GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba分别用Sephadex LH-20柱层析纯化。在洗脱图谱中,每个物种都有一个主要的A510 nm峰,红色馏分包括104 - 127管GydF4y2BaExcoecariaGydF4y2Ba样品和44-54管GydF4y2Ba桂花GydF4y2Ba采用UPLC-DAD-QTOF-MS/MS分别对样品进行分析。GydF4y2Ba2GydF4y2BaA和B)。UPLC-DAD分析显示六和五种不同的花青素GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba分别(无花果。GydF4y2Ba2GydF4y2BaC和D)。根据每个花青素正离子的m/z和MS/MS片段谱与“METLIN”数据库信息的比较,6个花青素(No. 1-6)GydF4y2BaExcoecariaGydF4y2Ba被确定(表GydF4y2Ba1GydF4y2Ba),包括花青素3- o -葡萄糖苷、飞燕花青素3-(2″- galloyl半乳糖苷)、花青素3-(2″-galloylglucoside)、花青素3- o -芦丁苷、牡丹花青素3-槐果苷和牡丹花青素3-龙胆苷(表1)GydF4y2Ba1GydF4y2Ba,无花果。GydF4y2Ba2GydF4y2Ba5种花色苷(No.7-11)GydF4y2Ba桂花GydF4y2Ba是Cyanidin 3-O-Rutinoside,Delphinidin 3-Neohehoside,Cyanidin 3- [6-(6-ρ-香豆甘糖基)-2-木糖糖苷,Pelargonidin 3-丙氨酸-5-葡糖苷和Cyanidin 5-O-葡糖苷(表GydF4y2Ba1GydF4y2Ba,无花果。GydF4y2Ba2GydF4y2BaF).根据280 nm吸光度代表的UPLC-DAD谱,cyanidin 3-(2″-galloylglucoside) (No. 3)和cyanidin 3- o -glucoside (No. 1)被认为是主要的花青素GydF4y2BaExcoecariaGydF4y2Ba(无花果。GydF4y2Ba2GydF4y2BaC),而花青素3- o -芦丁苷(7)是其中之一GydF4y2Ba桂花GydF4y2Ba(无花果。GydF4y2Ba2GydF4y2BaD)。GydF4y2BaExcoecariaGydF4y2Ba,最丰富的花青素3-(2“ - 庚酰葡糖苷)和次次蛋白酰胺3-(2” - 庚酰葡糖苷)是较阳厕所化的花青素,而仅发现非寄生酰基的花青素GydF4y2Ba桂花GydF4y2Ba.GydF4y2Ba
鉴定叶片中的主要花青素GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba,使用UPLC-DAD-QTOF-MS /女士。GydF4y2BaA-B.GydF4y2Ba花青素的柱层析纯化谱。采用Sephadex LH-20柱层析法,在510 nm和280 nm处测定了花青素的吸光度GydF4y2BaExcoecariaGydF4y2Ba(一)和GydF4y2Ba桂花GydF4y2Ba(B)。采用UPLC-DAD-QTOF-MS/MS分析两虚线之间的主要花青素组分。GydF4y2Ba光盘GydF4y2Ba花青素UPLC-DAD谱以280 nm的吸光度表示。花青素部分GydF4y2BaExcoecariaGydF4y2Ba(c)和GydF4y2Ba桂花GydF4y2Ba(D)分别采用UPLC-DAD-QTOF-MS/MS分析(A)和(B)叶片。GydF4y2BaE-FGydF4y2Ba主要花色苷的MS/MS谱图GydF4y2BaExcoecariaGydF4y2Ba(E)和GydF4y2Ba桂花GydF4y2Ba(f)分别。(E-F)中的花青素的预测是基于综合的MS / MS代谢物数据库“Metlin”(GydF4y2Bahttps://metlin.scripps.edu/GydF4y2Ba)GydF4y2Ba
未乙酰化的花青素GydF4y2BaExcoecariaGydF4y2Ba体外稳定性略高于非没食子苷GydF4y2Ba
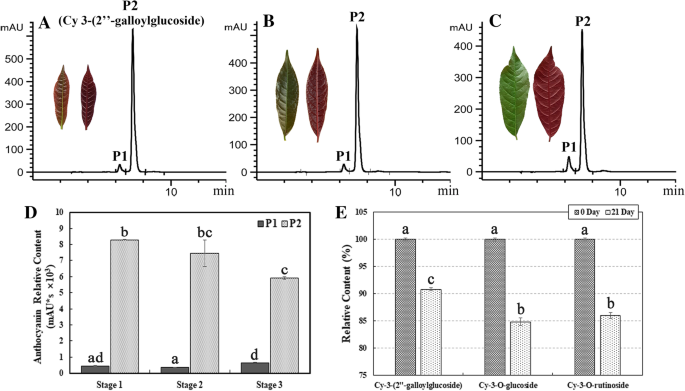
花青素的含量GydF4y2BaExcoecariaGydF4y2Ba用高效液相色谱法测定。A510 nm的两个主峰,峰1 (P1)和峰2 (P2)被检测到,P2的丰度远远高于P1(图5)。GydF4y2Ba3.GydF4y2BaA-C)。两个色素成分叶成熟(图中显示出边际降解。GydF4y2Ba3.GydF4y2BaD),与成熟过程中总花青素含量不变相关GydF4y2BaExcoecariaGydF4y2Ba叶子(图。GydF4y2Ba1GydF4y2BaE)。在两个峰值花青素由UPLC-DAD-QTOF-MS / MS进行鉴定,在P1和P2中的主要组件是矢车菊3-O-糖苷和花青素-3-(2“-galloyl-葡糖苷)分别(附加文件GydF4y2Ba1GydF4y2Ba:图S1D和E)。GydF4y2Ba
主要花青素的稳定性GydF4y2BaExcoecariaGydF4y2Ba叶子和体外。GydF4y2BaA-C.GydF4y2Ba花青素含量GydF4y2BaExcoecariaGydF4y2Ba成熟过程中的叶子。花青素含量GydF4y2BaExcoecariaGydF4y2Ba第1至第3阶段的叶片(如图所示。GydF4y2Ba1GydF4y2BaA)采用高效液相色谱法(A510nm)分析。通过UPLC-MS/MS进一步鉴定1 (P1)为cyanidin-3-O-glucoside(附加文件)GydF4y2Ba1GydF4y2Ba图S1D),而峰2 (P2)被鉴定为cyanidin 3-(2″-galloylglucoside)(附加文件GydF4y2Ba1GydF4y2Ba:图S1E)。GydF4y2BaDGydF4y2BaP1和P2的在叶成熟过程中的相对含量GydF4y2BaExcoecariaGydF4y2Ba由颜料的峰面积表示。GydF4y2BaEGydF4y2Ba主要花青素的体外稳定性。如(a)和图3所示的三个主要花青素的相对含量。GydF4y2Ba2GydF4y2BaF在室温保存21天后检测。所有的值都是三个个体重复的测量值的平均值,(D)和(E)中值的统计细节如图所示。GydF4y2Ba1GydF4y2Ba
上述主要花青素GydF4y2BaExcoecariaGydF4y2Ba(2″-galloylglucoside)和cyanidin 3- o -glucoside, cyanidin 3- o -rutinoside inGydF4y2Ba桂花GydF4y2Ba(无花果。GydF4y2Ba2GydF4y2BaF)分别用LH-20柱色谱法(图纯化。GydF4y2Ba2GydF4y2BaA和B)体外稳定性比较。3种花色苷在pH 3.0缓冲液中相对含量与色素水平的关系分别在第0天和第21天下降到91、85和86%。花青素3-(2″-没食子苷)比其他两种色素表现出稍强的稳定性。GydF4y2Ba3.GydF4y2BaE)。GydF4y2Ba
低氢GydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba依赖性花青素降解酶活性GydF4y2BaExcoecariaGydF4y2Ba叶子可能负责色素的维持GydF4y2Ba
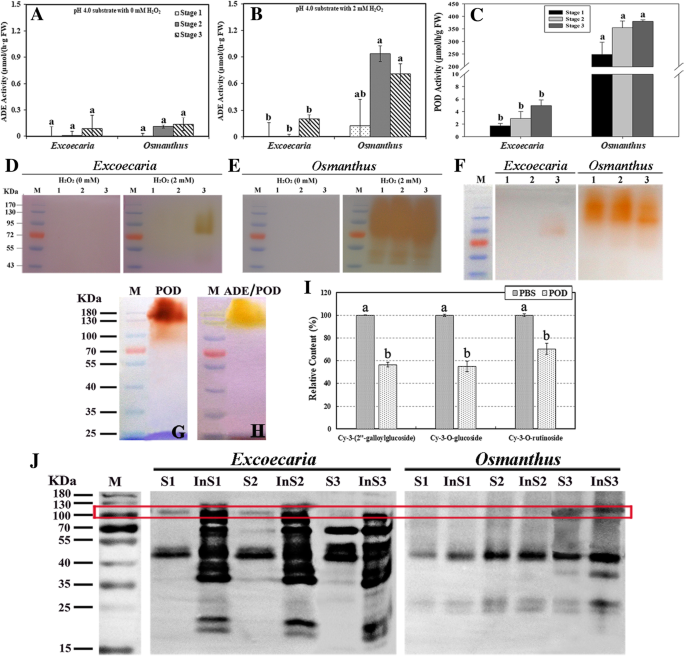
分别从各植物中分离纯化部分花青素,并作为底物检测花青素降解酶(ADE)活性。两个小时GydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba在叶片发育过程中,测定了依赖和独立ADE活性。GydF4y2Ba4GydF4y2Ba).毫无疑问地检测到两种植物中的脂肪活性GydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba(无花果。GydF4y2Ba4GydF4y2Ba一种)。当在H存在GydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba检测到明显较高的ADE活动GydF4y2Ba桂花GydF4y2BaHGydF4y2Ba2GydF4y2BaOGydF4y2Ba2,GydF4y2Ba而ADE活动检测GydF4y2BaExcoecariaGydF4y2Ba即使在H存在下,叶子也仍然很低GydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba(无花果。GydF4y2Ba4GydF4y2Bab)。GydF4y2Ba
叶成熟期间的ADE / POD活性和蛋白质水平GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba.GydF4y2BaA-B.GydF4y2Ba花青素降解酶(ADE)活性。叶片三个发育阶段ADE活性的变化。GydF4y2Ba1GydF4y2BaA和B与从部分纯化的花色素苷底物确定GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2BapH为4.0时,含或不含HGydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba.GydF4y2BaCGydF4y2Ba豆荚的活动。用愈创木酚和HGydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Baas substrates at pH 7.0.D-E.GydF4y2Ba在凝胶ADE活性测定。用半天然PAGE分离总蛋白10微克。利用花青素底物观察ADE活性,如(A-B)所示。M Lane为蛋白标记,1-3 Lane为(A-B)中的叶片样品。GydF4y2BaFGydF4y2Ba凝胶中POD活性测定。如(C)所述,将凝胶浸泡在底物中以观察POD活性。GydF4y2BaG-HGydF4y2Ba纯化过氧化物酶的凝胶活性测定。提取纯化过氧化物酶GydF4y2Ba桂花GydF4y2Ba叶子。用愈创木酚(G)观察其POD活性及其对花青素降解(ADE/POD)的影响,并进行部分纯化GydF4y2Ba桂花GydF4y2Baanthocyanins (H) respectively as substrates in the presence of 2 mM H2GydF4y2BaOGydF4y2Ba2GydF4y2Ba.M道如(D-E)所述。GydF4y2Ba我GydF4y2BaPOD介导了主要花青素的降解。主要的花青素GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba,如图2所示。GydF4y2Ba3.GydF4y2Ba(a - c)和无花果。GydF4y2Ba2GydF4y2BaF,分别纯化,如图所示。GydF4y2Ba2GydF4y2BaA和B,并加入作为底物的ADE / POD反应物作为(C)中,用变性酶作为对照。The remained anthocyanin contents were determined after the reaction for 20 min.JGydF4y2Ba免疫检测豆荚。在叶样品中的可溶性和不溶性馏分蛋白中检测到荚蛋白丰度,如(a)中的叶样品。红色框架指示吊舱带的大小为约110kDa。呈现在(a-c,i)中的值的细节如图2所示。GydF4y2Ba1GydF4y2Ba
用相同花色苷底物(含或不含H)进行凝胶内活性测定,进一步证实了ADE活性模式GydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2BapH为4.0时(图。GydF4y2Ba4GydF4y2BaD和E)与模式相关,H非常弱GydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba在两种植物中观察到独立的ADE活性信号,在H存在的情况下观察到更强的活性染色GydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba为了GydF4y2Ba桂花GydF4y2Ba.H.GydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2BaADE的依赖性表明该酶可能是过氧化物酶(POD),这与之前发现的POD在植物[36]花青素降解中起重要作用有关。进一步用分光光度法测定叶片中POD活性(图。GydF4y2Ba4GydF4y2BaC)和凝胶内法(图。GydF4y2Ba4GydF4y2BaF)。通过这两种方法检测到的活动显示出类似的图案,其中,所述过氧化物酶活性约为100倍的更高GydF4y2Ba桂花GydF4y2Ba叶子比GydF4y2BaExcoecariaGydF4y2Ba.用凝胶活性测定法几乎检测不到POD活性GydF4y2BaExcoecariaGydF4y2Baat stage 1 and 2, and weak signal at around 100 kDa was observed only at stage 3, while intensive POD activity bands were detected for桂花GydF4y2Ba在所有3个阶段的叶片(图。GydF4y2Ba4GydF4y2BaF)。The major ADE activity band was of similar size as the POD activity band, both of around 100 kDa (Fig.4GydF4y2BaE和F),还有HGydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba根据酶的依赖性,ADE实际上是POD,在叶片花青素降解过程中起作用,本文将其命名为ADE/POD。GydF4y2Ba
更好地了解花青素的维持GydF4y2BaExcoecariaGydF4y2Ba叶片中,过氧化物酶(ADE/POD)主要介导降解GydF4y2BaExcoecariaGydF4y2Ba将花青素与降解进行比较GydF4y2Ba桂花GydF4y2Ba颜料。ADE/POD部分纯化GydF4y2Ba桂花GydF4y2Ba叶片用硫酸铵沉淀,饱和度为70-100%。在2mm H的存在下GydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba凝胶活性测定显示,部分纯化的ADE/POD组分具有较高的ADE/POD活性,主要活性带约为110 kDa,无论是与愈创木酚(图)。GydF4y2Ba4GydF4y2BaG)或GydF4y2Ba桂花GydF4y2Ba花青素作为底物(图GydF4y2Ba4GydF4y2BaH).因此,POD馏分用于POD介导的两种植物花青素的降解。添加ADE/POD后,三种主要花青素均迅速降解(图3)。GydF4y2Ba4GydF4y2Ba一世)。在25℃下20分钟后,Cyanidin 3-(2“ - 庚酰葡糖苷),Cyanidin 3-O-葡糖苷和Cyanidin 3-O-rutinoside的相对含量记录为57,55%和70%,为含量分别进行酶控制(图。GydF4y2Ba4GydF4y2Ba一世)。这些结果表明,即使较阳性的花青素来自GydF4y2BaExcoecariaGydF4y2Ba比体外非寄生合花青素稍微稳定(图。GydF4y2Ba3.GydF4y2BaE),没食子酰化花青素示出了类似于降解POD作为非没食子酰化的。GydF4y2Ba
为了解两种植物ADE/POD活性的显著差异,采用多克隆POD抗体检测叶片中ADE/POD蛋白水平。该抗体在两种植物的蛋白质提取物的可溶性和不溶性部分均检测到约110 kDa的蛋白条带。110 kda蛋白在两种植物的可溶性部位含量相近,而在不溶性部位含量较高GydF4y2BaExcoecariaGydF4y2Ba比GydF4y2Ba桂花GydF4y2Ba在所有阶段(图。GydF4y2Ba4GydF4y2Ba110-kDa以来,均有ADE/POD带GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba在花色素苷降解模式的显着的差异可能是由于ADE / POD的通过在未知成分失活GydF4y2BaExcoecariaGydF4y2Ba叶子。GydF4y2Ba
分离得到天然POD抑制剂GydF4y2BaExcoecariaGydF4y2Ba由没食子葡萄糖/鞣花单宁组成GydF4y2Ba
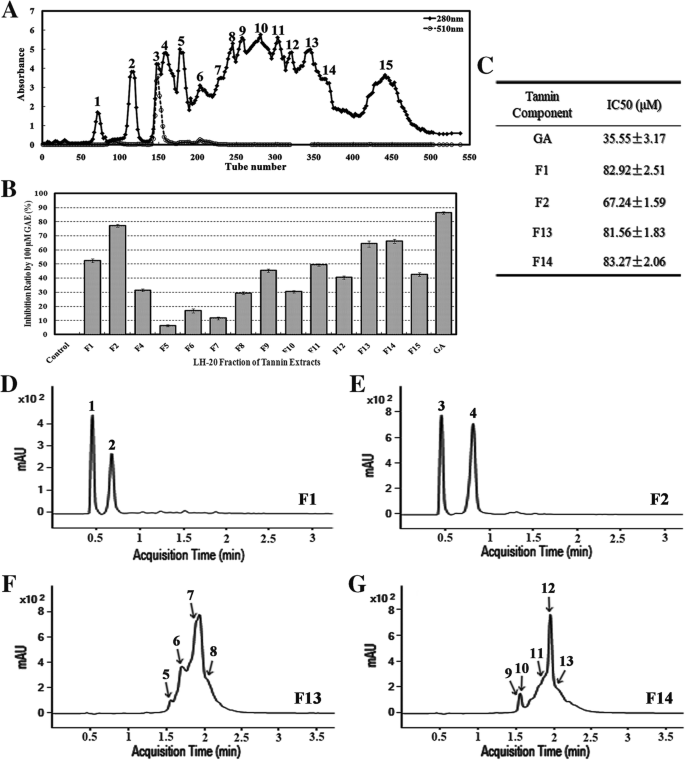
酚醛树脂在GydF4y2BaExcoecariaGydF4y2Ba采用Sephadex LH-20柱层析法提取分离叶片,研究叶片中是否存在天然POD抑制剂。根据A280 nm峰得到15个馏分(图。GydF4y2Ba5GydF4y2BaA)和各馏分的酚含量测定为没食子酸当量(GAE)。研究各馏分100 μM GAE对ADE/POD活性的抑制作用(图1)。GydF4y2Ba4GydF4y2Ba其中,F1、F2、F13、F14和GA的抑制率均在50%以上,分别为52.45、77.22、64.31、66.08和83.36%(图1)。GydF4y2Ba5GydF4y2BaB). GA、F1、F2、F13和F14对ADE/POD的半数最大抑制浓度(IC50)分别为35.55、82.92、67.24、81.56和83.27 μM GAEGydF4y2BaExcoecariaGydF4y2Ba叶子含有天然ADE / POD抑制剂。GydF4y2Ba
天然POD抑制剂的分离GydF4y2BaExcoecariaGydF4y2Ba叶子。GydF4y2Ba一个GydF4y2Ba酚类化合物的分离GydF4y2BaExcoecariaGydF4y2Ba叶用Sephadex LH 20柱层析。Fifteen fractions were obtained based on the absorbance peaks at 280 nm of the chromatography profile.BGydF4y2Ba酚类组分对POD活性的抑制作用。POD活性的抑制率如图所示。GydF4y2Ba4GydF4y2BaG的测定方法是将各馏分(A)的100 μM GAE(没食子酸当量)添加到活性测定反应中,如图所示。GydF4y2Ba4GydF4y2BaC。GydF4y2BaCGydF4y2Ba各组分对POD的IC50值。以没食子酸为参比,测定各组分(F1、F2、F13、F14)对POD活性的半数最大抑制浓度(IC50)值,如(B)所示,抑制率均在50%以上,具有较高的抑制效果。GydF4y2BaD-G.GydF4y2Ba高抑制组分的UPLC-DAD谱以280 nm的吸光度表示。高抑制组分GydF4y2BaExcoecariaGydF4y2Ba叶如(C)所示由UPLC-DAD分别分析GydF4y2Ba
采用UPLC-DAD-QTOF-MS/MS进一步分析F1、F2、F13和F14馏分中的化合物(表1)GydF4y2Ba2GydF4y2Ba和无花果。GydF4y2Ba5GydF4y2BaD-G)。基于否定模式的MS / MS图中的片段离子(附加文件GydF4y2Ba2GydF4y2Ba图S2)、GA片段(78.01,125.02,169.01)和HHDP (hexahydroxydiphenyl)单元(300.99)均在4个组分中检测到,表明化合物为GA或HHDP衍生物(表2)GydF4y2Ba2GydF4y2Ba;额外的文件GydF4y2Ba2GydF4y2Ba:图S2)。The major compounds in F1, both Cpd 1 and 2 were monogalloylglucose with mass of 332 Da. Both Cpd 3 and 4 in F2 were galloyl quinic acid with mass of 344 Da. In F13, Cpd 5 was identified as methyl gallic acid with mass of 184 Da, Cpd 6,7 and 8, were identified as three ellagitannins (HHDP derivatives, with mass of 952, 1104, 1118 Da respectively). Five compounds were identified in F14, including Cpd 9, another methyl gallic acid with mass of 184 Da; another two ellagitannins (Cpd 10 and 11, with mass of 952 and 966 Da respectively); two galloylglucoses (simple gallic acid derivatives), tetragalloyl hexoside (Cpd 12) and pentagalloyl hexoside (Cpd 13) (Table2GydF4y2Ba).总之,即使通过其他方法的化合物的进一步的识别是必需的,没食子酰基/ HHDP基部分的存在于级分的主要化合物被证实,表明高水平的GGS的/在酚馏分专家组负责对POD抑制。GydF4y2Ba
鉴定了更多可水解的单宁GydF4y2BaExcoecariaGydF4y2Ba但不是在GydF4y2Ba桂花GydF4y2Ba叶子GydF4y2Ba
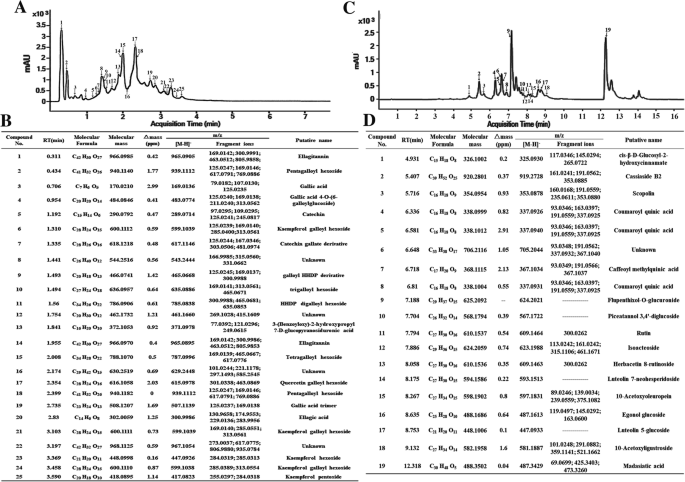
在对POD有较强抑制作用的酚组分中发现多个GGs/ETs的提示下,我们比较了酚类化合物的谱图GydF4y2Ba红背桂花和GydF4y2BaUPLC-DAD-QTOF-MS/MS分析。在280 nm处有25和19个吸光度峰GydF4y2Ba红背桂花和GydF4y2Ba分别(无花果。GydF4y2Ba6GydF4y2BaA和C)。将成功获得质谱/质谱的高A280nm的化合物与Metlin数据库中获得的信息进行比对(GydF4y2Bahttps://metlin.scripps.edu/GydF4y2Ba),Chemspider(GydF4y2Bahttp://www.chemspider.com/GydF4y2Ba)及Pubchem (GydF4y2Bahttps://pubchem.ncbi.nlm.nih.gov/GydF4y2Ba).在GydF4y2BaExcoecariaGydF4y2Ba,用[M-H]鉴定了加仑酸(CPD 3)和鞣花酸(CPD 20)GydF4y2Ba−GydF4y2Ba分别在m/z为169.0136和300.9986,特征子离子分别在m/z为125.0235和283.9956。25个化合物中,17个(Cpd 1、2、3、4、6、7、9、10、11、14、15、17、18、19、20、21、24)检测到m/z为169.0136、125.0235、300.9991的片段。连同MS和MS/MS光谱与上述数据库获得的信息对齐(附加文件)GydF4y2Ba4GydF4y2Ba:数据文件1),这些化合物被预测为是没食子酸,鞣花酸或HHDP衍生物,大多数被预测为GGS /与没食子酰基(化合物1,2,4,6,9,10,14,15的ET,17,18,19,21,24)或/和HHDP单元(化合物1,9,11,14),限定到糖部分(图GydF4y2Ba6GydF4y2Ba在简单没食子酸衍生物或鞣花单宁中,鞣花单宁(Cpd 1,14)、五烯丙基己糖苷(Cpd 2,18)和四烯丙基己糖苷(Cpd 15)的含量也很高GydF4y2BaExcoecariaGydF4y2BaPOD对高抑制效果的级分(图。GydF4y2Ba6GydF4y2BaB;表格GydF4y2Ba2GydF4y2Ba).相比GydF4y2BaExcoecariaGydF4y2Ba,不含水解单宁GydF4y2Ba桂花GydF4y2Ba(附加文件GydF4y2Ba5GydF4y2Ba:数据文件2)。相反,一些木质素构成,如化合物1中的肉桂酸;化合物4,5和8中的香豆蔻酰;化合物7中含有咖啡因酰GydF4y2Ba桂花GydF4y2Ba(无花果。GydF4y2Ba6GydF4y2Bad)。GydF4y2Ba
非目标酚类化合物的分析GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2BaUPLC-DAD-QTOF-MS / MS。GydF4y2Ba一个GydF4y2Ba来自酚类提取物的UPLC-DAD型材(A280nm)GydF4y2BaExcoecariaGydF4y2Ba叶子。从酚类化合物中提取GydF4y2BaExcoecariaGydF4y2Ba进行UPLC-DAD-QTOF-MS/MS分析。(B)中主要酚类化合物的峰数从1到25。GydF4y2BaBGydF4y2Ba主要酚类化合物的鉴定GydF4y2BaExcoecariaGydF4y2Ba叶子。在提取物中的化合物是基于MS和MS / MS谱鉴定(附加文件GydF4y2Ba4GydF4y2Ba:数据文件1),详细信息如表所示GydF4y2Ba2GydF4y2Ba.GydF4y2BaCGydF4y2Ba来自酚类提取物的UPLC-DAD型材(A280nm)GydF4y2Ba桂花GydF4y2Ba叶子。提取总酚类化合物GydF4y2Ba桂花GydF4y2Ba进行UPLC-DAD-QTOF-MS/MS分析。(D)中包括主要酚类化合物的峰值为1至19。GydF4y2BaDGydF4y2Ba主要酚类化合物的鉴定GydF4y2Ba桂花GydF4y2Ba叶子。在提取物中的化合物是基于MS和MS / MS谱鉴定(附加文件GydF4y2Ba5GydF4y2Ba:数据文件2),详细信息如表中所述GydF4y2Ba2GydF4y2Ba
高水平的可水解单宁与花青素共同定位GydF4y2BaExcoecariaGydF4y2Ba通过共色素作用抑制体内过氧化物酶活性并增加颜色强度GydF4y2Ba
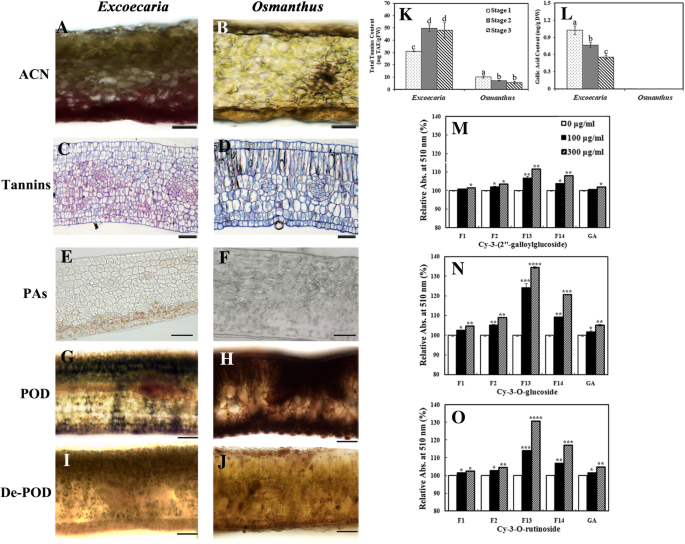
大多数已鉴定的酚类GydF4y2BaExcoecariaGydF4y2Ba,特别是对POD抑制效果高的,GGs/ETs属于水解单宁GydF4y2Ba2GydF4y2Ba和无花果。GydF4y2Ba6GydF4y2Bab)。因此,确定了总单宁内容物GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba叶片在叶片发育期间。鞣酸含量增加GydF4y2BaExcoecariaGydF4y2Ba随着叶片成熟,而在内容GydF4y2Ba桂花GydF4y2Ba在这个过程中,叶子减少了。单宁含量比对照高5倍GydF4y2BaExcoecariaGydF4y2Ba叶子比GydF4y2Ba桂花GydF4y2Ba在第2阶段,分别添加49.94 mg TAE/g FW和7.14 mg TAE/g FW。GydF4y2Ba7GydF4y2Bak)。在检测GA含量高GydF4y2BaExcoecariaGydF4y2Ba各龄期叶片水分含量的变化范围为0.55 ~ 1.01 mg/g DW。然而,在GydF4y2Ba桂花GydF4y2Ba在所有的阶段(图。GydF4y2Ba7GydF4y2BaL;额外的文件GydF4y2Ba3.GydF4y2Ba:图S3)。GydF4y2Ba
叶片中可水解单宁的定位及其与花青素的共色素作用及其对POD活性的抑制。GydF4y2BaA-B.GydF4y2Ba叶的第2期叶片的横截面GydF4y2BaExcoecariaGydF4y2Ba(一)和GydF4y2Ba桂花GydF4y2Ba(B)为花青素定位。Scale bars indicate 50 μm.光盘GydF4y2Ba用钌红和甲苯胺蓝联合染色法测定了紫穗槐2期叶片5 μm厚切片GydF4y2BaExcoecariaGydF4y2Ba(c)和GydF4y2Ba桂花GydF4y2Ba(D)比例尺表示100 μm。GydF4y2BaE-FGydF4y2Ba香兰素染色的阶段2叶片的各部分(5微米厚)的GydF4y2BaExcoecariaGydF4y2Ba(E)和GydF4y2Ba桂花GydF4y2Ba(F).刻度条表示100 μm。GydF4y2BaG-HGydF4y2Ba叶片中豆荚活性的组织化学定位。横截面GydF4y2BaExcoecariaGydF4y2Ba(G)和GydF4y2Ba桂花GydF4y2Ba(H)的叶片在阶段2用愈创木酚和H孵育GydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba在pH值7.0。比例尺表示100 μm。GydF4y2Bai jGydF4y2Ba对照横切面进行POD组织化学定位。横截面GydF4y2BaExcoecariaGydF4y2Ba(我和GydF4y2Ba桂花GydF4y2Ba(J)leaf blades as in (I-J) was boiled for 15 min for enzyme denature and served as the control. Scale bars indicate 100 μm.KGydF4y2Ba总单宁含量为TAE(单宁酸当量)GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba.GydF4y2BalGydF4y2Ba以没食子酸为标准,采用高效液相色谱法测定叶片中没食子酸含量(附文件GydF4y2Ba3.GydF4y2Ba:图S3)。(K-L)中值的统计细节如图所示。GydF4y2Ba1GydF4y2Ba.GydF4y2BaM-OGydF4y2Ba没食子糖/鞣花单宁对主要花青素的共色素作用GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba.510nm的Cy-3-(2“ - 金属葡糖苷)(m)和Cy-3-O-葡糖苷(n)的相对吸光度GydF4y2BaExcoecariaGydF4y2Ba来自Cy-3-O-Rutinoside的叶子GydF4y2Ba桂花GydF4y2Ba分别添加0、100、300 μg/mL的单宁酸后,叶片(O)的生长发育良好。星号(* p < 0.05)表示添加0和100或300 μg/mL的单宁酸之间的显著差异。两个星号代表GydF4y2BapGydF4y2Ba< 0.01,三个星号代表GydF4y2BapGydF4y2Ba< 0.001,四个星号表示GydF4y2BapGydF4y2Ba< 0.0001。所有的值都是三个个体重复测量的平均值GydF4y2Ba
通过钌红和甲苯胺蓝染色观察到叶子中单宁的位置。在7-8个细胞层中观察到强烈的粉红色染色GydF4y2BaExcoecariaGydF4y2Ba,但不在GydF4y2Ba桂花GydF4y2Ba细胞(图。GydF4y2Ba7GydF4y2BaC和D),表明单宁积累的高含量GydF4y2BaExcoecariaGydF4y2Ba叶子。为了更好地了解叶片组织中可水解单宁的水平,对缩合单宁(PAs)进行了香兰素染色。浅棕色染色仅在其背面2-3个细胞层可见GydF4y2BaExcoecariaGydF4y2Ba,但不在GydF4y2Ba桂花GydF4y2Ba细胞(图。GydF4y2Ba7GydF4y2Bae和f)。上述结果揭示了大量的的背轴面积累水解鞣质的GydF4y2BaExcoecariaGydF4y2Ba趁没人在家时离开GydF4y2Ba桂花GydF4y2Ba叶子。冰冻切片的结果表明,花青素主要位于的背面GydF4y2BaExcoecariaGydF4y2Ba叶在三个阶段(图GydF4y2Ba1GydF4y2BaC,无花果。GydF4y2Ba7GydF4y2BaA),不像花青素在正反两面的均匀分布GydF4y2Ba桂花GydF4y2Ba叶片在第1和第2阶段(图。GydF4y2Ba1GydF4y2BaD,无花果。GydF4y2Ba7GydF4y2BaB).此外,当叶片切片与POD底物共孵育时,叶片正面和背面的细胞均呈现深棕色GydF4y2Ba桂花GydF4y2Ba(无花果。GydF4y2Ba7GydF4y2BaH);而在GydF4y2BaExcoecariaGydF4y2Ba叶中,褐变强度小于叶中GydF4y2Ba桂花GydF4y2Ba且仅出现在近轴面(图。GydF4y2Ba7GydF4y2BaG)。结果表明,叶片两侧均有较高的POD活性GydF4y2Ba桂花GydF4y2Ba,虽然在轴向表面上几乎没有检测到活动GydF4y2BaExcoecariaGydF4y2Ba叶片,与位于叶片背面的高水平单宁相关(图。GydF4y2Ba7GydF4y2BaC-J)。GydF4y2Ba
水解单宁和花青素的copigmentation进行了研究。一个fter 0–300 μg/mL GAE of GA or the fractions (F1, F2, F13, F14) (Table2GydF4y2Ba)被添加到GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba在pH 3.0时,花青素溶液(0.05 mM)的红色强度显著增加(图3)。GydF4y2Ba7GydF4y2BaM-O),表明GGs/ETs与花青素发生共色素作用。GGs/ETs对花青素3- o -芦丁苷和花青素3- o -葡萄糖苷的红色影响比对花青素3-(2″-没子醇-葡萄糖苷)的颜色影响更大(图。GydF4y2Ba7GydF4y2BaM-O)。F13和F14,其中载有高含量的GGS / ETS(图GydF4y2Ba5GydF4y2Baf和g,表GydF4y2Ba2GydF4y2Ba),比F1、F2和GA在颜色强度上产生了更多的增强(图。GydF4y2Ba7GydF4y2BaM-O)。在Cyanidin 3-O-Rutinoside的510nm(A510nm)下,分别在300μg/ ml GAE F13和F14中加入300μg/ mL G14,为510nm(a510nm)的吸光度增加到30.88%和17.09%(图。GydF4y2Ba7GydF4y2BaO);用于矢车菊-3-O-葡糖苷更高34.57和20.83%A510nm(图GydF4y2Ba7GydF4y2BaN)的A510nm分别为11.67和7.99%(图2″-galloylglucoside)。GydF4y2Ba7GydF4y2Ba米)。GydF4y2Ba
总之,发现了高含量的可水解的单宁是共定位在的背轴面与花色素苷GydF4y2BaExcoecariaGydF4y2Ba叶绿素含量的增加显著提高了色素的颜色,降低了与POD相关的花青素降解活性。GydF4y2Ba
高水平的可水解单宁导致低pH值的背面GydF4y2BaExcoecariaGydF4y2Ba叶子GydF4y2Ba
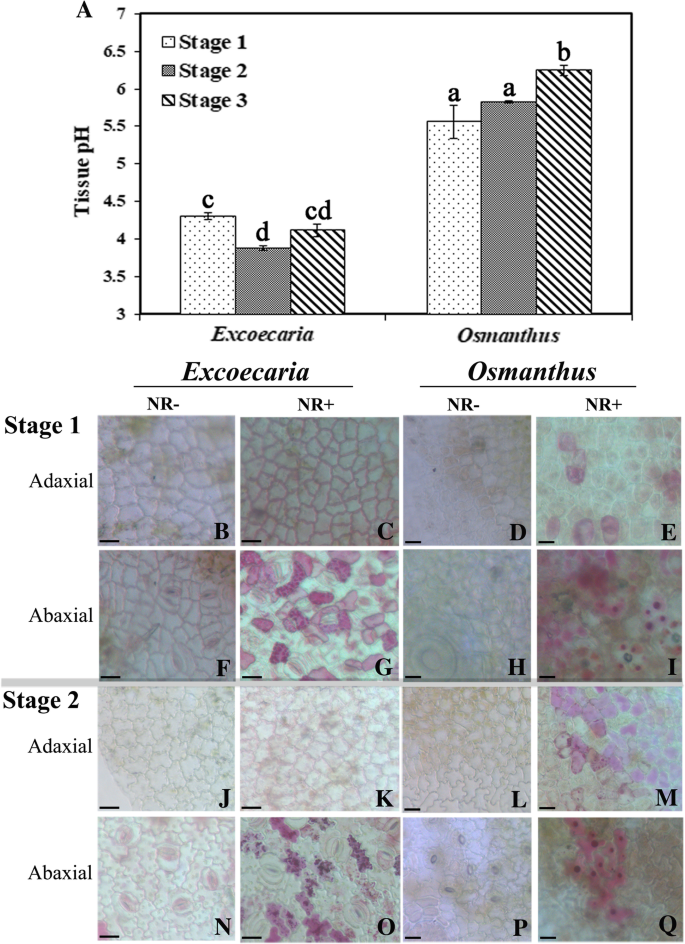
由于花青素的稳定性也依赖于细胞的pH值,因此测量两种植物中的pH值。记录了大约4.0至4.5 pH值GydF4y2BaExcoecariaGydF4y2Ba叶,这是比5.5至6的pH值下检测到GydF4y2Ba桂花GydF4y2Ba叶子(图。GydF4y2Ba8GydF4y2Ba一种)。中相应的表皮细胞的液泡体内酸度通过中性红(NR)染色(图中进一步测量。GydF4y2Ba8GydF4y2BaB-Q)。染色后,仅在表皮细胞的下轴部可见红色GydF4y2BaExcoecariaGydF4y2Ba叶子(图。GydF4y2Ba8GydF4y2Bag和o)而在两侧的表皮细胞中观察到红色着色GydF4y2Ba桂花GydF4y2Ba叶子(图。GydF4y2Ba8GydF4y2Bae,i,m和q)。染色的细胞GydF4y2BaExcoecariaGydF4y2Ba表现出比正常细胞更强的NR积累GydF4y2Ba桂花GydF4y2Ba(无花果。GydF4y2Ba8GydF4y2Bag,o,i和q),表示这些GydF4y2BaExcoecariaGydF4y2Ba细胞在更酸性的环境,这是有望增加花青素的稳定性。GydF4y2Ba
pH值的GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba叶子。(A)匀浆的pH值GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba叶子在水里。叶片发育阶段的细节如图所示。GydF4y2Ba1GydF4y2Ba.GydF4y2Bac, j - kGydF4y2Ba的近轴表皮细胞的中性红染色GydF4y2BaExcoecariaGydF4y2Ba叶子。近轴的表皮细胞GydF4y2BaExcoecariaGydF4y2Ba在阶段1(b),阶段2(j)和阶段1(c)阶段,第2(c),第2(k)阶段染色,阶段2(k)染色,染色的叶片染色。GydF4y2Ba做减法N-OGydF4y2Ba厌恶表皮细胞的NR染色GydF4y2BaExcoecariaGydF4y2Ba叶子。的背面表皮细胞GydF4y2BaExcoecariaGydF4y2Ba第1阶段(F)、第2阶段(N)和第1阶段(G)、第2阶段(O)有NR染色的叶片。GydF4y2BaD-E,L-MGydF4y2Ba近轴表皮细胞NR染色GydF4y2Ba桂花GydF4y2Ba叶子。近轴的表皮细胞GydF4y2Ba桂花GydF4y2Ba在第1(d)阶段,阶段2(L)和阶段1(e)阶段,第2阶段(m),叶片2(l)和Nr染色的叶片。GydF4y2BaH-I,P-QGydF4y2Ba厌恶表皮细胞的NR染色GydF4y2Ba桂花GydF4y2Ba叶子。的背面表皮细胞GydF4y2Ba桂花GydF4y2Ba第1阶段(H)、第2阶段(P)和第1阶段(I)、第2阶段(Q)有NR染色的叶片GydF4y2Ba
讨论GydF4y2Ba
一般而言,花青素瞬时在幼叶积累,以保护组织免受光的损害,并且将颜料后叶成熟或在形状上迅速降解[GydF4y2Ba1GydF4y2Ba].然而,在某些形状下垫层植物,如GydF4y2Ba紫鸭跖草GydF4y2Ba[GydF4y2Ba51GydF4y2Ba],GydF4y2Ba秋海棠GydF4y2Ba[GydF4y2Ba23GydF4y2Ba],GydF4y2Ba仙客来GydF4y2Ba[GydF4y2Ba22GydF4y2Ba),而GydF4y2BaExcoecariaGydF4y2Ba[GydF4y2Ba47GydF4y2Ba],成熟后,即使在弱光条件下,花青素仍保持在叶片的背面[GydF4y2Ba21GydF4y2Ba,GydF4y2Ba52GydF4y2Ba].成熟叶片背面花青素的维持对这些林下植物具有重要的光保护作用,但其机制尚不清楚。在本研究中,为了研究叶片中可能阻止花青素在背面红色叶片中降解的潜在因素,我们比较了花青素酶降解和永久性色素沉淀植物(GydF4y2BaExcoecariaGydF4y2Ba)和瞬态的色素沉着植物(GydF4y2Ba桂花GydF4y2Ba).GydF4y2Ba
我们首先研究的是永久性和暂时性的色素沉着GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba叶片的差异是由于花青素类型的不同。事实上,我们发现了高水平的没食子酸花青素(花青素与没食子酸酰基化)GydF4y2BaExcoecariaGydF4y2Ba而所有的颜料GydF4y2Ba桂花GydF4y2Ba是non-galloylated(表GydF4y2Ba1GydF4y2Ba,无花果。GydF4y2Ba2GydF4y2Ba未乙酰化花青素也存在于红叶中GydF4y2Ba挪威枫GydF4y2Ba“深红之王”(GydF4y2Ba53GydF4y2Ba],绳绒花的红花,GydF4y2BaAcalypha Hispida.GydF4y2Ba发热管。[GydF4y2Ba54GydF4y2Ba].据报道,携带芳族酰基取代基的花青素包括GydF4y2BapGydF4y2Ba香豆,咖啡,阿魏酸,芥子酸,高卢酸或GydF4y2BapGydF4y2Ba-羟基苯甲酸,由于分子内共色素沉着,表现出极大的稳定性[GydF4y2Ba55GydF4y2Ba,GydF4y2Ba56GydF4y2Ba,GydF4y2Ba57GydF4y2Ba].此外,酰化花青素被报道为一种更有效的光保护手段,它能提供植物超快的能量耗散和显著的UV-B吸收能力[GydF4y2Ba58GydF4y2Ba].在本研究中,发现Cyanidin 3-(2“ - 金酰葡糖苷)比花青蛋白3-O-Rutinoside和Cyanidin 3-O-葡糖苷更稳定(图。GydF4y2Ba3.GydF4y2Ba然而,无论是没有galloylated和没有galloylated花青素分离GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba分别在过氧化物酶(POD)存在下迅速降解(图。GydF4y2Ba4GydF4y2BaI).考虑到酶的降解可能比体内组织的自发分解起更重要的作用[GydF4y2Ba35GydF4y2Ba,GydF4y2Ba36GydF4y2Ba,我们推测其他因素,而不是色素的稳定性,可能在防止色素降解中发挥更重要的作用GydF4y2BaExcoecariaGydF4y2Ba(无花果。GydF4y2Ba3.GydF4y2BaE)。GydF4y2Ba
有研究表明,荚果和漆酶(LAC创建)负责在植物中花色素苷降解GydF4y2Ba35GydF4y2Ba,GydF4y2Ba36GydF4y2Ba].本论文利用部分纯化的花青素GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba年轻的叶子分别,强壮hGydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba用于检测依赖ADE活动GydF4y2Ba桂花GydF4y2Ba叶子却只留下活动的痕迹GydF4y2BaExcoecariaGydF4y2Ba叶子(图。GydF4y2Ba4GydF4y2Baa - b, d e)。有趣的是,凝胶试验检测到ADE活性带的大小(图。GydF4y2Ba4GydF4y2BaD和E)与凝胶中POD活性测定显示的条带大小相似(图。GydF4y2Ba4GydF4y2BaF),证实了pod在叶片花青素降解中起主要作用[GydF4y2Ba36GydF4y2Ba,GydF4y2Ba59GydF4y2Ba].利用POD抗体证明两种植物叶片中ADE/POD蛋白水平无显著差异(图2)。GydF4y2Ba4GydF4y2Baj);但是,ADE / POD活动GydF4y2BaExcoecariaGydF4y2Ba显著低于GydF4y2Ba桂花GydF4y2Ba(无花果。GydF4y2Ba4GydF4y2BaC和F),提示ADE/ pod抑制剂可能存在于GydF4y2BaExcoecaria叶子GydF4y2Ba.GydF4y2Ba
因此,我们分离出15个酚类组分GydF4y2BaExcoecariaGydF4y2Ba叶子(图。GydF4y2Ba5GydF4y2BaA),发现其中4个组分对ADE/POD活性有较高的抑制作用(图4)。GydF4y2Ba5GydF4y2BaUPLC-MS/MS结果进一步表明,4个组分(F1、F2、F13、F14)的主要成分为没食子酸(GA)衍生物,主要为GGs/ETs(表)GydF4y2Ba2GydF4y2Ba).结果表明,GGs/ETs富集组分对ADE/POD活性有抑制作用,其半数最大抑制浓度(IC50)为67.24 ~ 83.27 μM GAE,略低于GA (IC50 = 35.55 μM)(图2)。GydF4y2Ba5GydF4y2BaC).结果表明天然存在GA和GGs/ETsGydF4y2BaExcoecariaGydF4y2Ba叶子抑制豆荚介导的花青素降解。在先前的研究中报道了对POD的抑制及其衍生物,其中Gallic酸和鞣花酸作为非竞争性抑制剂,分别为牛值分别为28.29和14.74μm的牛乳清豆荚[GydF4y2Ba60GydF4y2Ba].据报道,艾尔塔基宁蛋白是许多其他酶的有效抑制剂,可能是由于它们的结合蛋白质的能力[GydF4y2Ba61GydF4y2Ba].Pomegranate ellagitannins, punicalagin, punicalin, and ellagic acid were identified as α-glucosidase inhibitors (IC50 of 140.2, 191.4, and 380.9 μM, respectively) [62GydF4y2Ba].从玫瑰花蕾提取物粉末中分离得到7种鞣花丹宁,其对二肽基肽酶- iv (DPP-IV)的抑制活性与本研究的鞣花丹宁组分相同[GydF4y2Ba63GydF4y2Ba(图。GydF4y2Ba5GydF4y2BaC)。从鞣花单宁GydF4y2Ba仙鹤草GydF4y2BaLedeb对蛋白酪氨酸磷酸酶具有显著的抑制作用,IC50值为17.03±0.09 μM [GydF4y2Ba64GydF4y2Ba].在本研究中,除了无碱酸和鞣花酸外,检测到多个GGS / ETEGydF4y2BaExcoecariaGydF4y2Ba未发现没食子酸及其衍生物GydF4y2Ba桂花GydF4y2Ba叶子(图。GydF4y2Ba6GydF4y2Ba).结果表明,虽然两种植物的POD蛋白水平相似GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba(无花果。GydF4y2Ba4GydF4y2BaJ)用于检测显着更低的活动GydF4y2BaExcoecariaGydF4y2Ba叶子(图。GydF4y2Ba4GydF4y2BaC)。此外,组织化学分析显示极低的POD活性的背轴面检测GydF4y2BaExcoecariaGydF4y2Ba可水解单宁的位置(图。GydF4y2Ba7GydF4y2BaG-J),进一步证实没食子酸衍生物和鞣花单宁抑制过氧化物酶介导花青素降解的活性GydF4y2BaExcoecariaGydF4y2Ba叶子(图。GydF4y2Ba5GydF4y2Ba).GydF4y2Ba
花青素的稳定性也依赖于络合剂(酚类,金属离子就是)和pH [存在GydF4y2Ba65GydF4y2Ba].许多研究表明,连翘是提高花青素的颜色强度和稳定性的有效方法[GydF4y2Ba66GydF4y2Ba,GydF4y2Ba67GydF4y2Ba,GydF4y2Ba68GydF4y2Ba,GydF4y2Ba69GydF4y2Ba].Gallic acid是一种众所周知的Copigation试剂,在蔓越莓汁中效应花青素稳定性[GydF4y2Ba70GydF4y2Ba],归因于它的芳环的最短距离的花青素面板[GydF4y2Ba71GydF4y2Ba].在花瓣中鉴定了几个戈兰林和蛋白质胰岛素GydF4y2Ba天竺葵sylvaticumGydF4y2Ba并通过分子间共色素沉着有效地维持了紫色[GydF4y2Ba72GydF4y2Ba].在本研究中,发现了高水平的简单没食子酸衍生物(没食子酸葡萄糖)和鞣花单宁GydF4y2BaExcoecariaGydF4y2Ba树叶,但没有发现GydF4y2Ba桂花GydF4y2Ba(无花果。GydF4y2Ba6GydF4y2Ba).没食子酸和含GGs/ETs的酚类组分显著提高了花青素溶液的红色强度,而GGs/ETs的共色素作用远比没食子酸显著(图2)。GydF4y2Ba7GydF4y2BaM-O)。此外,与之前的研究相关联,没食子酸衍生物造成的酸性环境比许多其他有机酸更强[GydF4y2Ba73GydF4y2Ba,GydF4y2Ba74GydF4y2Ba],对于检测到更多的酸性条件下GydF4y2BaExcoecariaGydF4y2Ba叶子比GydF4y2Ba桂花GydF4y2Ba,通过测量叶片匀浆的pH值的方法(图。GydF4y2Ba8GydF4y2BaA),或液泡中性红富集(图。GydF4y2Ba8GydF4y2BaB-Q)。该水解单宁和花青素是对的背面侧共定位的事实GydF4y2BaExcoecariaGydF4y2Ba叶子(图。GydF4y2Ba7GydF4y2BaA-F);对脂肪表面的酸条件比Adaxial表面更高GydF4y2BaExcoecariaGydF4y2Ba叶子(图。GydF4y2Ba8GydF4y2Ba),表明没食子酸及其衍生物的存在不仅与花青素相互作用,增加了花青素的稳定性和颜色增强,而且还导致了花青素背面的低pH环境GydF4y2BaExcoecariaGydF4y2Ba叶子保持红色。GydF4y2Ba
结论GydF4y2Ba
总之,在热带林下植物的背轴面上积累的花青素在间歇性暴露于高强度阳光(即阳光斑块)时提供了光保护。基于目前的研究数据,我们认为,一组独特的酚类化合物,GGs/ETs,大量积累在背面层GydF4y2BaExcoecariaGydF4y2Ba叶抑制POD由copigmentation介导的花青素的花色素苷降解,增加稳定性和颜色强度,导致离轴红叶的永久的保养。GydF4y2Ba
材料和方法GydF4y2Ba
植物材料GydF4y2Ba
Excoecaria cochinchinensisGydF4y2Ba不悦之色。和GydF4y2Ba桂花雀族GydF4y2Ba常绿变种叶片在三个阶段(红色,绿色,绿色,如图1,2,3。GydF4y2Ba1GydF4y2BaA和B)分别在中国南方市广州市,中国东南市校园内收集(23°7°,113°E)。取样的叶子在液体n中立即进行或冷冻GydF4y2Ba2GydF4y2Ba保存至−80℃。GydF4y2Ba
花青素和叶绿素含量测定GydF4y2Ba
花青素的定量方法如下[GydF4y2Ba75GydF4y2Ba].用分光光度计(Shimadzu UV-2450, Kyoto, Japan)在530 nm和645 nm处测定去叶绿素花青素提取物的吸光度。花青素含量计算为(AGydF4y2Ba530GydF4y2Ba-0.25GydF4y2Ba×GydF4y2Ba一个GydF4y2Ba645.GydF4y2Ba) gGydF4y2Ba−1GydF4y2Ba鲜重(FW)。GydF4y2Ba
为进一步测定各主要花青素的含量GydF4y2BaExcoecariaGydF4y2Ba叶子,在经过HPLC分析之前,通过0.22μm疏水聚偏二氟化硼(PVDF)膜(ANPEL Scientific Instruments,Shanghai,China)过滤了花青素提取物。在Agilent 1200系列HPLC系统(Agilent Tech,Agilent Tech。,Santa Clara,CA,USA)中进行分离花青素。将提取物注入C18(2)柱(Luna®,5μm,250×4.6mm,现象,托兰,CA,USA)。流动相由0.1%甲酸(Fa)组成,乙腈(A)和0.1%Fa在水(B)中。使用0.8ml / min的流速的梯度洗脱在35℃下以超过35分钟以上的10至45%。注射体积为20μL。监测波长以530nm记录。每个主要花青素的相对含量(分别由HPLC收集的主要峰值级分,并通过如“的UPLC-QTOF-MS / MS进一步鉴定”GydF4y2Ba花青素的分析GydF4y2Ba“)在成熟过程中GydF4y2BaExcoecariaGydF4y2Ba根据峰面积计算叶片。GydF4y2Ba
对于叶绿素(CHL)含量测定,将冷冻叶(1g)研磨在液氮中,并在4℃下在黑暗中置于10ml冷含水丙酮(80%,v / v)中过夜。在10,000g离心10分钟后,用冷水丙酮再萃取残余物直至其变得无色。将所有上清液合并并带到20毫升。然后通过663nm和645nm的分光光度计测量CHL上清液的吸光度。按照描述计算每重的叶片的CHL浓度[GydF4y2Ba76GydF4y2Ba].GydF4y2Ba
花青素的分析GydF4y2Ba
50克的红叶GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba分别用350 mL 0.3 M HCl溶液多次浸泡提取花青素。然后用Amberlite XAD-7树脂(Sigma-Aldrich, Saint Louis, MO, USA)柱(1.5 × 40 cm)对粗花青素提取物进行部分纯化,如所述[GydF4y2Ba77GydF4y2Ba].收集红色馏分,并用旋转蒸发器(Heidolph, Schwabach, Germany)进行浓缩。将浓缩后的花青素溶解在4 mL 10% (v/v) FA中,装入Sephadex LH 20 (5.5 × 90 cm, Sigma)柱中进行进一步纯化。以10% FA为洗脱液,流速为1 mL/min。馏分(2 mL/管)用馏分收集器收集。用分光光度计在510 nm处检测洗脱。根据510 nm处的吸光度值,将主峰的组分聚在一起,用Amberlite XAD-7树脂再次纯化,在甲醇中交换10% FA到0.05% FA的溶剂,然后进行浓缩。纯化后的花青素通过0.22 μm PVDF膜过滤,转移到瓶中进行分析。GydF4y2Ba
采用高效液相色谱(HPLC)结合二极管阵列检测(DAD)和电喷雾电离质谱(ESI/MS)对纯化的花青素进行鉴定[GydF4y2Ba78GydF4y2Ba],在一个UPLC1290-6540B Q-TOF(安捷伦科技,新加坡),再加上一个6540 UHD Q-TOF ESI质谱仪(安捷伦科技,新加坡)。The chromatographic separation was achieved on an Agilent eclipse plus 50 × 2.1 mm, 1.8 μm column and the monitoring wavelength was recorded at 280 nm. The mobile phase consisted of acetonitrile (A) and 0.2% FA in water (B). Gradient elution at a flow rate of 0.4 mL/min was used from 10 to 90% A at 35 °C. The MS was recorded with a heat capillary voltage of 4 kV, spectra were recorded in positive ion mode between m/z 100 and 1500 with heated dry nitrogen gas at temperature 300 °C and flow rate 8 L/min was used. Nitrogen was used as the nebulizing gas (40 psi) and the fragmentation voltage was 160 V. The identification of the compounds were based on the searching of m/z values of the compounds in Metlin databases (https://metlin.scripps.edu/GydF4y2Ba)和Chemspider数据库中MS/MS片段离子的比较(GydF4y2Bahttp://www.chemspider.com/GydF4y2Ba)及Pubchem (GydF4y2Bahttps://pubchem.ncbi.nlm.nih.gov/GydF4y2Ba).GydF4y2Ba
总单宁含量测量GydF4y2Ba
总单宁的提取和测定方法如下所述[GydF4y2Ba39GydF4y2Ba].单宁含量表示为每克新鲜组织(Mg Tae / G FW)的单宁酸(Gallotannin,Sigma)当量的毫克。GydF4y2Ba
叶组织中单宁的花青素位置和染色GydF4y2Ba
手横截面的叶片GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba分别浸泡在ddHGydF4y2Ba2GydF4y2BaO,并用光学显微镜观察颜料分布(德国徕卡微系统公司)。GydF4y2Ba
根据所述方法对叶片组织中的单宁进行染色[GydF4y2Ba79GydF4y2Ba].首先,按照所述进行固定和切片[GydF4y2Ba39GydF4y2Ba].简单地说,圆盘(2毫米× 2毫米)GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba叶片分别在含有4% (w/v)多聚甲醛,2% (w/v)戊二醛的100 mM磷酸盐缓冲液(PBS, pH 7.2)中固定12 h。PBS洗涤后,分别用梯度乙醇和LRWhite树脂(Sigma)脱水渗透,最后用纯LRWhite替代。然后将样品转移到带有新鲜LRWhite的胶囊中,并在两盏15瓦紫外灯(360 nm)下在−20℃下至少固化24 h,然后在RT下继续固化48 h [GydF4y2Ba39GydF4y2Ba].F要么tannins staining, 5-μm-thick sections obtained on a microtome (Leica Microsystems, Wetzlar, Germany) were incubated in ruthenium red (0.05% aqueous) for 2 min and then washed before incubated again in toluidine blue (0.1% aqueous) for 1 min [79GydF4y2Ba].观察和照片是在光学显微镜(Optiphot,尼康,东京,日本)上完成的。为了更好地了解上述叶片中单宁染色中可水解单宁的水平,我们还对植物组织中缩合单宁(PAs)进行了香兰素染色[GydF4y2Ba39GydF4y2Ba].GydF4y2Ba
非目标酚类化合物的UPLC-DAD-QTOF-MS/MS分析GydF4y2Ba
酚类物质的提取方法如下[GydF4y2Ba80GydF4y2Ba],以含1%苯并噻二唑(BTH)的70% (v/v)丙酮水溶液为萃取液。最终提取液(100 μL)在氮气流下干燥,再用1 mL 60% (v/v)乙醇溶解,通过0.22 μm PVDF膜过滤,转移到瓶中进行分析。GydF4y2Ba
上述酚类提取物的非目标谱GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba分别进一步表征由UPLC-QTOF-MS / MS,如“GydF4y2Ba花青素的分析GydF4y2Ba,在3.5 kV毛细管热电压下记录质谱,在m/z 100 ~ 1100之间以负离子模式记录光谱。破碎电压为150 V。GydF4y2Ba
用交联葡聚糖LH 20的酚类化合物的柱色谱法GydF4y2Ba
The above phenolic extracts from the leaves were also purified by Sephadex LH 20 (1.5 × 70 cm) column chromatography. The dried crude extracts (1 g dried sample extraction for described column dimension) were first dissolved in 2 mL aqueous 3% (v/v) FA and the insoluble residue was then dissolved in 1 mL methanol. The 3 mL sample was loaded onto the column that had been equilibrated with aqueous 3% (v/v) FA. Elution was performed with gradient aqueous methanol, from 20 to 100%, at a flow rate of 20 mL/h. Fractions (3 mL/tube) were collected with a fraction collector.
根据280 nm处的吸光度值(图。GydF4y2Ba5GydF4y2BaA),将酚类提取物的各馏分组合成15个大馏分即F1-F15。15个馏分的总酚含量采用福林- ciocalteu法测定,如所述[GydF4y2Ba39GydF4y2Ba].用没食子酸标定曲线计算没食子酸当量(μg/mL GAE)。GydF4y2Ba
高效液相色谱法测定没食子酸含量GydF4y2Ba
酚类物质分三个阶段GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba分别按“GydF4y2Ba非目标酚类化合物的UPLC-DAD-QTOF-MS/MS分析GydF4y2Ba“[GydF4y2Ba80GydF4y2Ba].如所描述的每个样品的过滤的提取物通过HPLC分离[GydF4y2Ba39GydF4y2Ba].柱温为25℃。通过与标准没食子酸的保留时间(Sigma-Aldrich)比较,确定各样品中没食子酸(GA)的峰,并通过标准添加法进一步确认。简单地说,在样品提取物中分别加入2,4 μg/mL标准没食子酸,并监测没食子酸峰面积的增加。根据没食子酸标准曲线计算各样品粗提物中没食子酸含量[mg/g DW(干重)]。GydF4y2Ba
酶提取,SDS-PAGE和POD免疫检测GydF4y2Ba
通过将叶片(2g)均化用8ml 0.1m pH 7.0磷酸钾缓冲液(KPB)均化均化粗酶,含有30%(w / w)聚乙烯醇吡咯烷酮(PVPP)和80μl蛋白酶抑制剂溶液[1片蛋白酶抑制剂(完全™,迷你,乙二胺四乙酸(EDTA)-FREE蛋白酶抑制剂鸡尾酒,罗氏,罗氏,曼海姆,德国)溶解在10mL KPB中。离心后(20分钟,12,000g,4℃),以粗酶提取物或蛋白质提取物的可溶性部分收集上清液[GydF4y2Ba81GydF4y2Ba].将上述萃取残渣重悬于上述含8 M尿素的KPB中进行均质。离心后,收集上清液作为蛋白质提取液的不溶部分[GydF4y2Ba39GydF4y2Ba].蛋白浓度用考马斯亮蓝G-250测定。GydF4y2Ba
酶粗提物在Laemmli样品缓冲液中煮沸10分钟变性,然后按照标准条件在10% (w/v)十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中分离[GydF4y2Ba39GydF4y2Ba].GydF4y2Ba
对叶片中POD水平进行免疫检测,方法如下[GydF4y2Ba39GydF4y2Ba,使用多克隆抗辣根POD抗体(Agrisera antibody, Vännäs, Sweden)。GydF4y2Ba
花青素降解酶/过氧化物酶(ADE/POD)活性测定GydF4y2Ba
花青素在GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba分别提取叶片并部分纯化如“GydF4y2Ba花青素的分析GydF4y2Ba”。用ph -微分法测定花青素的浓度,如所述[GydF4y2Ba82GydF4y2Ba].用0.2 M乙酸钠缓冲液(pH 4.0)将浓缩的花青素分别稀释至0.05 M,制备2种测定ADE/POD活性的花青素底物。GydF4y2Ba
利用花青素底物测定ADE/POD活性时,将酶粗提物(0.1 mL)添加到2.0 mL花青素底物中,添加或不添加2 mM HGydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba.40℃孵育20 min。在甲醇中加入2ml 0.1 M的HCl终止反应。与与变性酶平行建立的反应相比,在530 nm处记录了由于反应混合物中花青素的降解而降低的吸光度。如所描述的[GydF4y2Ba40GydF4y2Ba, ADE活性的一个单位是降解1 μmol cyanidin-3-glucoside所需的ADE量(ε = 29600 M)GydF4y2Ba−1GydF4y2Ba厘米GydF4y2Ba−1GydF4y2Ba)每小时在40°C时。ADE活性表示为μmolHGydF4y2Ba−1GydF4y2Ba g−1GydF4y2BaFW。GydF4y2Ba
以愈创木酚为底物,在含有0.05 mL酶粗提物、2.75 mL 50 mM磷酸盐缓冲液(pH 7.0)、100 μL 150 mM H的反应混合物(3 mL)中测定POD活性GydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba和20.0 μL of 200 mM guaiacol. As described [83GydF4y2Ba在470 nm (ε = 6740 M)下,观察了愈栎醇在反应混合物中氧化引起的吸光度增加GydF4y2Ba−1GydF4y2Ba厘米GydF4y2Ba−1GydF4y2Ba),用分光光度计检测2分钟。POD活性以μmol/h表达GydF4y2Ba−1GydF4y2Ba g−1GydF4y2BaFW (1 μmol of substrate conversion/h−1GydF4y2Ba g−1GydF4y2Ba弗兰克-威廉姆斯)。GydF4y2Ba
ADE / POD活性凝胶染色使用两个衬底具有或不具有ħGydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba以上但没有蛋白质样品煮沸即半天然PAGE所描述PAGE后进行。The gel was then rinsed twice with the buffer for 5 min to remove SDS and immersed in the same buffer containing the substrates with 2 mM H2GydF4y2BaOGydF4y2Ba2GydF4y2Ba或没有HGydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba直到乐队被可视化。GydF4y2Ba
过氧化物酶的部分纯化GydF4y2Ba桂花GydF4y2Ba叶子GydF4y2Ba
八十克的冷冻GydF4y2Ba桂花GydF4y2Ba叶片粉碎后立即匀浆于300 mL 0.1 M KPB (pH 7.0)中,其中含有8.6 mM二硫苏糖醇(DTT)、5 mM EDTA、1 mM苯甲基磺酰氟(PMSF)和5% (w/v) PVPP,然后12,000 g离心20分钟[GydF4y2Ba39GydF4y2Ba].用硫酸铵沉淀(70 ~ 100%)进一步分离提取物,12000 g离心20 min。沉淀再次悬浮,在0.01 M KPB (pH 7.0)含2.2 mM DTT的条件下透析。GydF4y2Ba
花青素的体外稳定性GydF4y2Ba
三种主要花青素在GydF4y2Ba花青素的分析GydF4y2Ba,如图所示。GydF4y2Ba2GydF4y2Ba冻干后再溶于0.2 M乙酸钠缓冲液(pH 4.0)中。纯化产物ADE/POD活性测定如下GydF4y2Ba桂花GydF4y2Ba将POD(5μl)加入到125μl的上述底物中,1μl1mmHGydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba.混合物在25°C孵育20分钟。加125 μL氯仿终止反应。离心(13000 g, 5 min)后,上清液中剩余花青素的相对含量在510 nm处用高效液相色谱法测定,具体方法见GydF4y2Ba花青素和叶绿素含量测定GydF4y2Ba,与与变性酶平行的反应相比。GydF4y2Ba
在0.4 M柠檬酸-磷酸氢二钠缓冲液中分别制备0.05 mM的花青素,pH为3.0,室温放置21 d。分别记录0天和21天各花青素溶液在510 nm处的吸光度,分析不同类型花青素的稳定性GydF4y2Ba.GydF4y2Ba
单宁成分的IC50值和共色素作用的测定GydF4y2Ba
纯化的单宁成分的半最大抑制浓度(IC50)GydF4y2Ba桂花GydF4y2BaPOD(0.6 μg) was tested by 0, 10, 20, 40, 60, 80, 100 μM GAE of the F1, F2, F13, F14 sub-fractions and GA. The POD activities were measured as described above and the inhibition ratio was obtained by calculating the percentage of the decrease in the activity due to the addition of the tannin constituents, to the activity without addition.
分别在花青素溶液中加入0、100、300 μg/mL GAE的F1、F1、F2、F13和F14四个组分,以相同水平的没食子酸作为参考。加入后2小时,记录每种混合物在510 nm处的吸光度,分析单宁成分对花青素颜色强度的影响GydF4y2Ba.GydF4y2Ba
ADE/POD在叶片组织中的组织化学染色和定位GydF4y2Ba
用剃须刀片手切叶片横切面,用冷PBS(磷酸盐缓冲液)(50 mM, pH 7.0)冲洗,并在25°C过氧化氢酶(100 mg/mL;Sigma-Aldrich)以消除内源性过氧化氢。然后将样品冲洗几次以去除过氧化氢酶,并在25°C的含13.3 mM愈伤愈醇和5 mM H的PBS中孵育GydF4y2Ba2GydF4y2BaOGydF4y2Ba2GydF4y2Ba.The controls were cross sections boiled for 15 min to destroy enzyme activity. The treated cross sections were observed by the light microscopy [35GydF4y2Ba].GydF4y2Ba
中性红染色检测组织细胞液pH和液泡酸度GydF4y2Ba
如所描述的,测定叶组织细胞液pH值[GydF4y2Ba84GydF4y2Ba].匀浆的pH值由pH计测量(satious, Göttingen,德国)。用中性红(NR, Sigma)测定叶片细胞的亚液泡酸度[GydF4y2Ba85GydF4y2Ba].新鲜叶片组织切片GydF4y2BaExcoecariaGydF4y2Ba和GydF4y2Ba桂花GydF4y2Ba分别浸入NR溶液(20mg / L)中,在室温下孵育20分钟。通过光学显微镜观察NR染色和非染色组织切片的Adaxial / Zaxial表皮细胞。GydF4y2Ba
统计分析GydF4y2Ba
从3个生物重复样本中收集数据。数值以平均值±平均值标准误差(SEM)表示。采用未配对t检验(GydF4y2BaPGydF4y2Ba< 0.05),使用GraphPad QuickCalcs在线软件(Prism 7, GraphPad software, San Diego, CA, USA)。GydF4y2Ba
可用性数据和材料GydF4y2Ba
本研究中生成或分析的所有数据均包含在本文及其附加文件中。GydF4y2Ba
缩写GydF4y2Ba
- [M + H]GydF4y2Ba+GydF4y2Ba:GydF4y2Ba
-
分子离子GydF4y2Ba
- (mh)GydF4y2Ba−GydF4y2Ba:GydF4y2Ba
-
分子离子GydF4y2Ba
- 正面:GydF4y2Ba
-
花青素降解酶GydF4y2Ba
- BTH:GydF4y2Ba
-
苯并噻二唑GydF4y2Ba
- Cpd:GydF4y2Ba
-
化合物GydF4y2Ba
- 爸爸:GydF4y2Ba
-
二极管阵列检测GydF4y2Ba
- 民进党:GydF4y2Ba
-
Dipeptidyl肽酶GydF4y2Ba
- 德勤:GydF4y2Ba
-
dithiothreitol.GydF4y2Ba
- 德国之声:GydF4y2Ba
-
干重GydF4y2Ba
- EDTA:GydF4y2Ba
-
乙二胺四乙酸GydF4y2Ba
- ESI / MS:GydF4y2Ba
-
电喷雾电离质谱GydF4y2Ba
- 费尔南多-阿隆索:GydF4y2Ba
-
甲酸GydF4y2Ba
- 遗传算法:GydF4y2Ba
-
没食子酸GydF4y2Ba
- GAE:GydF4y2Ba
-
没食子酸当量GydF4y2Ba
- gg / ETs:GydF4y2Ba
-
Galloylglucoses /鞣花单宁GydF4y2Ba
- HHDP:GydF4y2Ba
-
Hexahydroxydiphenoyl.GydF4y2Ba
- 高效液相色谱法:GydF4y2Ba
-
高效液相色谱法GydF4y2Ba
- IC50:GydF4y2Ba
-
半最大抑制浓度GydF4y2Ba
- KPB:GydF4y2Ba
-
钾磷酸盐缓冲液GydF4y2Ba
- LAC:GydF4y2Ba
-
漆酶GydF4y2Ba
- NPQ:GydF4y2Ba
-
Non-photochemical淬火GydF4y2Ba
- NR:GydF4y2Ba
-
中性红GydF4y2Ba
- P:GydF4y2Ba
-
顶峰GydF4y2Ba
- 不是:GydF4y2Ba
-
原花青素/浓缩单宁GydF4y2Ba
- PBS:GydF4y2Ba
-
磷酸缓冲液GydF4y2Ba
- PMSF:GydF4y2Ba
-
苯甲基磺酰氟GydF4y2Ba
- 圆荚体:GydF4y2Ba
-
过氧化物酶GydF4y2Ba
- ppo:GydF4y2Ba
-
多酚氧化酶类GydF4y2Ba
- PVDF:GydF4y2Ba
-
聚乙二烯二氟化物GydF4y2Ba
- PVPP:GydF4y2Ba
-
PolyvinylpolypyrrolidoneGydF4y2Ba
- Rt:GydF4y2Ba
-
保留时间GydF4y2Ba
- sds - page:GydF4y2Ba
-
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳GydF4y2Ba
- 扫描电镜:GydF4y2Ba
-
平均标准误差GydF4y2Ba
- TAE:GydF4y2Ba
-
丹宁酸当量GydF4y2Ba
- UPLC-QTOF-MS /女士:GydF4y2Ba
-
超级性能液相色谱四极其飞行时间质谱GydF4y2Ba
- VAZ /排名:GydF4y2Ba
-
总叶黄素到叶绿素GydF4y2Ba
参考文献GydF4y2Ba
- 1。GydF4y2Ba
黄志强,王志强,王志强,等。植物营养组织中花青素的光保护作用。新植醇。2002;155(3):349 - 61。GydF4y2Ba
- 2.GydF4y2Ba
植物色素的遗传与生物化学。植物学报2006;57:761-80。GydF4y2Ba
- 3.GydF4y2Ba
Gould K,Jay-allemand C,Logan Ba,Baissac Y,Bidel L.什么时候植物有用的叶状花青素?使用拟南芥的突变体重新评估光保护假设,该突变体在花青素积累中不同。Environ Exp Bot。2018; 154:11-22。GydF4y2Ba
- 4.GydF4y2Ba
Cooney LJ, Logan BA, Walsh MJ, Nnatubeugo NB, Reblin JS, Gould KS。“红、绿加拿大Sambucus canadensis花青素和热能耗散的光保护”再版。Environ Exp Bot. 2018; 154:4-10。GydF4y2Ba
- 5.GydF4y2Ba
李志刚,李志刚,李志刚。花青素在植物逆境响应中的环境意义。Photochem Photobiol。1999;70(1):1 - 9。GydF4y2Ba
- 6.GydF4y2Ba
奥伦 - 沙米尔M.不花青素降解在决定植物颜料浓度显著的作用?植物SCI。2009; 177(4):310-6。GydF4y2Ba
- 7.GydF4y2Ba
陈志强,王志强,王志强,等。葡萄成熟和幼龄叶片光合作用的光抑制。植物科学。2003;164(4):635 - 44。GydF4y2Ba
- 8.GydF4y2Ba
Malnoë A.光合作用的光抑制还是光保护?更新(新命名的)持续淬火部件qH。Environ Exp Bot. 2018; 154:123-33。GydF4y2Ba
- 9.GydF4y2Ba
黄酮类化合物的生物合成及其对应激的影响。植物学报。2002;5(3):218-23。GydF4y2Ba
- 10。GydF4y2Ba
幼叶花青素含量高与叶黄素循环组分库低和光抑制风险低相关。40 Photosynthetica。2002;(3):349 - 54。GydF4y2Ba
- 11.GydF4y2Ba
Hughes NM, Burkey KO, Cavender-Bares J, Smith WK。冬红(花青酸)和冬绿(氰酸)被子植物常绿植物的叶黄素循环色素和抗氧化特性。中国生物医学工程学报。2011;63(5):1895-905。GydF4y2Ba
- 12.GydF4y2Ba
Tattini M,Landi M,Brunetti C,Giordano C,Remorini D,Gould Ks,Guidi L.表皮Coumaroyl花青素保护甜罗勒免于过度的轻微应力:光衰减的多种后果。physiol platararum。2014; 152(3):585-98。GydF4y2Ba
- 13.GydF4y2Ba
罗勒叶对高太阳辐射的分子和生理响应机制研究:以红色和绿色罗勒叶为例。J Exp Bot. 2017;68(9): 2425-37。GydF4y2Ba
- 14.GydF4y2Ba
罗短笛E,蓝底男,佩莱格里尼E,Agati G,奴C,希奥尔达尼T,Lorenzini G,Malorgio楼马萨伊R,Nali族C,拉略G,Remorini d,Vernieri P,L. Guidi的通过epidermally定位诱导多后果花青素在李的年轻,成熟和衰老的叶子。前植物SCI。2018; 9:917。GydF4y2Ba
- 15.GydF4y2Ba
Sytar O,Zivcak男,Bruckova K,Brestic男,Hemmerich I,Rauh C,SIMKO I.移位类黄酮的积累和酚酸在莴苣归因于紫外线辐射和温度的变化。SCI Hortic。2018; 239:193-204。GydF4y2Ba
- 16.GydF4y2Ba
Hatier JHB, Gould KS。花青素在营养器官中的作用。有请:Davies K, Gould KS,编辑。花青素。纽约:施普林格;2008.p -。GydF4y2Ba
- 17.GydF4y2Ba
关闭DC, Beadle CL。叶面花青素的生理生态。机器人启2003;69(2):149 - 61。GydF4y2Ba
- 18.GydF4y2Ba
奥伦 - 沙米尔男,在石楠叶的生长和花青素的色素沉着尼辛 - 利维A.温度和赤霉素效果。j hortic sci biotechnol。1999; 74(3):355-60。GydF4y2Ba
- 19.GydF4y2Ba
Nissim-Levi A,Kagan S,Ovadia R,Oren-Shami M.温度,紫外线和镁对Cocoplum叶中的花青素色素沉着的影响。j hortic sci biotechnol。2003; 78(1):61-4。GydF4y2Ba
- 20。GydF4y2Ba
李DW,柯林斯TM。系统发育和个体发育对热带植物叶片中花青素和甜菜青素分布的影响。acta botanica sinica(云南植物学报),2012;GydF4y2Ba
- 21。GydF4y2Ba
李DW,洛瑞JB,石B.离轴花青素热带雨林植物的叶子层:在深色光捕获的增强剂。Biotropica。1979; 11(1):70-7。GydF4y2Ba
- 22。GydF4y2Ba
Klančnikk,levpuščekm,gaberščika. variegation和红色Zhaxial表皮定义了仙客来紫癜的叶光学性质。植物群GydF4y2Ba.GydF4y2Ba2016; 224:87-95。GydF4y2Ba
- 23.GydF4y2Ba
王Y,邵,王J,任h,刘H,张Q,郭Q,陈X.珍稀濒危植物两种表型表型的形态学和生理特性比较,海棠Fimbistipula Hance。Speckynthetica。2016; 54(3):381-9。GydF4y2Ba
- 24.GydF4y2Ba
Hughes NM, Vogelmann TC, Smith WK。背面花青素对林下植物吸收红光的光学效应:重温后向散射假说。中国生物医学工程学报。2008;59(12):3435-42。GydF4y2Ba
- 25.GydF4y2Ba
休斯NM,木匠KL,盖保德TS,米勒CN,沃特斯MN,史密斯WK。光合成本和背面与正面花青素芋“莫吉托的利益。足底GydF4y2Ba.GydF4y2Ba2014; 240(5):971-81。GydF4y2Ba
- 26.GydF4y2Ba
Manetas Y.为什么有些叶子是花青素和为什么大多数花青素的叶子是红色的?弗洛拉 - 形态,分布。植物的功能生态学。2006; 201(3):163-77。GydF4y2Ba
- 27.GydF4y2Ba
Fernández-Marín B, Esteban R, Míguez F, Artetxe U, Castañeda V, Pintó-Marijuan M, Becerril JM, García-Plazaola JI。温带落叶林多年生林下草本植物背面花青素的生理生态作用。AoB植物。2015;7。GydF4y2Ba
- 28.GydF4y2Ba
田中华,王志强,王志强,等。植物色素的生物合成及其应用。植物j . 2008; 54(4): 733 - 49。GydF4y2Ba
- 29.GydF4y2Ba
王志强,王志强,王志强,等。植物生殖器官中花青素合成调控的研究进展。植物科学。2011;181(3):219 - 29。GydF4y2Ba
- 30.GydF4y2Ba
passeri v,koes r,quattrocchio fm。高价值植物产品设计的新挑战:植物液泡中花青素的稳定化。前植物SCI。2016; 7:153。GydF4y2Ba
- 31.GydF4y2Ba
刘Y,Tikunov Y,思腾RE,Marcelis LF,维瑟RG,在茄果类蔬菜Bovy酒店A.花青素合成和降解机理研究。接待化学。2018; 6:52。GydF4y2Ba
- 32。GydF4y2Ba
多酚氧化酶在作物中的作用:生物化学、生理和遗传方面。中华医学杂志。2017;18(2):377。GydF4y2Ba
- 33。GydF4y2Ba
Kader F,Haluk JP,Nicolas JP,MetChe M.用蓝莓多酚氧化酶降解Cyanidin 3-葡糖苷:动力学研究和机制。j农业食品化学。1998年; 46(8):3060-5。GydF4y2Ba
- 34。GydF4y2Ba
庞旭,黄旭,杨旭,纪志,张志强。多酚氧化酶在荔枝果皮花色苷降解中的作用。中国农业科学。2008;41:540-5。GydF4y2Ba
- 35。GydF4y2Ba
方芳,张晓霞,罗华,周军,龚伟,史志,何青,吴青,李丽,姜玲,蔡智,Oren-Shamir M,张智,庞欣。一种胞内漆酶对表儿茶素介导的荔枝果皮花青素降解的影响。植物杂志。2015;169(4):2391 - 408。GydF4y2Ba
- 36.GydF4y2Ba
Zipor G,Duarte P,Carqueijeiro I,Shahar L,Ovadia R,Teper-Bamnolker P,Eshel D,Levin Y,Doron-Faigenboim A,Sottomayor M,Oren-Shamir M.在Planta花青素中的真空III类过氧化物酶降解Brunfelsia Calycina花。新植物。2015; 205(2):653-65。GydF4y2Ba
- 37.GydF4y2Ba
拉克曼Ĵ,Hamouz K.红色和紫色马铃薯作为人类营养的一份审查显著的抗氧化剂来源。植物土壤环境。2005; 51(11):477。GydF4y2Ba
- 38.GydF4y2Ba
花青素苷的稳定性和回收率对临床和实验样品分析的影响。食品化学。2009;57(12):5271-8。GydF4y2Ba
- 39.GydF4y2Ba
罗华,邓胜,付伟,张昕,张旭,彭欣。没食子儿茶素对蔷薇和毛蕊花花瓣中花青素活性降解的影响。中华医学杂志。2017;18(4):699。GydF4y2Ba
- 40。GydF4y2Ba
张志刚,庞旭,纪志,蒋勇。花色苷降解在荔枝果皮褐变中的作用。食品化学。2001;75(2):217 - 21所示。GydF4y2Ba
- 41。GydF4y2Ba
马扎G,Minitiati E.花青素的水果,蔬菜和谷物。博卡拉顿:CRC压力;1993年。GydF4y2Ba
- 42。GydF4y2Ba
Schmitzer v,Veberic R,Osterc G,Stackar F.在地下筹款的花卉开发期间颜色和酚醛含量发生变化。J AM SoC Hortic SCI。2010; 135(3):195-202。GydF4y2Ba
- 43。GydF4y2Ba
Kondo T,Ueda M,Isobe M,Goto T.一种新的蓝色发育与矢车菊的新型分子机制,来自矢车菊的超分子颜料,GydF4y2BaCentaurea Cyanus.GydF4y2Ba.Tetrahedron lett。1998年; 39(45):8307-10。GydF4y2Ba
- 44。GydF4y2Ba
马扎G,在水溶液中的花色苷的辅色的Brouillard R的机构。植物化学。1990; 29(4):1097-102。GydF4y2Ba
- 45。GydF4y2Ba
张永强,张志强,张志强。植物花青素生物合成的研究进展。植物学报。2014;19:81-90。GydF4y2Ba
- 46。GydF4y2Ba
Anjaneyulu ASR, Rao VL。从红树林植物agallocha Linn中提取五种二萜类化合物(agallochins A-E)。植物化学。2000;55(8):891 - 901。GydF4y2Ba
- 47.GydF4y2Ba
姜PM, Son PT ., Matsunami K ., Otsuka H.。Var. cochinchinensis。化学学报。2005;53(12):1600-3。GydF4y2Ba
- 48.GydF4y2Ba
园艺,草坪Huxely A.新的RHS字典。伦敦:麦克米伦。ISBN 0-333-47494-5;1992年。GydF4y2Ba
- 49.GydF4y2Ba
李志强,李志强,李志强,等。杂交月季植物化学成分分析。“Jardin de Granville”的HPTLC, HPLC-DAD和HPLC-ESI-HRMS:六个植物器官的多酚指纹图谱。植物化学。2014;99:127-34。GydF4y2Ba
- 50。GydF4y2Ba
Liberal J, Costa G, Carmo A, Vitorino R, Marques C, Domingues MR, Domingues P, Goncalves AC, Alves R, Sarmento-Ribeiro AB, Girão H, Cruz MT, Batista MT.一种富含鞣花丹宁的成分的化学特征和细胞毒性潜力GydF4y2Ba草莓属vescaGydF4y2Ba叶子。阿拉伯J化学。2015。GydF4y2Bahttp://dx.doi.org/10.1016/j.arabjc.2015.11.014GydF4y2Ba.GydF4y2Ba
- 51。GydF4y2Ba
石竹属植物营养器官的组织解剖学研究。37神物铺子Serbica。2013;(2):121 - 6。GydF4y2Ba
- 52.GydF4y2Ba
李DW,格雷厄姆R.叶雨林阳光和极端的阴生植物的光学性能。我是J机器人。1986; 73(8):1100-8。GydF4y2Ba
- 53.GydF4y2Ba
fosen T, Andersen ØM。从桔梗红叶中提取花青素3-(2″,3″-双烯丙基糖苷)。植物化学。1999;52(8):1697 - 700。GydF4y2Ba
- 54.GydF4y2Ba
Reiersen B,Kiremire Bt,Byamukama R,AndersenØm。花青素用来自Chenille植物的Gallic酸酰化,GydF4y2BaAcalypha Hispida.GydF4y2Ba.植物化学,2003;64(4):867 - 71。GydF4y2Ba
- 55.GydF4y2Ba
食用来源的酰化花青素及其在食品系统中的应用。生物化学学报2003;14(3):217-25。GydF4y2Ba
- 56.GydF4y2Ba
黄志强,王志强,王志强,等。黑胡萝卜提取物中花色苷含量的测定。并对其色性进行了评价。食品科学。2004;219(5):479-86。GydF4y2Ba
- 57。GydF4y2Ba
黄志强,王志强,王志强,等。酰基化和非酰基化花青素的热降解特性。食品科学。2006;71(8):C504-12。GydF4y2Ba
- 58。GydF4y2Ba
acta photonica sinica, 2010, 39 (5): 663 - 663 . acta photonica sinica, 2010, 39(5): 663 - 663。Chem-Eur j . 2012; 18(12): 3736 - 44。GydF4y2Ba
- 59。GydF4y2Ba
过氧化物酶在荔枝果皮花青素降解中的作用。食品化学。2005;90(1):47-52。GydF4y2Ba
- 60.GydF4y2Ba
Sarikaya SBO, Sisecioglu M, Cankaya M, Gulcin İ, Ozdemir H.一系列酚酸对牛乳过氧化物酶的抑制特性。J酶抑制剂医学化学。2015;30(3):479-83。GydF4y2Ba
- 61.GydF4y2Ba
王艳,张慧,梁红,袁强。石榴皮中石榴皮苷的分离纯化、抗氧化活性及蛋白质沉淀能力。食品化学。2013;138(1):437 - 43。GydF4y2Ba
- 62.GydF4y2Ba
石榴鞣花丹宁在体外抑制α-葡萄糖苷酶活性,降低淀粉消化率。中国食品科学。2015;66(1):85-92。GydF4y2Ba
- 63。GydF4y2Ba
Kato E, Uenishi Y, Inagaki Y, Kurokawa M, Kawabata J.玫瑰花蕾提取物粉末中二肽基肽酶iv抑制剂rugosin a, B及相关化合物的分离。生物化学学报。2016;80(11):2087-92。GydF4y2Ba
- 64。GydF4y2Ba
引用本文:Nguyen DH, Seo UM, Zhao BT, Le DD, Seong SH, Choi JS, Min BS, Woo MH.从仙鹤草中提取鞣花丹宁和黄酮。具有蛋白质酪氨酸磷酸酶和乙酰胆碱酯酶抑制活性。Bioorg化学。2017;72:293 - 300。GydF4y2Ba
- 65。GydF4y2Ba
花青素在食品中的稳定性。出自:Markakis P,编辑。作为食用色素的花青素。纽约:学术出版社;1982.p . 163 - 78。GydF4y2Ba
- 66。GydF4y2Ba
Gómez-Míguez M, González-Manzano S, Escribano-Bailón MT, Heredia FJ, Santos-Buelga C.不同酚类copigments对malvidin - glucside颜色的影响。农业食品化学学报。2006;54(15):5422-9。GydF4y2Ba
- 67。GydF4y2Ba
卡瓦尔康蒂RN,桑托斯DT,梅雷莱斯MAA。花青素在模型和食品系统中的非热稳定机制综述。食品科学进展。2011;44(2):499-509。GydF4y2Ba
- 68。GydF4y2Ba
陈志强,陈志强,陈志强,等。共色素和酚类成分对葡萄酒色泽的影响。食品科学技术。2016;53(6):2540-7。GydF4y2Ba
- 69。GydF4y2Ba
陈志强,王志强,陈志强,等。共色素作用对黑莓花青素稳定性的影响。LWT-Food science Technol. 2017; 75:72-7。GydF4y2Ba
- 70。GydF4y2Ba
没食子酸对维生素c强化蔓越莓汁中花青素降解和颜色损失的保护作用。食品化学。2016;210:422-7。GydF4y2Ba
- 71。GydF4y2Ba
钱伯忠,刘建华,赵淑娟,蔡建新,景平。没食子酸/阿魏酸/咖啡酸对颜色增强和花青素稳定性的影响。食品化学。2017;228:526-32。GydF4y2Ba
- 72。GydF4y2Ba
Tuominen A, Sinkkonen J, Karonen M, Salminen JP。从天竺葵花瓣中提取的sylvatin、acetylglucosylvcum水解单宁具有助色素作用。植物化学。2015;115:239-51。GydF4y2Ba
- 73。GydF4y2Ba
Peleg H,Bodine KK,贵族AC。酸对明矾和酚类化合物涩的影响。化学感官。1998年; 23(3):371-8。GydF4y2Ba
- 74。GydF4y2Ba
莫塔FL,凯马达AJ,皮尼奥SP,马塞EA。某些天然的酚类化合物的水溶解度。工业工程化学RES。2008; 47(15):5182-9。GydF4y2Ba
- 75。GydF4y2Ba
朱Q,隋S,雷X,杨Z,鲁K,刘G,刘YG的彩叶R2R3 MYB型原花青素调节基因SsMYB3改变花色的转基因烟草的李M.异位表达。Plos一个。2015; 10(10):e0139392。GydF4y2Ba
- 76。GydF4y2Ba
亚迪。分离叶绿体中的铜酶、多酚氧化酶GydF4y2Ba甜菜属GydF4y2Ba.植物理性。1949; 24(1):1。GydF4y2Ba
- 77.GydF4y2Ba
张志,庞旭,杨超,纪志,蒋勇。荔枝果皮花色苷的分离纯化及结构分析。食品化学。2004;84(4):601 - 4。GydF4y2Ba
- 78.GydF4y2Ba
从荔枝果皮水提物中分离得到B型和a/B型表儿茶素三聚体。中华医学杂志。2018;19(1):301。GydF4y2Ba
- 79.GydF4y2Ba
Retamales HA, Scharaschkin T.一种鉴定桃金娘科二级化合物的染色方法。应用植物学报,2014;2(10):1400063。GydF4y2Ba
- 80.GydF4y2Ba
rzeppa s,von Bargen C,Bittner K,Humpf Hu。反相高效液相色谱法耦合到电喷雾电离串联质谱(RP-HPLC-ESI-MS / MS)中食品样品中Flavan-3-OLS和原硝酸镁分析。j农业食品化学。2011; 59(19):10594-603。GydF4y2Ba
- 81.GydF4y2Ba
庞晓东,黄志强,黄志强,等。钙信号在葡萄芽休眠释放中的作用。中国生物医学工程学报。2007;58(12):3249-62。GydF4y2Ba
- 82.GydF4y2Ba
黑莓浓缩汁和葡萄酒中掺假成分的检测。acta肛周化学学报1982;65(6):1417-23。GydF4y2Ba
- 83.GydF4y2Ba
Chakraborty TK,Das N,Sengupta S,Mukherjee M.在孢子术期间在Pleurotus佛罗里达犬的吉尔卡群天然基质的积累。Curr Microbiol。2000; 41(3):167-71。GydF4y2Ba
- 84.GydF4y2Ba
关键词:花青素,花青素,活性降解,花青素足底。2005;222(1):19-26。GydF4y2Ba
- 85.GydF4y2Ba
在拟南芥中,花青素的转运途径与内质网-液泡蛋白分选途径重叠,并有助于液泡包涵体的形成。植物杂志。2007;145(4):1323 - 35。GydF4y2Ba
确认GydF4y2Ba
作者感谢杨崇先生(华南农业大学仪器分析研究中心)对UPLC-DAD-QTOF-MS/MS分析的帮助。GydF4y2Ba
资金GydF4y2Ba
这项工作是由中国(31171988和31772036),国家自然科学基金委员会和中国国家重点基础研究发展计划(2013CB127105)的支持。该融资机构提供了实验成本,研究生工资的支持和出版费用为这项工作。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
贡献GydF4y2Ba
HL、WL和XZ收集样本并进行大部分实验。HL处理了表格和无花果。SD, QX和TH有助于进行生理和化学实验。XP对UPLC-DAD-QTOF-MS/MS数据分析做出了贡献,并撰写了部分文章。ZZ和XZ构思项目,分析数据,撰写和修改文章。所有作者阅读并批准了手稿的最终版本。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
附加信息GydF4y2Ba
出版商的注意GydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。GydF4y2Ba
附加文件GydF4y2Ba
附加文件1:GydF4y2Ba
图S1GydF4y2Ba.在花色苷的HPLC图谱GydF4y2BaExcoecariaGydF4y2Ba通过UPLC-DAD-QTOF-MS / MS叶和识别。(A-C)花青素内容物GydF4y2BaExcoecariaGydF4y2Ba成熟过程中的叶子。花青素含量GydF4y2BaExcoecariaGydF4y2Ba第1至第3阶段的叶片(如图所示。GydF4y2Ba1GydF4y2BaA)采用高效液相色谱法(A510nm)分析。(D)经UPLC-DAD-QTOF-MS/MS鉴定的峰1 (P1)。(A-C)中的P1进一步鉴定为Cy-3-O葡萄糖苷。(E)经UPLC-DAD-QTOF-MS/MS鉴定的峰2 (P2)。(A-C)中的P2进一步鉴定为cyanidin 3-(2″-galloylglucoside)。(TIF 10184 kb)GydF4y2Ba
额外的文件2:GydF4y2Ba
图S2GydF4y2Ba.主要POD抑制剂的鉴定GydF4y2BaExcoecariaGydF4y2Ba叶子由UPLC-DAD-QTOF-MS / MS。(A-d)在由UPLC-DAD-QTOF-MS / MS的高抑制馏分的化合物的表征。The MS and MS/MS spectra of the major compounds with high absorbance at 280 nm indicate various hydrolysable tannins in the high inhibition fractions of F1 (A), F2 (B), F13(C) and F14 (D) as described in Fig.5GydF4y2BaA及B. (TIF 10206kb)GydF4y2Ba
额外的文件3:GydF4y2Ba
图S3GydF4y2Ba.HPLC使用内标方法的Gallic酸含量测定。(a,e)标准小酸的HPLC分析。(B,F)在第2阶段叶片酚提取物中的GALIC酸的HPLC分析GydF4y2BaExcoecariaGydF4y2Ba(B)和GydF4y2Ba桂花GydF4y2Ba(F). (C-D)高效液相色谱法分析叶酚提取物中的没食子酸GydF4y2BaExcoecariaGydF4y2Ba,提取液中添加2 μg/mL (C)和4 μg/mL (D)标准没食子酸。(G-H)高效液相色谱法分析叶片单宁提取物中没食子酸GydF4y2Ba桂花GydF4y2Ba,提取液中添加2 μg/mL (G)和4 μg/mL (H)标准没食子酸。(TIF 9908 kb)GydF4y2Ba
附加文件4:GydF4y2Ba
数据文件1GydF4y2Ba.MSMS复合报告GydF4y2BaExcoecariaGydF4y2Ba本研究中使用的酚类物质。(PDF 21926 kb)GydF4y2Ba
额外的文件5:GydF4y2Ba
数据文件2GydF4y2Ba.MSMS复合报告GydF4y2Ba桂花GydF4y2Ba本研究中使用的酚类物质。(PDF 6486 KB)GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文遵循知识共享署名4.0国际许可协议(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
罗慧,李伟,张旭东。GydF4y2Baet al。GydF4y2Ba在植物中高水平的水解单宁酸会抑制过氧化物酶介导的花青素退化和维护的背面红叶GydF4y2BaExcoecaria CochinchinensisGydF4y2Ba.GydF4y2BaBMC植物杂志GydF4y2Ba19,GydF4y2Ba315(2019)。https://doi.org/10.1186/s12870-019-1903-yGydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
接受GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-019-1903-yGydF4y2Ba
关键字GydF4y2Ba
- 戈兰甘蔗/埃利亚尼亚斯GydF4y2Ba
- 花青素的维护GydF4y2Ba
- 过氧化物酶GydF4y2Ba
- 背面红叶GydF4y2Ba
- Excoecaria cochinchinensisGydF4y2Ba