- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
ABC1K10a是一种非典型激酶,在植物耐盐胁迫中起作用gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba文章编号:gydF4y2Ba270gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
ABC1K(BC1复合激酶的活性)是一种进化原始的非典型激酶系列,广泛分布在原核生物和真核生物中。ABC1K蛋白激酶gydF4y2Ba拟南芥gydF4y2BaABC1K蛋白参与了对光氧化应激和镉诱导氧化应激的响应。gydF4y2Ba
结果gydF4y2Ba
在这里,我们报道了线粒体定位的ABC1K10a通过调节活性氧(ROS)在植物耐盐胁迫中发挥作用。我们的研究结果表明,ABC1K10a的表达是由盐胁迫诱导的,该基因的突变导致ROS的过度积累和对盐胁迫的超敏反应。外源施用活性氧清除剂GSH可显著抑制活性氧积累,挽救盐敏感表型gydF4y2Baabc1k10agydF4y2Ba.ROS overaccumulation在gydF4y2Baabc1k10agydF4y2Ba盐胁迫下的突变体可能是由于线粒体电子传递链的缺陷。此外,一些其他线粒体局限性的缺陷gydF4y2BaABC1KgydF4y2Ba基因也会导致盐过敏。gydF4y2Ba
结论gydF4y2Ba
总之,我们的结果表明,线粒体位于ABC1K10a调控线粒体活性氧的产生,并在拟南芥耐盐性的正调控因子。gydF4y2Ba
背景gydF4y2Ba
土壤含盐量高是一种世界性的环境条件,它会抑制作物的生长并降低产量[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba]。高浓度的钠(钠gydF4y2Ba+gydF4y2Ba)是盐渍土壤中的主要离子,导致渗透胁迫,钠gydF4y2Ba+gydF4y2Ba毒性和氧化应激,从而导致盐对植物的损害[gydF4y2Ba3.gydF4y2Ba]。盐过敏感(SOS)途径是植物减少胞质Na积累的核心机制gydF4y2Ba+gydF4y2Ba维持细胞KgydF4y2Ba+gydF4y2Ba/NagydF4y2Ba+gydF4y2Ba体内平衡(gydF4y2Ba4gydF4y2Ba]。在SOS途径中,盐胁迫引起钙结合蛋白SOS3和SOS3- like钙结合蛋白8 (SCaBP8)的活性,激活蛋白激酶SOS2,导致Na的磷酸化和激活gydF4y2Ba+gydF4y2Ba/小时gydF4y2Ba+gydF4y2Baaltiporter sos1,因此增强了nagydF4y2Ba+gydF4y2Ba流出从胞浆[gydF4y2Ba5gydF4y2Ba]。在盐胁迫下,SOS通路受多种蛋白质调控。在正常生长条件下,SOS2激酶活性受到蛋白激酶SOS2- like 5 (PKS5)、14-3-3蛋白和GIGANTEA (GI)的抑制,导致Na含量降低gydF4y2Ba+gydF4y2Ba/小时gydF4y2Ba+gydF4y2BaSOS1的altiporter活性[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba]。盐胁迫促进PKS5和14-3-3s之间的相互作用,其释放SOS2的抑制,导致SOS途径的激活来调节NAgydF4y2Ba+gydF4y2Ba体内平衡(gydF4y2Ba6gydF4y2Ba]。推定的钙可渗透的转运仪Atann4被SOS2-SCABP8复合物磷酸化并抑制,其微调钙信号并响应于盐胁迫调节SOS途径[gydF4y2Ba8gydF4y2Ba]。gydF4y2Ba
盐胁迫诱导活性氧(ROS)的过度积累,如过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)、单线态氧(gydF4y2Ba1gydF4y2BaOgydF4y2Ba2gydF4y2Ba)、羟基自由基(•OH)、超氧阴离子自由基(OgydF4y2Ba2gydF4y2Ba˙ˉ)[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba9gydF4y2Ba]。在盐胁迫下,ROS可由多个细胞部位产生,包括叶绿体、线粒体、过氧化物酶体和质膜NADPH氧化酶[gydF4y2Ba10gydF4y2Ba]。水稻基因的突变gydF4y2BaWSL12gydF4y2Ba编码叶绿体核苷二磷酸激酶2(NDPK2),导致增强的ROS积累和灵敏度对盐胁迫,表明叶绿体是由盐引起的应力破坏ROS的来源[gydF4y2Ba11gydF4y2Ba]。高盐度也损害线粒体电子不同呼吸链复合,并导致过度还原泛醌(UQ),和过量的电子之间的传输速率被传输到分子氧或硝酸盐,从而产生至OgydF4y2Ba2gydF4y2Ba˙ˉ或一氧化氮(NO) [gydF4y2Ba12gydF4y2Ba]。线粒体蛋白AtMT2b(一种2型金属硫蛋白)通过与电压依赖性阴离子通道3 (AtVDAC3)相互作用来调节ROS稳态和线粒体膜电位(MMP),参与植物盐胁迫反应[gydF4y2Ba13gydF4y2Ba]。gydF4y2Ba
需氧生物进化都非酶和酶抗氧化防御机制,以对抗氧化应激保护植物[gydF4y2Ba14gydF4y2Ba]。非酶促抗氧化剂包括维生素C,维生素E,生物碱,类胡萝卜素,三肽谷胱甘肽(GSH)和黄酮类,而抗氧化酶如超氧化物脱粉剂(SOD),过载酶,抗坏血酸过氧化物酶(APX)和谷胱甘肽过氧化物酶(GPX)可以有效地解毒细胞ogydF4y2Ba2gydF4y2Ba˙ˉ和h.gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba15gydF4y2Ba]。大量研究报道过表达sod (Cu/Zn-SOD、Mn-SOD或Fe-SOD)可增强转基因植物的耐盐性[gydF4y2Ba15gydF4y2Ba]。转基因水稻过度表达gydF4y2Ba大肠杆菌gydF4y2Ba猫的编码基因,gydF4y2Ba凯特gydF4y2Ba,显示对盐胁迫的耐受性增强[gydF4y2Ba16gydF4y2Ba]。此外,谷胱甘肽作为最重要的代谢物之一,具有减轻氧化应激的作用,细胞内谷胱甘肽的浓度直接影响植物的耐受性[gydF4y2Ba15gydF4y2Ba]。因此,在胁迫条件下维持细胞内ROS的稳态是植物应激反应的重要环节。gydF4y2Ba
bc1复合激酶(ABC1Ks)是非典型激酶,缺乏真核蛋白激酶的许多特征。ABC1Ks的创始成员是来自ABC1/COQ8(现称ScCOQ8)gydF4y2Ba酿酒酵母gydF4y2Ba,其功能是通过调节UQ合成来维持线粒体bc1复合体的活性[gydF4y2Ba17gydF4y2Ba]。作为ScCOQ8,UbiB的同系物gydF4y2Ba大肠杆菌gydF4y2Ba,aarf in.gydF4y2BaProvidencia Stuartii.gydF4y2Ba和cabc1 in.gydF4y2Ba智人gydF4y2Ba还在UQ生物合成中的功能[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba]。的gydF4y2Ba拟南芥gydF4y2BaABC1K家族共有17个成员,其中8个(AtABC1K1-8)属于光合作用特异分支,6个(AtABC1K11-15)属于线粒体分支,3个(AtABC1K9、AtABC1K10a和AtABC1K10b)属于祖先分支[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba]AtABC1K8(AtOSA1)是该家族中第一个定位于叶绿体的成员,参与减轻镉诱导的氧化应激[gydF4y2Ba22gydF4y2Ba]。ABC1K1及其同源物ABC1K3使VTE1磷酸化,VTE1是生育酚合成的主要限制因子,并参与植物对光氧化应激的响应[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba]。叶绿体ABC1Ks已被广泛研究,但线粒体ABC1Ks的作用尚不清楚。gydF4y2Ba
在这项研究中,我们证明了线粒体ABC1K10a在盐胁迫耐受中发挥重要作用。的gydF4y2BaABC1K10AgydF4y2Ba敲除突变体积累过多的HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和o.gydF4y2Ba2gydF4y2Ba˙ˉ,对盐胁迫过敏。抑制ROS的合成,减轻了盐胁迫的过敏性反应gydF4y2Baabc1k10agydF4y2Ba突变体。进一步分析表明,活性氧在gydF4y2Baabc1k10agydF4y2Ba在盐胁迫下,可能是由线粒体呼吸复合物的不规则产生的。其他线粒体ABC1K构件也通过调节ROS积累来涉及对盐胁迫的反应,表明ABC1K系列在盐应激反应中的重要作用。在一起,我们的结果结果揭示了线粒体的ABC1K10A在拟南芥中耐盐耐受性的积极作用。gydF4y2Ba
结果gydF4y2Ba
拟南芥gydF4y2Ba线粒体 -gydF4y2Baabc1kgydF4y2Ba突变体在盐和渗透胁迫下积累更高的ROSgydF4y2Ba
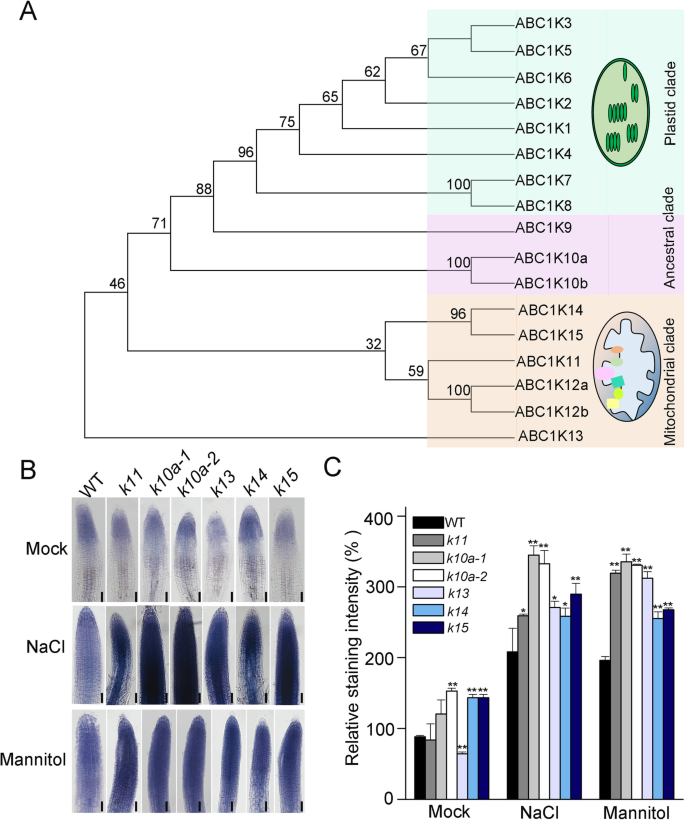
成员gydF4y2Ba拟南芥gydF4y2BaABC1K家族根据其进化起源和亚细胞定位可分为三个分支:叶绿体分支、线粒体分支和祖先分支(图1)。gydF4y2Ba1gydF4y2Baa).先前的研究表明,位于叶绿体中的ABC1K蛋白参与氧化应激反应[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba24gydF4y2Ba]。为了确定ABC1KS的祖先思工和线粒体疏水层,我们还涉及ROS代谢,我们在几个中检测到ROS水平gydF4y2Baabc1kgydF4y2BaNaCl或甘露醇处理下的突变体。活性氧水平gydF4y2Baabc1kgydF4y2Ba突变体在两种处理下均显著增加,表明这些蛋白在非生物胁迫条件下的ROS解毒中发挥作用。结果显示,在两个独立的细胞中,活性氧的积累量最高gydF4y2Baabc1k10agydF4y2Ba突变体(gydF4y2Bak10a-1gydF4y2Ba和gydF4y2Bak10a-2gydF4y2Ba),选择该基因进行进一步鉴定(图。gydF4y2Ba1gydF4y2Bab,c)。gydF4y2Ba
的gydF4y2Baabc1kgydF4y2Ba突变体在盐和渗透胁迫下比野生型积累更多的ROS。(gydF4y2Ba一个gydF4y2Ba)ABC1K蛋白的系统发育树gydF4y2Ba拟南芥gydF4y2Ba.通过比较编码的所有17个ABC1K蛋白的氨基酸序列来构建树木gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba基因组。三个不同的进化枝用不同的颜色突出显示(绿色表示质体进化枝;紫色表示祖先分支,浅粉色表示线粒体分支)根据之前的报道[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba]。(gydF4y2BabgydF4y2Ba野生型根的NBT染色,gydF4y2BaABC1K11gydF4y2Ba,gydF4y2Baabc1k10agydF4y2Ba,gydF4y2BaABC1K13gydF4y2Ba,gydF4y2BaABC1K14gydF4y2Ba和gydF4y2BaABC1K15gydF4y2Ba200 mM NaCl或300 mM甘露醇处理突变体根系。bar = 400 μm。gydF4y2BakgydF4y2Ba,gydF4y2Baabc1k。gydF4y2Ba(gydF4y2BacgydF4y2Ba) NBT染色强度定量。星号表示各处理与野生型差异有统计学意义。误差条指示±SD (gydF4y2BangydF4y2Ba= 15) (* *gydF4y2BaPgydF4y2Ba < 0.01, *PgydF4y2Ba < 0.05,tgydF4y2Ba-测试)gydF4y2Ba
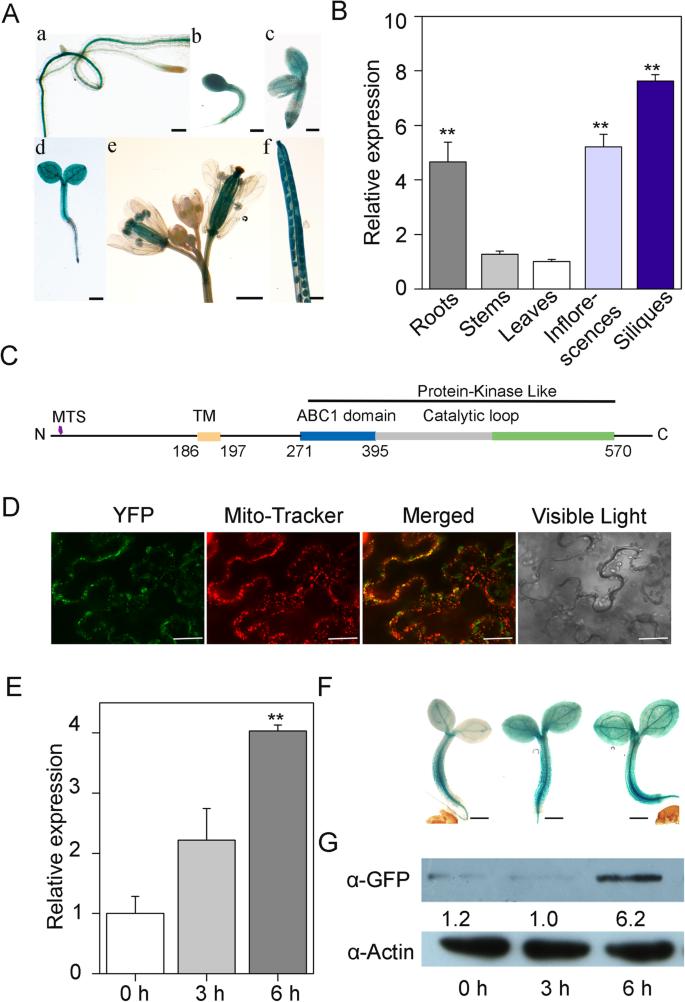
的表达模式gydF4y2BaABC1K10a (K10a)gydF4y2Ba基因gydF4y2Ba
表达模式gydF4y2BaABC1K10AgydF4y2Ba(命名)gydF4y2BaK10AgydF4y2Ba在此)首先分析使用gydF4y2BaproK10a :: GUSgydF4y2Ba转基因植物。GUS染色显示gydF4y2BaK10AgydF4y2Ba在各种组织中表达,具有相对较高的体积和子叶中的表达(图。gydF4y2Ba2gydF4y2Ba一个)。通过QRT-PCR分析进一步证实了这些结果,其显示了根,花和单片机中最强的表达水平(图。gydF4y2Ba2gydF4y2Bab)。生物信息学分析表明了N-末端的推定线粒体信号肽(图。gydF4y2Ba2gydF4y2Bac),提示K10a存在线粒体定位。为了验证这一点,我们将K10a-YFP融合蛋白表达于gydF4y2Ba尼古利亚娜·宾夕法尼亚州gydF4y2Ba叶片和K10A-YFP的荧光在线粒体中被专用于线粒体检测,与线粒体标志物型型术追踪器红色重叠(图。gydF4y2Ba2gydF4y2Bad).这一结果表明K10a确实是一种线粒体蛋白。gydF4y2Ba
分子表征gydF4y2BaABC1K10AgydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba)携带的转基因拟南芥线的GUS染色gydF4y2BaproK10a :: GUSgydF4y2Ba构造。B, e和f条= 2毫米。A, c和d,杆= 500 μm。(gydF4y2BabgydF4y2Ba)的表达gydF4y2BaABC1K10AgydF4y2BaqRT-PCR检测。gydF4y2BaActin2 / 8.gydF4y2Ba作为对照。星号表示叶片与其他组织之间有统计学显著差异(**)gydF4y2BaPgydF4y2Ba < 0.01,tgydF4y2Ba以及)。(gydF4y2BacgydF4y2Ba)ABC1K10A的示意性蛋白质结构。MTS,线粒体靶向序列;TM,跨膜结构域。(gydF4y2BadgydF4y2Ba)ABC1K10a(绿色荧光)和线粒体跟踪器(红色荧光)在小鼠体内的亚细胞定位gydF4y2Ba尼古利亚娜·宾夕法尼亚州gydF4y2Ba叶子。柱= 50 μm。(gydF4y2Bae, f一些gydF4y2Ba) NaCl处理诱导ABC1K10a表达。(E)相对转录水平gydF4y2BaABC1K10AgydF4y2Ba(qRT-PCR)通过比较处理和未处理的样品得到盐胁迫下的qRT-PCR结果。误差条指示±SD (gydF4y2BangydF4y2Ba= 3)。星号指示在不同处理时间处理和未处理的样品之间有统计学差异显著(**gydF4y2BaPgydF4y2Ba < 0.01,tgydF4y2Ba以及)。(gydF4y2BafgydF4y2Ba) GUS染色,5日龄转基因苗表达gydF4y2BaABC1K10apro:格斯gydF4y2Ba分别用200 mM NaCl处理0、3或6 h。条=200μm。(gydF4y2BaggydF4y2Ba)提取总蛋白质,表达5日龄的转基因幼苗gydF4y2BaABC1K10a pro:: ABC1K10a-GFPgydF4y2Ba用200%的抗生素治疗 0、3或6毫米NaCl h、 蛋白提取物用α-GFP抗体进行western印迹分析(gydF4y2BaggydF4y2Ba).肌动蛋白作为对照gydF4y2Ba
为了支持线粒体K10a蛋白在非生物胁迫中的作用,我们测定了盐胁迫处理下的表达模式。qRT-PCR和GUS染色结果显示gydF4y2BaK10AgydF4y2Ba通过NaCl治疗上调(图。gydF4y2Ba2gydF4y2Bae, f)。进一步分析了K10a-GFP融合蛋白的转基因株系gydF4y2BaK10AgydF4y2Ba本机启动子(gydF4y2BaproK10a: K10a-GFPgydF4y2Ba),证实NaCl处理诱导K10a蛋白水平显著升高(图。gydF4y2Ba2gydF4y2Bag;额外的文件gydF4y2Ba2gydF4y2Ba:S2)。这些结果表明gydF4y2BaK10AgydF4y2Ba是盐诱导基因,可在盐应激反应中发挥作用。gydF4y2Ba
的gydF4y2Baabc1k10agydF4y2Ba突变体对盐胁迫非常敏感gydF4y2Ba
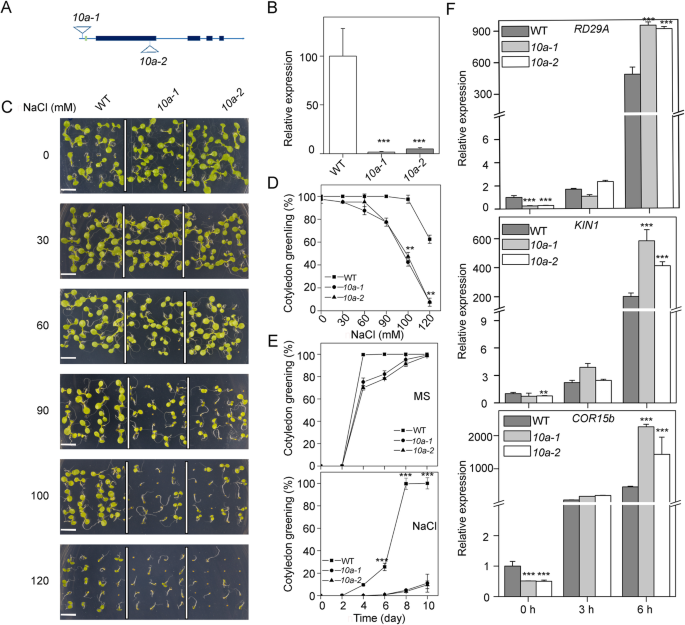
为了研究K10a在盐胁迫反应中的作用,我们对两个独立的T-DNA突变体(gydF4y2Ba10A-1gydF4y2Ba和gydF4y2Ba10A-2gydF4y2Ba)表示可忽略不计gydF4y2BaK10AgydF4y2Ba表达(图。gydF4y2Ba3.gydF4y2Baa,b)。在正常生长条件下,gydF4y2Ba10gydF4y2Ba突变体与野生型生长相似。而在NaCl处理下gydF4y2Ba10gydF4y2Ba突变体比野生型表现出更严重的生长抑制(图。gydF4y2Ba3.gydF4y2Bac、 d,e)。对子叶绿化的影响在植株上表现明显gydF4y2Ba10gydF4y2Ba与野生型相比,NaCl浓度较低的突变体(图。gydF4y2Ba3.gydF4y2Bad)。在含有100mM NaCl的MS培养基上生长10天后,所有野生型幼苗都有绿色子叶,而只有11%的人gydF4y2Ba10A-1gydF4y2Ba和10%的人gydF4y2Ba10A-2gydF4y2Ba突变体具有绿色子叶(图。gydF4y2Ba3.gydF4y2Bae)。盐响应标志物基因的表达分析gydF4y2Ba对干燥反应29AgydF4y2Ba(gydF4y2BaRD29AgydF4y2Ba) [gydF4y2Ba27gydF4y2Ba],gydF4y2Ba激酶1gydF4y2Ba(gydF4y2BaKIN1gydF4y2Ba) [gydF4y2Ba27gydF4y2Ba]及gydF4y2Ba冷调节15bgydF4y2Ba(gydF4y2BaCOR15bgydF4y2Ba) [gydF4y2Ba28gydF4y2Ba]的表达量显著高于gydF4y2Ba10gydF4y2Ba突变体比盐处理在6小时后野生型(图。gydF4y2Ba3.gydF4y2Baf)。总的来说,这些结果表明,K10a是在植物盐胁迫响应和耐受性非常重要。gydF4y2Ba
的gydF4y2Baabc1k10agydF4y2Ba突变体对盐胁迫表现出更高的敏感性。(gydF4y2Ba一个gydF4y2Ba的原理图gydF4y2BaABC1K10AgydF4y2Ba基因。填满的盒子代表外显子,盒子之间的线代表内含子。两个T-DNA插入也显示。(gydF4y2BabgydF4y2Ba)转录本丰度gydF4y2BaABC1K10AgydF4y2Ba在野生类型和gydF4y2Baabc1k10agydF4y2Ba突变体。5日龄野生型和野生型的总rnagydF4y2Ba10gydF4y2Ba突变体幼苗进行实时qRT-PCR。进行3次生物重复(平均值±SD,gydF4y2BangydF4y2Ba= 3)。gydF4y2Ba10gydF4y2Ba,gydF4y2Baabc1k10agydF4y2Ba.星号表示之间的统计差异gydF4y2Ba10gydF4y2Ba突变体和野生型(***gydF4y2BaP <0.001gydF4y2Ba,gydF4y2Bat -gydF4y2Ba测试)。(gydF4y2BacgydF4y2Ba)野生型和野生型的盐敏感性gydF4y2Ba10gydF4y2Ba突变体。野生型,gydF4y2Ba10A-1gydF4y2Ba和gydF4y2Ba10A-2gydF4y2Ba突变体种子在含不同浓度NaCl的MS培养基上萌发生长8 d。Bar = 500 μm。(gydF4y2BadgydF4y2Ba在不同NaCl浓度的MS培养基上生长10 d后,对幼苗的子叶绿色度进行评分,这是至少4个独立试验中100株幼苗的平均值。(意味着±SD;gydF4y2BangydF4y2Ba= 100)。星号表示统计上显着的差异(**gydF4y2BaP < 0.01gydF4y2Ba,gydF4y2BaT-Test.gydF4y2Ba)之间的gydF4y2Ba10gydF4y2Ba突变体和野生型。(gydF4y2BaegydF4y2Ba野生型和野生型子叶绿化率gydF4y2Ba10gydF4y2Ba突变体对NaCl处理的反应。野生型,gydF4y2Ba10A-1gydF4y2Ba和gydF4y2Ba10A-2gydF4y2Ba种子在MS培养基或MS培养基上播种,100mM NaCl。在指定的日期计算Cotyledon绿化率。误差条指示±SD (gydF4y2BangydF4y2Ba= 100)。星号表示有统计学意义的差异(***)gydF4y2BaPgydF4y2Ba < 0.001,t -gydF4y2Ba测试)gydF4y2Ba10gydF4y2Ba突变体和野生型。(F)转录水平gydF4y2BaRD29AgydF4y2Ba,gydF4y2BaKIN1gydF4y2Ba和gydF4y2BaCOR15bgydF4y2Ba在野生型,gydF4y2Ba10A-1gydF4y2Ba和gydF4y2Ba10A-2gydF4y2BaNaCl处理不同时间的突变体。在指定时间处理5日龄幼苗,不处理或添加200 mM NaCl,采用qRT-PCR分析转录水平。误差条指示±SD (gydF4y2BangydF4y2Ba= 3)。星号表示统计上显著的差异gydF4y2Ba10gydF4y2Ba突变体和野生型(**gydF4y2BaPgydF4y2Ba < 0.01, ***P < 0.001, t-gydF4y2Ba测试)gydF4y2Ba
拟南芥gydF4y2BaABC1K10a正调控盐胁迫耐受性gydF4y2Ba
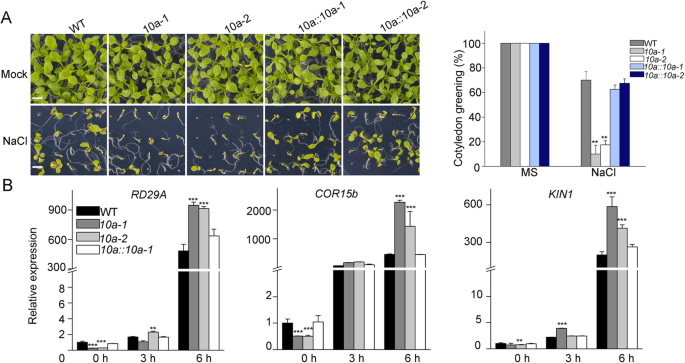
为进一步证实其盐敏感表型gydF4y2Ba10gydF4y2Ba突变体是由缺陷引起的gydF4y2BaK10AgydF4y2Ba通过引入野生型获得了两个独立的互补转基因系gydF4y2BaK10AgydF4y2Ba基因由本地人驱动gydF4y2BaK10AgydF4y2Ba发起人进入gydF4y2Ba10A-2gydF4y2Ba突变体。的表达gydF4y2BaK10AgydF4y2Ba在里面gydF4y2Ba10A-2gydF4y2Ba突变体完全恢复了盐过敏表型gydF4y2Ba10A-2gydF4y2Ba突变到野生型水平,进一步证明了这一点gydF4y2BaK10AgydF4y2Ba是否需要耐盐性gydF4y2Ba拟南芥gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Baa).的表达水平始终如一gydF4y2BaRD29AgydF4y2Ba,gydF4y2BaKIN1gydF4y2Ba和gydF4y2BaCOR15bgydF4y2Ba在有或无盐胁迫条件下,补种的植株也恢复到野生型水平(图2)。gydF4y2Ba4gydF4y2Bab) .此外,我们还培育了过表达的转基因株系gydF4y2BaK10a-MycgydF4y2Ba在控制下gydF4y2Ba35个年代gydF4y2Ba启动子(gydF4y2BaK10a-OEgydF4y2Ba),gydF4y2BaK10a-OEgydF4y2Ba与野生类型相比,线显示增强的耐盐性(附加文件gydF4y2Ba1gydF4y2Ba: S1)。综上所述,我们的研究结果表明,K10a正调控植物的耐盐性。gydF4y2Ba
互补的gydF4y2Ba10gydF4y2Ba突变体恢复盐敏感性对野生型水平。(gydF4y2Ba一个gydF4y2Ba)在不存在或存在100%浓度的条件下生长的拟南芥幼苗 12毫米氯化钠 天。互补系gydF4y2Ba10:: 10 a - 1gydF4y2Ba和gydF4y2Ba10:: 10 a -gydF4y2Ba是通过引入agydF4y2BaProABC1K10a: ABC1K10a-GFPgydF4y2Ba构造成gydF4y2Ba10gydF4y2Ba突变背景(Bar = 500 μm)。星号表示与野生型在相同处理下差异有统计学意义(**)gydF4y2BaPgydF4y2Ba < 0.01,tgydF4y2Ba以及)。(gydF4y2BabgydF4y2Ba的相对表达水平gydF4y2BaRD29AgydF4y2Ba,gydF4y2BaKIN1gydF4y2Ba和gydF4y2BaCOR15bgydF4y2Ba在野生型,gydF4y2Ba10A-1gydF4y2Ba,gydF4y2Ba10A-2gydF4y2Ba和gydF4y2Ba10A :: 10A-2-GFPgydF4y2BaQRT-PCR分析的幼苗。星号表示与WT有统计学意义差异(**gydF4y2BaPgydF4y2Ba< 0.01, t检验)gydF4y2Ba
ROS过度令人意陷导致盐超敏反应gydF4y2Ba10gydF4y2Ba突变体gydF4y2Ba
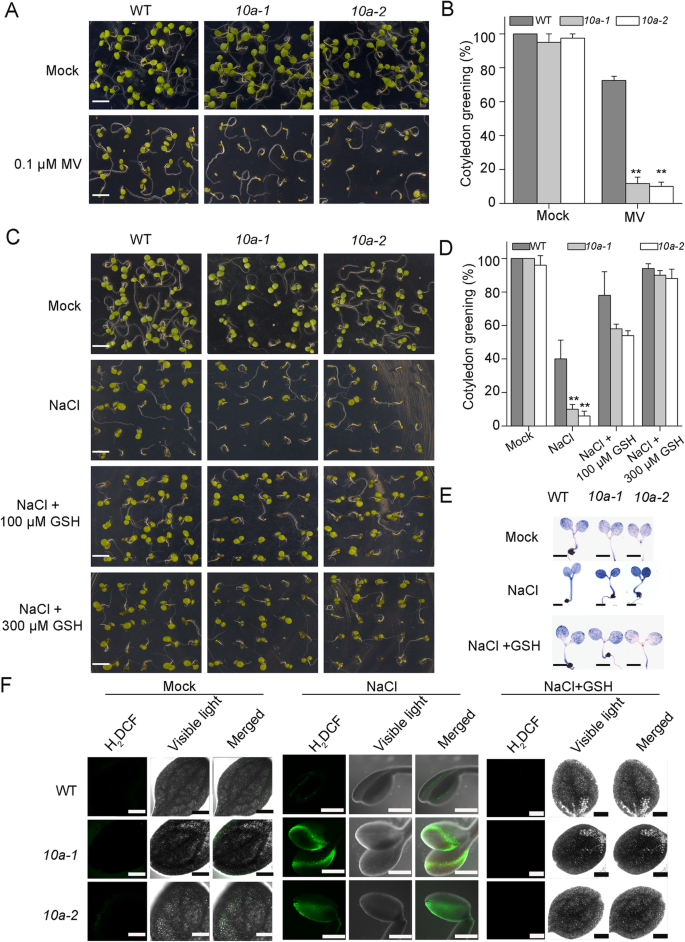
我们的结果表明,NaCl处理增加了活性氧的积累gydF4y2Ba10gydF4y2Ba因此,我们想知道是否ROS的增加是观察到的盐敏感表型的主要原因(图。gydF4y2Ba1gydF4y2Bab, c).甲基紫精(MV)诱导植物叶绿体和线粒体产生ROS [gydF4y2Ba29gydF4y2Ba].当植物生长在添加0.1的MS培养基中时 产生μM ROS的化学物质甲基紫精MVgydF4y2Ba10gydF4y2Ba突变体对MV表现出超敏反应,与盐胁迫下观察到的表型相似(图。gydF4y2Ba3.gydF4y2Bac;无花果。gydF4y2Ba5gydF4y2Baa).在MV存在的情况下gydF4y2Ba10gydF4y2Ba突变体只有11%的子叶是绿色的,而野生型有70%的子叶是绿色的。gydF4y2Ba5gydF4y2Bab).这些结果表明,盐敏感表型gydF4y2Ba10gydF4y2Ba突变可导致ROS从过度积累。gydF4y2Ba
清除活性氧可逆转植物对盐胁迫的超敏反应gydF4y2Ba10gydF4y2Ba突变体。(gydF4y2Ba一个gydF4y2Ba)野生型和野生型的表型gydF4y2Ba10gydF4y2Ba对MV处理反应的突变体。将种子播种在添加或不添加0.1 μM MV的MS培养基上,10 d后拍照(gydF4y2Ba一个gydF4y2Ba) (Bar = 500 μm)。计算子叶绿化率为(gydF4y2BabgydF4y2Ba)(平均值±SD,gydF4y2BangydF4y2Ba= 100)。星号表示与相应的野生类型有统计学意义(**gydF4y2BaPgydF4y2Ba < 0.01,tgydF4y2Ba以及)。(gydF4y2BacgydF4y2Ba的盐胁迫症状)缓解作用GSH处理在gydF4y2Ba10gydF4y2Ba突变体。生长在十天指定媒体幼苗进行拍照,并计算出子叶绿化率(gydF4y2BadgydF4y2Ba).(栏=500μm。平均值±SD,gydF4y2BangydF4y2Ba= 100)。星号表示与相应的野生类型有统计学意义(**gydF4y2BaP < 0.01gydF4y2Ba,gydF4y2BaT-Test.gydF4y2Ba).(gydF4y2BaegydF4y2Ba和gydF4y2BafgydF4y2Ba) NBT染色(gydF4y2BaegydF4y2Ba)和HgydF4y2Ba2gydF4y2BaDCF-DA染色(gydF4y2BafgydF4y2Ba)野生类型的子叶和gydF4y2Ba10gydF4y2BaNaCl处理或添加100 μM谷胱甘肽后突变体。条= 2毫米(gydF4y2BaegydF4y2Ba),棒=300μm(gydF4y2BafgydF4y2Ba)gydF4y2Ba
我们使用活性氧清除剂GSH来确定活性氧在盐胁迫反应中的作用gydF4y2Ba10gydF4y2Ba突变体。在含有100 mM NaCl的MS培养基中萌发6天后,40%的野生型幼苗的子叶呈绿色,而只有10%的野生型幼苗的子叶呈绿色gydF4y2Ba10A-1gydF4y2Ba6%gydF4y2Ba10A-2gydF4y2Ba突变体的子叶呈绿色(图。gydF4y2Ba5gydF4y2BaC,D)。然而,向中和300μmgsh中和盐与wt的作用,gydF4y2Ba10A-1gydF4y2Ba和gydF4y2Ba10A-2gydF4y2Ba幼苗子叶绿化率分别达到94、90和88%,说明NaCl处理抑制生长是由于活性氧积累和盐敏感引起的gydF4y2Ba10gydF4y2Ba突变体是由于ROS的过度积累(图。gydF4y2Ba5gydF4y2Bac, d).用NBT和2’7’-二氯荧光素二醋酸酯(HgydF4y2Ba2gydF4y2BaDCF-DA)染色,提示OgydF4y2Ba2gydF4y2Ba˙ˉ和h.gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba, 分别 [gydF4y2Ba30.gydF4y2Ba]。在正常生长条件下,野生型与野生型之间无明显差异gydF4y2Ba10gydF4y2Ba突变体。然而,NaCl处理产生了明显更强的染色gydF4y2Ba10gydF4y2Ba突变体与野生型相比,而GSH在所有基因型中减少过量的ROS积累(图。gydF4y2Ba5gydF4y2Bae,f)。这些结果进一步支持盐胁迫下的ROS过度诊断占盐超敏反应gydF4y2Ba10gydF4y2Ba突变体。gydF4y2Ba
的gydF4y2Ba10gydF4y2Ba突变导致盐胁迫下线粒体功能障碍gydF4y2Ba
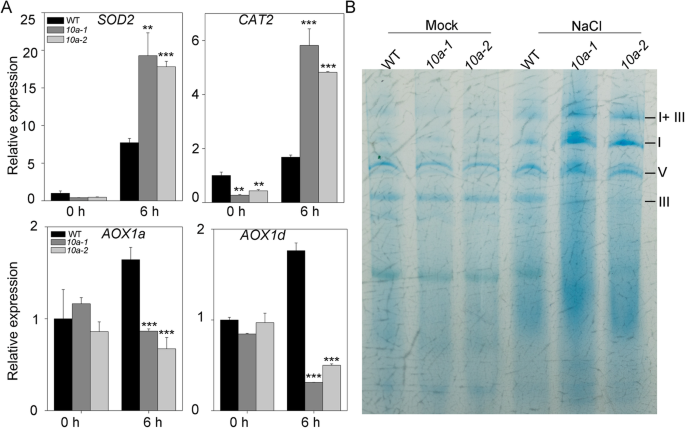
线粒体是ROS产生的重要来源,特别是在各种非生物胁迫下,抑制ETC活性,干扰电子转移,促进ROS产生[gydF4y2Ba10gydF4y2Ba]。在盐胁迫下,经典的细胞色素c氧化酶(COX)途径受到抑制,而替代氧化酶(AOX)途径在将电子从泛素转移到氧和限制ROS生成方面发挥着重要作用[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba]。研究盐胁迫是否能诱导高水平的活性氧gydF4y2Ba10gydF4y2Ba线粒体功能障碍引起的突变体,分析其表达gydF4y2BaAOXgydF4y2Ba基因和两种抗氧化基因。在NaCl处理下,gydF4y2BaSOD2gydF4y2Ba和gydF4y2BaCAT2gydF4y2Ba在gydF4y2Ba10gydF4y2Ba突变体相对于野生型,这表明gydF4y2Ba10gydF4y2Ba突变体比野生型遭受更严重的氧化应激(图。gydF4y2Ba6gydF4y2Ba然而,较低的表达gydF4y2BaAOXgydF4y2Ba基因在gydF4y2Ba10gydF4y2Ba与野生型相比,突变体意味着AOX途径受到严重抑制,导致ROS过度产生(图。gydF4y2Ba6gydF4y2Ba一个)。gydF4y2Ba
线粒体功能障碍gydF4y2Baabc1k10agydF4y2Ba盐胁迫下的突变体。(gydF4y2Ba一个gydF4y2Ba)氧化应激相关基因的表达。的表达gydF4y2BaSOD2gydF4y2Ba,gydF4y2BaCAT2gydF4y2Ba,gydF4y2BaAox1a.gydF4y2Ba和gydF4y2BaAox1d.gydF4y2Ba用qRT-PCR检测200 mM NaCl处理植株的生长情况。误差条指示±SD (gydF4y2BangydF4y2Ba= 3)。星号表示与相应的野生类型有统计学意义(**gydF4y2BaPgydF4y2Ba < 0.01 and ***PgydF4y2Ba < 0.001,tgydF4y2Ba以及)。(gydF4y2BabgydF4y2Ba)在野生类型和野生类型中的线粒体复合物的丰富gydF4y2Ba10gydF4y2Ba突变体。从MS培养基或MS添加100mm NaCl培养基上生长的5日龄幼苗中提取粗线粒体膜。用Blue Native-PAGE分离线粒体复合物,考马斯亮蓝染色gydF4y2Ba
我们进行了Blue Native(BN)-PAGE分析,以确定线粒体呼吸链中复合物的组装。在野生型和野生型之间检测到类似水平的线粒体复合物gydF4y2Ba10gydF4y2Ba突变体在正常生长条件下。然而,复合物III水平在正常生长条件下受到更严重的抑制gydF4y2Ba10gydF4y2Ba在NaCl处理下突变体与WT的比较(图。gydF4y2Ba6gydF4y2Bab;额外的文件gydF4y2Ba3.gydF4y2Ba: S3)。因为线粒体复合物I和III是产生ROS的关键位点[gydF4y2Ba12gydF4y2Ba],盐压力下的复杂III组件的异常可能会占ROS的过度累计gydF4y2Ba10gydF4y2Ba突变体。这些结果还表明K10a可能在维持植物中盐胁迫下的复合III的完整性和稳定性作用。gydF4y2Ba
其他缺陷gydF4y2BaABC1KgydF4y2Ba基因也导致盐超敏反应gydF4y2Ba
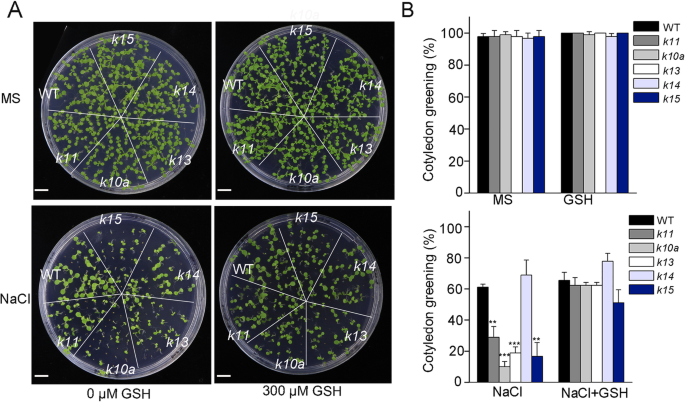
我们还研究了其他线粒体定位ABC1Ks在盐胁迫耐受性中的可能作用。两者之间没有区别gydF4y2BaK11,K13,K14gydF4y2Ba和gydF4y2BaK15gydF4y2Ba突变体和野生型在MS培养基上的生长表型不同gydF4y2BaK11gydF4y2Ba,gydF4y2BaK13gydF4y2Ba和gydF4y2BaK15gydF4y2Ba在100 mM NaCl处理下突变体发生了严重的突变(图2)。gydF4y2Ba7gydF4y2Baa、b;额外的文件gydF4y2Ba4gydF4y2Ba: S4)。因为这些突变体在盐胁迫下积累了更高水平的ROS(图。gydF4y2Ba1gydF4y2BaB,C),我们确定了ROS清除剂GSH的添加是否可以恢复盐胁迫的影响。与我们以前的结果一致gydF4y2Ba10gydF4y2Ba突变体,这些突变体的盐过敏性表型通过加入GSH(图的恢复。gydF4y2Ba7gydF4y2Baa, b). NaCl处理下,黄花苜蓿子叶绿色百分率gydF4y2BaK11gydF4y2Ba,gydF4y2BaK10AgydF4y2Ba,gydF4y2BaK13gydF4y2Ba和gydF4y2BaK15gydF4y2Ba分别为野生型的47、16、30和27%,而外源施GSH时,这一比例分别为95、95、95和78%(图1)。gydF4y2Ba7gydF4y2Ba这些结果表明gydF4y2Ba拟南芥gydF4y2Ba线粒体局部的ABC1K蛋白通过维持ROS稳定性在植物盐耐受中发挥着突出的作用。gydF4y2Ba
线粒体ABC1K蛋白参与盐胁迫反应gydF4y2Baabc1kgydF4y2Ba突变体对NaCl处理的响应和GSH对表型的恢复。种子的种子gydF4y2Baabc1kgydF4y2Ba在MS培养基上种植突变体,毫无或用200mM NaCl 10天。将子叶绿化表型的回收是用100μmgsh的测试(gydF4y2Ba一个gydF4y2Ba).条= 5毫米。子叶变绿率(gydF4y2BabgydF4y2Ba).误差条表示平均值±标准偏差(gydF4y2BangydF4y2Ba= 100)。星号表示与对应野生型(**)差异显著gydF4y2BaPgydF4y2Ba < 0.01, ***PgydF4y2Ba < 0.001,tgydF4y2Ba-测试)gydF4y2Ba
讨论gydF4y2Ba
作为非典型蛋白激酶,据报道酵母祖构件ABC1K到需要为辅酶Q的生物合成,因此线粒体氧化代谢[gydF4y2Ba33gydF4y2Ba]。在高等植物中gydF4y2Baabc1kgydF4y2Ba突变体对强光Cd引起的氧化应激高度敏感gydF4y2Ba2+gydF4y2Ba或H.gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba]。在这项研究中,我们发现线粒体ABC1K成员的T-DNA插入突变体对盐胁迫非常敏感(图。gydF4y2Ba1gydF4y2Bab;无花果。gydF4y2Ba7gydF4y2Ba).两种缺斑突变体的详细表型表征gydF4y2Ba10gydF4y2Ba,发现在盐胁迫下,去黄化过程明显受阻,生长受到抑制(图。gydF4y2Ba3.gydF4y2BaC,D。e)。与戏剧性响应表型一致,盐诱导性标记基因的表达也显着升高gydF4y2Ba10gydF4y2Ba突变体的数量比野生型的多(图。gydF4y2Ba3.gydF4y2BaF),表明突变体对盐胁迫的敏感反应。与成熟植株相比,去黄化期幼苗对干旱、盐度、光和温度等各种非生物胁迫更为敏感[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba]。的gydF4y2Ba10gydF4y2Ba突变体表现出强烈的子叶绿色缺陷,这可能与其在西力克和子叶中相对较高的表达有关(图。gydF4y2Ba2gydF4y2Baa、b;无花果。gydF4y2Ba3.gydF4y2Bac).这也说明ABC1K10a可能在盐胁迫下的幼苗早期发育中起着重要作用。我们的功能丧失和功能获得分析表明,ABC1K10a是盐耐受性的正调节因子gydF4y2Ba拟南芥gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Bac;额外的文件gydF4y2Ba1gydF4y2Ba: S1)。gydF4y2Ba
非生物胁迫常常导致细胞ROS的积聚,从而引起氧化应激作为二次压力。尽管ROS已被确认为信号传导分子,由应激条件引起的过量的ROS损伤细胞成分如DNA,RNA和蛋白质[gydF4y2Ba36gydF4y2Ba]。线粒体是ROS的主要来源,在调节重要的细胞代谢过程中发挥重要作用[gydF4y2Ba37gydF4y2Ba]。我们的研究结果表明,在盐胁迫条件下,线粒体ABC1K10a在线粒体功能中发挥着重要作用(图)。gydF4y2Ba6gydF4y2Baa, b),该基因的缺陷导致ROS的过度积累(图。gydF4y2Ba5gydF4y2Bae,f),可能来自线粒体。盐过敏表型gydF4y2Ba10gydF4y2Ba突变体可以被谷胱甘肽拯救(图。gydF4y2Ba5gydF4y2BaC,d),非酶促抗氧化剂抵消ROS积累[gydF4y2Ba15gydF4y2Ba,表明其盐敏感gydF4y2Ba10gydF4y2Ba突变是由线粒体源ROS过度积累引起的,导致氧化应激损伤。据报道,ROS还能调节各种转录调控,例如,何时gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba幼苗暴露于HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba,459个基因表达增强超过2倍[gydF4y2Ba38gydF4y2Ba]。以前的研究表明,ROS清除剂过氧化氢酶的缺乏引起的冗余ROS积累和多样化的基因诱导表达[gydF4y2Ba39gydF4y2Ba]。类似的证据在gydF4y2Baabc1k10agydF4y2Ba突变体中,ROS积累增多,基因表达增强gydF4y2BaRD29AgydF4y2Ba,gydF4y2BaKIN1gydF4y2Ba和gydF4y2BaCOR15bgydF4y2Ba,可以通过内源性ROS积聚触发(图。gydF4y2Ba3.gydF4y2Baf)。gydF4y2Ba
植物细胞呼吸包括COX途径和AP途径。当在应力条件下抑制Cox途径时,AOX在预防UQ过度减少,减轻ROS生产以及维持细胞呼吸状态的作用gydF4y2Ba39gydF4y2Ba]。在gydF4y2Ba10gydF4y2Ba突变体,表达gydF4y2BaAOXgydF4y2Ba盐胁迫下,基因减少,表明AP途径也受到抑制,导致线粒体中ROS产生增强和突变体中的氧化损伤。线粒体对维持细胞氧化还原平衡非常重要,线粒体复合物III已被证明是ROS产生的主要位点[gydF4y2Ba9gydF4y2Ba]。的gydF4y2Ba10gydF4y2Ba突变体显示出明显的线粒体复合体III,表明这一点gydF4y2BaK10AgydF4y2Ba可以调节线粒体复合物III的积累,以响应盐度应力响应于盐度应力的微调ROS水平(图。gydF4y2Ba6gydF4y2Bab)。gydF4y2Ba
ABC1K蛋白质共有保守基序包括催化环,NTP结合口袋,和MggydF4y2Ba2+gydF4y2Ba螯合位点,表明这些蛋白质在植物中的类似功能[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba40gydF4y2Ba]。我们的研究表明,除了gydF4y2Ba10gydF4y2Ba突变体,其他几个gydF4y2Baabc1kgydF4y2Ba突变体也显示出盐过敏表型和盐胁迫下ROS(图过度积累。gydF4y2Ba1gydF4y2Bab;无花果。gydF4y2Ba7gydF4y2Ba),揭示ABC1K家族蛋白在植物反应对盐度应力的保守作用。同时,塑体疏水层构件ABC1K1,ABC1K3和ABC1K8还显示出在氧化应激反应中起重要作用[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba]。因此,ABC1K家族蛋白可能是进化上保守的蛋白在调节细胞ROS产生响应植物非生物胁迫的作用。gydF4y2Ba
结论gydF4y2Ba
在这里,我们通过调节ROS积累发现,在植物盐胁迫耐受性线粒体本地化ABC1K10a功能。我们的数据表明gydF4y2BaABC1K10AgydF4y2Ba表达是通过盐处理诱导的,并且该基因的突变导致对盐胁迫和严重氧化应激的显着敏感。进一步的研究表明,线粒体电子传输链的缺陷负责ROS造成的ROSgydF4y2Ba10gydF4y2Ba突变体。线粒体中的其他ABC1K蛋白也调节ROS的产生和盐胁迫耐受性。gydF4y2Ba
方法gydF4y2Ba
质粒构建gydF4y2Ba
编码序列gydF4y2BaK10AgydF4y2Ba是插入gydF4y2BaPCAMBIA1302gydF4y2Ba在C末端创建YFP标记的10a蛋白gydF4y2BaK10AgydF4y2Ba编码序列也克隆到gydF4y2BapDONR™221gydF4y2Ba使用Gateway BP Clonase™II酶Mix (Invitrogen公司)。并通过LR反应(Invitrogen公司)将CDS序列克隆到二元载体中gydF4y2BapYL436gydF4y2Ba在其C末端产生10A蛋白质,其C末端有九个MYC标签[gydF4y2Ba41gydF4y2Ba]。gydF4y2Ba
基因组序列包括上游1500bpgydF4y2BaK10AgydF4y2Ba转录起始密码子和整个编码序列gydF4y2BaK10AgydF4y2Ba不含终止密码子扩增并克隆到gydF4y2BapCAMBIA1300gydF4y2Ba生成gydF4y2BaproABC1K10a: ABC1KgydF4y2Ba1gydF4y2Ba0 a-gfpgydF4y2Ba向量。载体中的启动子gydF4y2Baproabc1k10a :: abc1k10a-gfpgydF4y2Ba和在gydF4y2BaproABC1K10a:格斯gydF4y2Ba.用于载体构建引物已经在其他文件中列出了gydF4y2Ba5gydF4y2BaS1:表。gydF4y2Ba
植物材料和生长条件gydF4y2Ba
本研究中的野生类型是指的gydF4y2Ba拟南芥蒂利亚纳gydF4y2BaColumbia-0 var。的gydF4y2Baabc1k10a-1gydF4y2Ba(Salk_091799),gydF4y2Baabc1k10a-2gydF4y2Ba(SALK_067438),gydF4y2BaABC1K11gydF4y2Ba(SALK_009686C),gydF4y2BaABC1K13gydF4y2Ba(SALK_065389),gydF4y2BaABC1K14gydF4y2Ba(Salk_080026)和gydF4y2BaABC1K15gydF4y2Ba(Salk_056597)突变体从诺丁汉拟南芥股票中心(NASC,gydF4y2Bahttp://arabidopsis.infogydF4y2Ba).T-DNA插入的位置分别位于AT1G11390基因的启动子和第二外显子。利用左/右基因组引物(LP和RP)和LBa1鉴定纯合子gydF4y2BapBIN-pROK2gydF4y2Ba.gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba结果表明:100 μM光子mgydF4y2Ba−2gydF4y2Ba s−1gydF4y2Ba, 23°C/21°C(昼/夜),16-h-亮/8-h-暗循环,55%相对空气湿度。gydF4y2Ba尼古利亚娜·宾夕法尼亚州gydF4y2Ba在16-h光照/8-h黑暗周期下,在30°C下生长。用于纯合子鉴定的引物已在附加文件中列出gydF4y2Ba5gydF4y2BaS1:表。gydF4y2Ba
转基因植株是通过使用gydF4y2Ba根癌农杆菌gydF4y2Ba- 介导的花卉DIP方法[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].结构gydF4y2Ba35s :: abc1k10a-yfp / mycgydF4y2Ba和gydF4y2Baproabc1k10a :: abc1k10a-yfpgydF4y2Ba被引入野生型和gydF4y2Ba10gydF4y2Ba突变体,分别为K10A过表达和突变互补产生转基因系。在具有适当抗生素的1/2 ms培养基上筛选转基因种子,T3植物用于相关实验。gydF4y2Ba
非生物胁迫处理gydF4y2Ba
对于子叶绿化测定,从与相同的批料中收获的种子以10%(v / v)次氯酸钠灭菌10分钟,用无菌去离子水冲洗五次,然后在1/2 ms培养基上生长不同浓度的培养基NaCl或GSH。将种子保持在4℃下2天,然后在拍摄之前8-10天的长期光周期(16-H光/ 8-H-暗)照射在23℃下在23℃下孵育和分析的统计[gydF4y2Ba44gydF4y2Ba]。gydF4y2Ba
对于盐应激处理分析,在正常培养基上生长的5天幼苗浸入1/2ms液体培养基中,或者没有200mM NaCl的指示时间[gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba]。采集后,在液氮中冷冻,在−80°C下保存备用。gydF4y2Ba
GUS染色试验gydF4y2Ba
启动子GUS的组织化学分析如所述进行[gydF4y2Ba30.gydF4y2Ba]。5日龄转基因苗gydF4y2BaproABC1K10a:格斯gydF4y2Ba培养于1/2 MS培养基上,在含200 mM NaCl的1/2 MS液体培养基中浸泡3或6 h,用于GUS染色。采集成熟植株不同器官进行GUS染色。样品浸在冷90%丙酮为20分钟,用冲洗液洗净(50 mM磷酸盐缓冲剂,pH值7.2,0.5毫米K-ferrocyanide, 0.5毫米K-ferricyanide),然后在事前准备染色染色方案(包含2毫米X-Gluc冲洗液)在黑暗中一致的孵化时间了。去除染色液后,用15、35、50、70%乙醇分别洗涤15 min,然后用100%乙醇洗涤10 min,去除叶绿素。用Olympus MVX10立体显微镜对幼苗和器官进行了拍照。gydF4y2Ba
共聚焦显微镜gydF4y2Ba
为了确定K10a的亚细胞定位gydF4y2Bapro35S:gydF4y2Ba:gydF4y2BaABC1K10A-YFP.gydF4y2Ba变成了gydF4y2Ba农杆菌GV3101gydF4y2Ba[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba]。培养12 ~ 16 h后gydF4y2Ba杆菌gydF4y2Ba收集细胞,用OD600≈1.0重悬于转化缓冲液中,注入gydF4y2Ba尼古利亚娜·宾夕法尼亚州gydF4y2Ba年轻的叶子。共培养48 h后,用Mito-Tracker橙作为线粒体荧光标记物进行染色。采用卡尔蔡司LSM710 META激光扫描显微镜观察荧光信号。gydF4y2Ba
定量RT-PCRgydF4y2Ba
对于qRT-PCR, 5 d龄野生型和gydF4y2Ba10gydF4y2Ba突变体幼苗用含200 mM NaCl的1/2 MS液体培养基处理3或6 h。用TRIzol试剂(Invitrogen)提取总rna,用RNase-free DNase set (Qiagen)处理,M-MLV逆转录酶(Promega)进行逆转录。对于实时PCR检测,使用ChamQ Universal SYBR qPCR Master Mix (Vazyme)进行反应,使用三个独立的生物学重复。描述了相对实时PCR扩增gydF4y2Ba肌动蛋白2/8gydF4y2Ba作为内部控制[gydF4y2Ba47gydF4y2Ba]。用于QRT-PCR的引物已列在附加文件中gydF4y2Ba5gydF4y2BaS1:表。gydF4y2Ba
蛋白质凝胶印迹法gydF4y2Ba
为了检测K10a-GFP转基因苗的蛋白水平,将5日龄转基因苗按规定时间用含200 mM NaCl的1/2 MS液体培养基处理,然后在液氮中研磨成细粉。蛋白在提取缓冲液(50 mM Tris-HCl, pH 7.4, 150 mM NaCl, 5 mM EDTA, 1 mM PMSF, 5 mM DTT, 0.5% SDS)中提取,并用BCA蛋白检测试剂盒(TaKaRa)进行定量,如所述[gydF4y2Ba48gydF4y2Ba]。用12%SDS-PAGE凝胶分离每个样品的等量蛋白质,并转移到硝化纤维素膜上。用5%脱脂牛奶封闭膜,用多克隆抗GFP(1/2000)或抗肌动蛋白(1/5000)抗体孵育。用X射线胶片(柯达)观察信号。gydF4y2Ba
植物中活性氧的测定gydF4y2Ba
测定活性氧,5日龄野生型和gydF4y2Baabc1kgydF4y2Ba在规定的时间内用含200 mM NaCl的1/2 MS培养基处理突变体,用染料染色。活性氧水平分析如前所述[gydF4y2Ba49gydF4y2Ba]。gydF4y2Ba
在NBT染色过程中,幼苗在由20个细胞组成的反应缓冲液中培养15分钟 嗯 磷酸钾缓冲液(pH 6.2), 0.1 M NaCl和1 嗯,NBT。反应在黑暗中进行,以抑制NBT的分解。幼苗用水冲洗三次以去除多余的染料,然后在酸化缓冲液(10)中培养 毫升甲醇,2 毫升盐酸,38 mL水)和碱性缓冲液(7%氢氧化钠和60%乙醇)15分钟 分别为分钟。可以观察到马扎林,并通过梯度浓度乙醇处理去除色素。使用Olympus MVX10立体显微镜拍摄子叶或根。gydF4y2Ba
对于DCFH-DA染色,将幼苗在黑暗中以反应缓冲液(20mM k-磷酸,pH6.0,50mM DCFH-DA)一起孵育10分钟。使用Carl Zeiss LSM710 Meta激光扫描显微镜在488nm下拍摄子叶。gydF4y2Ba
蓝本地-PAGE和复杂性测定gydF4y2Ba
检测线粒体复合物的积累,5日龄野生型和gydF4y2Ba10A-1gydF4y2Ba,gydF4y2Ba10A-2gydF4y2Ba用MS培养基或含有100 mM NaCl的MS培养基上培养的突变体制备线粒体膜蛋白,如前所述[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].对于线粒体蛋白丰度的分析,50 通过4.5%至16%的梯度蓝色天然PAGE(Invitrogen,BN1002BOX)分离每个样品中的μg线粒体蛋白质,用考马斯亮蓝(CBB)染色,用10%甲醇和10%乙酸(v/v)褪色,然后成像。gydF4y2Ba
生物信息学和系统发育分析gydF4y2Ba
拟南芥gydF4y2BaABC1Ks蛋白序列从UniProt (gydF4y2Bahttps://www.uniprot.org/gydF4y2Ba)用于同源排列。通过使用软件Mega4进行序列对准和进化树的图。gydF4y2Ba
量化和统计分析gydF4y2Ba
定量数据表示为平均值±SD和平均值±SE。通过单向ANOVA和双向ANOVA进行各种治疗和材料之间的统计显着性。统计显着性设定为*gydF4y2BaPgydF4y2Ba< 0.05,* *gydF4y2BaPgydF4y2Ba < 0.01, ***PgydF4y2Ba< 0.001。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究期间生成或分析的所有数据均包含在本已发表文章及其补充信息文件中。本研究期间的植物材料可根据合理要求从通讯作者处获得。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
不适用。gydF4y2Ba
缩写gydF4y2Ba
- ABC1K:gydF4y2Ba
-
bc1复合体激酶的活性gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- SOS:gydF4y2Ba
-
盐过度敏感gydF4y2Ba
- SCaBP8:gydF4y2Ba
-
SOS3样钙结合蛋白8gydF4y2Ba
- PKS5:gydF4y2Ba
-
蛋白激酶SOS2-Like 5gydF4y2Ba
- HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba:gydF4y2Ba
-
过氧化氢gydF4y2Ba
- 1gydF4y2BaOgydF4y2Ba2gydF4y2Ba:gydF4y2Ba
-
单线态氧gydF4y2Ba
- 哦:gydF4y2Ba
-
氢氧自由基gydF4y2Ba
- OgydF4y2Ba2gydF4y2Ba˙ˉ:gydF4y2Ba
-
超氧化物阴离子自由基gydF4y2Ba
- UQ:gydF4y2Ba
-
泛醌gydF4y2Ba
- 没有:gydF4y2Ba
-
一氧化氮gydF4y2Ba
- AtMT2b:gydF4y2Ba
-
2型金属硫蛋白gydF4y2Ba
- AtVDAC3:gydF4y2Ba
-
电压依赖性阴离子通道3gydF4y2Ba
- MMP的:gydF4y2Ba
-
线粒体膜电位gydF4y2Ba
- GSH:gydF4y2Ba
-
三肽谷胱甘肽gydF4y2Ba
- SOD:gydF4y2Ba
-
超氧化物歧化酶gydF4y2Ba
- 猫:gydF4y2Ba
-
过氧化氢酶gydF4y2Ba
- APX型:gydF4y2Ba
-
抗坏血酸盐过氧化物酶gydF4y2Ba
- GPX:gydF4y2Ba
-
谷胱甘肽过氧化物酶gydF4y2Ba
- NBT:gydF4y2Ba
-
氮蓝四唑gydF4y2Ba
- RD29A:gydF4y2Ba
-
对干燥反应29AgydF4y2Ba
- KIN1:gydF4y2Ba
-
激酶1gydF4y2Ba
- COR15b:gydF4y2Ba
-
冷调节15 bgydF4y2Ba
- HgydF4y2Ba2gydF4y2BaDCF-DA:gydF4y2Ba
-
2 ' 7 ' -dichlorofluorescin二醋酸盐gydF4y2Ba
- 考克斯:gydF4y2Ba
-
细胞色素C氧化酶gydF4y2Ba
- 记者:gydF4y2Ba
-
替代途径gydF4y2Ba
- AOX:gydF4y2Ba
-
交替氧化酶gydF4y2Ba
参考gydF4y2Ba
- 1.gydF4y2Ba
王志强,王志强,王志强,等。SOS2与核苷二磷酸激酶2和过氧化氢酶的相互作用揭示了盐胁迫与HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba信号在gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.Mol细胞Biol。2007; 27:7771-80。gydF4y2Ba
- 2.gydF4y2Ba
杨Y,郭Y.阐明培养植物盐应激反应的分子机制。新植物。2018; 217:523-39。gydF4y2Ba
- 3.gydF4y2Ba
Ismail A,Takeda S,Nick P.盐压力下的生死:同样的球员,不同的时间?J Exp Bot。2014; 65:2963-79。gydF4y2Ba
- 4.gydF4y2Ba
朱镕基JK。盐胁迫下离子稳态的调节。植物学报2003;6:441-5。gydF4y2Ba
- 5.gydF4y2Ba
林浩,杨玉清,吴勇,杜伟,等。SOS2蛋白激酶磷酸化sos3样钙结合蛋白8可稳定其蛋白复合物并调节其耐盐性gydF4y2Ba拟南芥gydF4y2Ba.植物细胞。2009;21:1607-19。gydF4y2Ba
- 6。gydF4y2Ba
杨志,王超,薛勇,刘旭,陈胜,宋春平,等。钙激活14-3-3蛋白作为盐胁迫耐受的分子开关。Nat Commun。2019;10:1199 - 210。gydF4y2Ba
- 7。gydF4y2Ba
周H,林H,Chen S,Becker K,Yang Y,Zhao J,等。抑制抑制gydF4y2Ba拟南芥gydF4y2Ba通过14-3-3蛋白盐过于敏感途径。植物细胞。2014; 26:1166至1182年。gydF4y2Ba
- 8。gydF4y2Ba
马L,叶军,杨勇,林H,粤L,罗J,等。所述SOS2-SCaBP8复杂生成和盐胁迫条件下微调的AtANN4依赖性钙签名。DEV细胞。2019; 48:697-709。gydF4y2Ba
- 9。gydF4y2Ba
Miller Gad,Suzuki N,Ciftci-yilmaz S,Mittler Ron。干旱和盐度应力期间的活性氧物种稳态和信号传导。植物细胞环境。2010; 33:453-67。gydF4y2Ba
- 10.gydF4y2Ba
李志刚,李志刚,李志刚。植物活性氧基因网络的研究进展。植物科学学报。2004;9:490-8。gydF4y2Ba
- 11.gydF4y2Ba
叶伟,胡胜,吴磊,等。白条纹叶12 (WSL12)编码核苷二磷酸激酶2 (OsNDPK2),调控水稻叶绿体发育和非生物胁迫反应(gydF4y2Ba栽培稻L。gydF4y2Ba).mol繁殖。2016; 36:57-71。gydF4y2Ba
- 12.gydF4y2Ba
Poyton Ro,Ball Ka,Castello Pr。线粒体产生自由基和缺氧信号。趋势内科特遇到了。2009; 20:332-40。gydF4y2Ba
- 13.gydF4y2Ba
张米,刘某,Takano T,张XX。ATMT2B和ATVDAC3之间的相互作用影响NaCl应力下的线粒体膜电位和反应性氧物种gydF4y2Ba拟南芥gydF4y2Ba.Planta。2018; 249:417-29。gydF4y2Ba
- 14.gydF4y2Ba
氧化还原稳态和抗氧化信号:应激感知和生理反应之间的代谢界面。植物细胞。2005;17:1866 - 75。gydF4y2Ba
- 15.gydF4y2Ba
活性氧和抗氧化机制在植物抗非生物胁迫中的作用。植物生理学报2010;48:909-30。gydF4y2Ba
- 16.gydF4y2Ba
等。转基因水稻耐盐性的增强gydF4y2Ba大肠杆菌gydF4y2Ba过氧化氢酶基因,gydF4y2Ba凯特gydF4y2Ba.植物生物技术代表2007;1:49-55。gydF4y2Ba
- 17。gydF4y2Ba
ABC1是一种新的酵母核基因,在线粒体中具有双重功能:它抑制细胞色素b mRNA翻译缺陷,并对bc1复合物中的电子转移至关重要。EMBO。1991; 10:2023-31。gydF4y2Ba
- 18。gydF4y2Ba
王志强,王志强,王志强,等。gydF4y2BaCABC1gydF4y2Ba基因突变导致小脑共济失调和癫痫发作的泛素缺乏。Am J Hum Genet. 2008; 82:623-30。gydF4y2Ba
- 19。gydF4y2Ba
Poon WW,Davis De,Ha Ht,Jonassen T,相反PN,Clarke CF.鉴定gydF4y2Ba大肠杆菌ubiBgydF4y2Ba,在泛醌生物合成中第一次单氧化酶步骤所需的基因。J细菌。2000; 182:5139-46。gydF4y2Ba
- 20。gydF4y2Ba
Lundquist PK, Poliakov A, Bhuiyan NH, Zybailov B, Sun Q, Wijk KJ。基于定量蛋白质组学和全基因组共表达分析的拟南芥质体蛋白组的功能网络。植物杂志。2012;158:1172 - 92。gydF4y2Ba
- 21。gydF4y2Ba
Lundquist PK,Davis JI,Wijk KJ.植物中的ABC1K非典型激酶:填补细胞器激酶空缺.植物科学趋势.2012b;17:546-55。gydF4y2Ba
- 22。gydF4y2Ba
Jasinski M,Sudre D,Schansker G,Schellenberg M,Constant S,Martinoia E,Bovet L. Atosa1,ABC1样系列的成员,作为镉和氧化应激反应的新因素。植物理性。2008; 147:719-31。gydF4y2Ba
- 23。gydF4y2Ba
杨氏,曾X,李t,刘米,张某,高S等人。gydF4y2BaAtACDO1gydF4y2Ba中,ABC1样激酶基因,参与叶绿素降解,并在响应于光氧化胁迫gydF4y2Ba拟南芥gydF4y2Ba.J Exp Bot. 2012; 63:3959-73。gydF4y2Ba
- 24。gydF4y2Ba
Lundquist PK,Poliakov A,Giacomelli L,Friso G,Mason A,McQuinn Rp等。Plastoglobule Kinases ABC1K1和ABC1K3的损失导致茉莉酸途径的条件下垂,改性戊烯 - 脂质和募集。植物细胞。2013; 25:1818-39。gydF4y2Ba
- 25gydF4y2Ba
Martinis J,Glauser G,Valimareanu S,Kessler F.叶绿体ABC1样激酶调节维生素E新陈代谢gydF4y2Ba拟南芥gydF4y2Ba.植物杂志。2013;162:652 - 62。gydF4y2Ba
- 26gydF4y2Ba
等。ABC1K1/PGR6激酶:光合活性和叶绿体代谢之间的调节联系。植物j . 2014; 77:269 - 83。gydF4y2Ba
- 27gydF4y2Ba
刘征镒,贾应祥,丁玉玲,史玉涛,李铮,郭勇,等。冷反应中,质膜crpk1介导的14-3-3蛋白磷酸化诱导其核导入以微调CBF信号。痣细胞。2017;66:117-28。gydF4y2Ba
- 28gydF4y2Ba
廖聪聪,郑宇,郭宇。拟南芥中MYB30转录因子通过膜联蛋白介导的胞质钙信号调节氧化和热应激反应。新植物志。2017;216:163–77。gydF4y2Ba
- 29.gydF4y2Ba
崔凤全,杨晓明,何晓强,王志伟,等。甲基紫原诱导的叶绿体与线粒体信号的相互作用gydF4y2Ba拟南芥gydF4y2Ba.自由基生物Me. 2019; 134:555-666。gydF4y2Ba
- 30.gydF4y2Ba
杨玲,张娟,何金娟,秦媛媛,华丹平,段勇,等。aba介导的ROS在线粒体中通过调控根分生组织的活性gydF4y2Ba过多gydF4y2Ba表达gydF4y2Ba拟南芥gydF4y2Ba.公共科学图书馆麝猫。2014;10:e1004791。gydF4y2Ba
- 31。gydF4y2Ba
雅各比RP,泰勒NL,米勒AH。线粒体呼吸在耐盐性中的作用。植物学报。2011;16:1360-85。gydF4y2Ba
- 32。gydF4y2Ba
Purvis AC, Shewfelt RL。这种替代途径是否能改善植物敏感组织的冷害?杂志。1993;88:712-8。gydF4y2Ba
- 33。gydF4y2Ba
Brasseur G,Tron P,Dujardin GV,Slonimski PP,Chevillotte PB。核gydF4y2Ba他们gydF4y2Ba基因是线粒体呼吸链中细胞色素bc1复合物及其邻近复合物II和IV的正确构像和功能所必需的。欧洲生物化学杂志,1997;246:103-11。gydF4y2Ba
- 34.gydF4y2Ba
Moller IM.植物线粒体和氧化应激:电子传递、NADPH周转和活性氧物种的代谢。植物生物学年鉴。2001;52:561–91。gydF4y2Ba
- 35.gydF4y2Ba
研究结果表明,大豆亲水性抗氧化活性的变化gydF4y2BaAvena Sativa.gydF4y2Ba和gydF4y2Ba小麦gydF4y2Ba不同年龄的叶片在去黄化和强光处理。植物学报2006;119:321-7。gydF4y2Ba
- 36.gydF4y2Ba
活性氧:代谢、氧化应激和信号转导。植物学报2004;55:73 - 99。gydF4y2Ba
- 37.gydF4y2Ba
塞纳拉,枝形南部NS。线粒体活性氧物种的生理作用。Mol细胞。2012; 48:158-67。gydF4y2Ba
- 38.gydF4y2Ba
关键词:拟南芥,脱落酸,H基因,表达谱gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba应用程序。J Intent Plant Biol。2006; 48:62-74。gydF4y2Ba
- 39.gydF4y2Ba
Rizhsky L,Hallak-Herr E,Van Breusegem F,Rachmilevitch S,Barr Je,Radermel S,inzéd,缺乏抗坏血酸过氧化物酶和过氧化氢酶的双反义植物对氧化应激的敏感性小于缺乏抗坏血酸过氧化物酶或过氧化物酶的单一反义植物.工厂J. 2002; 32:329-42。gydF4y2Ba
- 40.gydF4y2Ba
Stefely JA,Reidenbach AG,奥博锐A,Oruganty K,弗洛伊德BJ,Jochem A,等人。线粒体ADCK3采用非典型蛋白激酶样折叠,使还原型辅酶Q的生物合成。Mol细胞。2015年; 57:83-94。gydF4y2Ba
- 41.gydF4y2Ba
燕S,王W,MarquésJ,Mohan R,Saleh A,Durrant We,等。水杨酸激活DNA损伤对增强植物免疫的影响。Mol细胞。2013; 52:602-10。gydF4y2Ba
- 42.gydF4y2Ba
阵伤SJ,弯曲AF。花卉DIP:简化方法gydF4y2Ba农杆菌属gydF4y2Ba-基因的介导转化gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.植物j . 1999; 16:735-43。gydF4y2Ba
- 43。gydF4y2Ba
关键词:泛素E3连接酶,MYB30,脱落酸,降解植物杂志。2018;178:428-40。gydF4y2Ba
- 44。gydF4y2Ba
刘辉,郭淑英,陆明辉,张勇,李建华,王伟,等。DHGA12的生物合成及其在拟南芥幼苗建立中的作用。Nat Commun。2019;10:1768 - 81。gydF4y2Ba
- 45。gydF4y2Ba
王赵Y,张ZJ,高JH, PC,胡T, et al。拟南芥PYL ABA受体的十倍突变体显示PYL抑制ABA独立的SnRK2活性。细胞众议员2018;23:3340-51。gydF4y2Ba
- 46。gydF4y2Ba
林志,李勇,张震,刘旭,徐春春,等。在高等植物中,RAF-SnRK2激酶级联介导了早期渗透胁迫信号。Nat Commun。2020;11:613。gydF4y2Ba
- 47。gydF4y2Ba
Guo Sy,Dai Sj,Singh Pk,Wang Hy,Wang Yn,Tan Jlh等。膜结合的NAC样转录因子OSNT15抑制了开花gydF4y2Ba栽培稻gydF4y2Ba《前线工厂科学》2018;9:555-64。gydF4y2Ba
- 48。gydF4y2Ba
王电脑,杜yy,侯yj,赵y,h煤,元fj等。通过OST1的S-亚硝基化,一氧化氮负调节保护细胞中的脱落酸信号传导。P Natl Acad Sci USA。2015; 112:613-8。gydF4y2Ba
- 49gydF4y2Ba
王铮,王凤峰,洪永昌,黄君仁,石兆华,朱建军。两种叶绿体蛋白通过影响保卫细胞中ROS的产生来抑制抗旱性。植物杂志。2016;172:2491 - 503。gydF4y2Ba
- 50.gydF4y2Ba
袁H,刘D.五乙酸蛋白SLG1的功能破坏影响线粒体RNA编辑,植物发育和对非生物胁迫的反应gydF4y2Ba拟南芥gydF4y2Ba. 《植物杂志》,2012年;70:432–44.gydF4y2Ba
- 51.gydF4y2Ba
等。AOX1D亚型替代氧化酶的诱导gydF4y2Ba蒂利亚纳gydF4y2Ba缺乏同种型Axox1a的T-DNA插入线不足以在用抗霉素A处理时优化光合作用。莫尔植物。2009; 2:284-97。gydF4y2Ba
致谢gydF4y2Ba
我们感谢血路王博士用于提供gydF4y2BaPCAMBIA1302gydF4y2Ba向量。我们感谢王伟和张国增提出的宝贵意见。我们感谢李阳对BN-PAGE分析提出的宝贵意见。gydF4y2Ba
资金gydF4y2Ba
该工作得到了中国农业部(2016ZX08009003002),111项目#D16014和中国博士后科学基金会(2019 M652522)的支持。该资助者在设计研究,收集,分析数据和写作稿件时没有发挥作用,但只提供财政支持。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
CPS构思并引导实验。XQ执行了实验,分析了数据并写了这篇文章。ZD,YZ和WL对实验设计,数据分析和手稿修订进行了实质性贡献。SG和JRB执行了手稿修订版。所有作者阅读并认可的终稿。gydF4y2Ba
通讯作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:S1gydF4y2Ba
的gydF4y2BaABC1K10AgydF4y2Ba过表达系对盐胁迫的耐受性更强。(A)不同基因型、野生型、gydF4y2Ba10A-1gydF4y2Ba突变体,gydF4y2Ba10A-2gydF4y2Ba在MS或添加100 mM NaCl的MS培养基上培养突变体和两个独立的过表达品系OE-1和OE-2。Bar = 500 μm。(B)子叶绿化的数量。进行了3次生物重复。误差条指示±SD (gydF4y2BangydF4y2Ba= 100)。星号表示与相应野生型(**)差异显著gydF4y2BaPgydF4y2Ba < 0.01, *PgydF4y2Ba < 0.05,tgydF4y2Ba以及)。gydF4y2Ba
附加文件2:S2gydF4y2Ba
ABC1K10A的表达是通过平移水平的NaCl治疗诱导的。提取总蛋白质,表达5日龄的转基因幼苗gydF4y2BaABC1K10apro: ABC1K10a-GFPgydF4y2Ba分别用200 mM NaCl处理0、3或6 h。蛋白提取液用α-GFP抗体western blotting分析。肌动蛋白作为对照。gydF4y2Ba
附加文件3:S3gydF4y2Ba
野生型和野生型线粒体复合物的丰度gydF4y2Ba10gydF4y2Ba突变体。gydF4y2Ba
附加文件4:S4gydF4y2Ba
分子表征gydF4y2BaABC1KgydF4y2Ba家庭成员。(A) T-DNA插入等位基因的位置。(B)的表达gydF4y2BaABC1KS.gydF4y2Ba通过QRT-PCR检测。gydF4y2Ba
附加文件5:表S1gydF4y2Ba
本研究使用的引物。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
秦旭,段志强,郑永强。gydF4y2Baet al。gydF4y2BaABC1K10a是一种非典型激酶,在植物耐盐胁迫中起作用。gydF4y2BaBMC植物杂志gydF4y2Ba20,gydF4y2Ba270(2020)。https://doi.org/10.1186/s12870-020-02467-4gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02467-4gydF4y2Ba
关键字gydF4y2Ba
- ABC1KgydF4y2Ba
- ABC1K10AgydF4y2Ba
- 盐胁迫gydF4y2Ba
- 活性氧gydF4y2Ba
- 线粒体gydF4y2Ba