- 研究文章
- 开放访问
- 发布:
桑比较转录组分析揭示了黑花青素合成机制(Morus Atropurpurea的罗)和白色(森菊属L.)果实基因型
BMC植物生物学体积20.文章编号:279.(2020.)
抽象的
背景
为了更好地了解在桑树果汁中的花青素生物合成,我们分析了桑椹品种DA 10的转录组(Morus AtropurpureaRoxb。那B.lack fruit) and Baisang (森菊属L.,白果树)。
结果
我们发现DA 10具有高水平的Cyanidin 3-O.-Glucoside(Cy)和Pelargonidin 3-O.-葡萄糖苷(Pg),百桑仅含Cy,含量较低。基于比较转录组分析,我们注释了超过27085个基因(包括1735个新基因)。结果表明,大10和百桑在果实发育的3个阶段(S1[4256个基因,花后10 d (DPA))、S2(5612个基因,19个DPA)和S3(5226个基因,28个DPA)中有差异表达。花青素的生物合成与15个核心基因和5个转录因子的表达有关。相对于百桑,大10在花青素生物合成的早期(中间化合物查尔酮和二氢黄酮醇的产生)和晚期(Cy和Pg的产生)的基因表达显著上调。白桑花青苷生物合成早期相关基因显著下调,黄酮3-羟化酶(FLS)过表达,产生槲皮素和/或杨梅素,而不产生花青素。
结论
花青素的在桑椹生物合成是从所述前体,苯丙氨酸开始,并通过二氢黄酮醇4-还原酶的上调介导的,花色素合成酶,花青素-3-O.葡糖基转移酶,和花青素-3-O.葡萄糖苷的2-O.-Glucuronosyltransferase,以及FLS的下调生产Cy和PG。
背景
花青素是一个化学上不同的类属于植物化合物的类黄酮组次级代谢产物。这种多功能酚醛组分子,其中超过635已确定日期,分别负责许多果实,种子的不同颜色(蓝调,紫色和红色),和花[1].大约95%的性质中的所有花青素源自六个主要的花青素(糖蜜),即Cyanidin(Cy),Pelargonidin(PG),麦芽素(MV),培养蛋白(PN),Delphinidin(DP)和Petunidin(Pt)[2].这些分子的存在和浓度有助于在植物组织中观察到的色素沉着。例如,鲜花中的不同蓝色阴影可归因于DP,而Reddish色调是由于CY [3.].除了作为着色剂的角色,某些花青素施加抗病毒,抗菌和杀菌活动[4.那5.因此,因此可以在通过致病微生物免受感染植物的作用来发挥作用。
花青素通常对哺乳动物和其他脊椎动物显示出低毒性[6.[众多研究表明,这些黄酮类化合物可能具有健康促进性质,例如抗炎,抗癌性和心脏保护活性,以及控制肥胖症和减轻糖尿病的疗效。假设在细胞系测定,动物研究和临床试验中观察到花青素的有益效果,与其强烈的抗氧化能力相关[7.].这些生物活性对花青素,它现在是在植物科学的研究最多的化合物中积极研究和花青素合成途径和在转录水平调控机制已在许多植物物种[彻底调查8.那9.].虽然在玉米,Snapdragon和Petunia中的花青素生物合成途径分享了许多常见反应,但它们也表现出显着的差异,鉴于所涉及的大量基因及其多重复杂相互作用。在桑树果岭素的组分和含量的分析的基础上,已经确定了桑树的花青素的主要成分是Cy。然而,在桑树花青素合成期间,PG和DP似乎通常不会代谢,其原因尚不清楚[10.那11.].这些机制最终影响在植物,其植物物种之间变化基本上,甚至不同的同一物种的品种[总花青素含量12.].
桑树(森属)不仅可作为蚕一个foodplant(Bombyx Mori.)但也传统上被用作东亚国家的药用植物。在中国,桑椹果被用作草药以防止肝肾损害,改善视力,加强关节,也用于其抗衰老作用,并治疗喉咙痛,发热,高血压和贫血[13.].桑椹含有大量花青素,其中与不同颜色的水果[相关联的所述不同水平14.].至少11个花青素已在桑葚被识别,主要部件可放置花青素-3-O.-Glucoside和Cyanidin-3-O.- 泌尿油[15.16]。迄今为止,对桑树花青素的生物合成的研究主要集中在其合成中涉及的少数选定基因的表征和表达[17.18]。但是,可用信息有限,因此我们尚未完全了解桑树中的花青素生物合成。全世界大约15种桑树物种(m·阿尔巴那m .黑质那- 多M.那M. Atropurpurea那m . bombycis那M. Mizubo.那M. Wittiorum.那M.金樱子那M. Cathayana那吉隆桑那蒙古M.那m . notabilis那M. nigriformis那M. Yunnanensis., 和m .南极光),其中桑椹品种100多个。这些品种最显著的区别之一是它们产生的果实的颜色,可能是黑色、粉色、红色或白色,不同桑树类型之间的这种自然变异为阐明花青素生物合成途径提供了宝贵的机会。
在目前的研究中那我们在这方面的努力集中在两个桑树品种大10(桑产量品质及蚕茧roxb。)和baisang(森菊属L.)[15.].DA10的叶子是心脏形的,相对平坦的,翡翠绿,光滑,稍皱,而那些Baisang的是心脏形的,完全或分裂,平坦的,深绿色,光滑,没有皱纹。沓10的特征在于大的紫色黑色果,而在相反,Baisang的果实是中型和玉白色。此前,杨等人。比较分析了15种和4个亚种的分类传统的桑葚之间的遗传结构。聚类分析表明之间Nei氏遗传一致性系数M. Atropurpurea和m·阿尔巴是0.9575,而遗传距离为0.0435,从而表明这两个物种之间的密切关系[16.].
出于本研究的目的,我们的特征和比较了DA 10和Baisang的转录活动,在发生后性化后的天数(DPA),即S1(10dPa),S2(19 dpa)和S3(28dPa),使用illumina测序技术。基于对基因本体学(GO)和基因组(KEGG)数据库的基因本体(GO)和Kyoto百科全书来确定差异表达基因(DEGS)的标识。通过将RNA-SEQ结果与定量实时PCR(QPCR)的结果进行比较来验证转录组数据。我们还调查了转录因子在花青素综合中的调节作用,以更好地了解桑树果实发育的机制。
结果
在桑果色的化合物种类
通过对大10和百桑两个桑品种果实不同发育阶段花青素含量的比较,研究了影响白桑果实颜色发育不全的生化因素。在Da 10中,果实颜色分别在S1、S2和S3阶段由绿色变为紫色,然后变为黑色。1).对于Baisang品种,桑里斯从绿色变为浅绿色,然后分别在阶段S1,S2和S3处进行白色(图。1).DA 10中的花青素含量包含Cy和PG。在S1中,未检测到这两种花青素,而在第2阶段,Cy和PG水平分别为23.533μg/ g和4.197μg/ g。在DA 10的成熟过程中,Cy和PG的水平分别在阶段S3达到375.29和24.423μg/ g。在Baisang,Cy是唯一检测到的花青素,其水平在S3的S2至10.957μg/ g的范围为4.87μg/ g(表1).结果表明,虽然白桑果实呈白色,但Cy含量较低,其他花青素Dp、Pn和Mv在两个品种的任何发育阶段均未检测到。
转录组测序,群集和功能度的视角富集
由于质量过滤,我们获得了33.77-744.56亿优质150-BP配对读数。已删除RRNA读取,测序读取被映射到Morus notabilis.施耐德。曼参考基因组(https://morus.swu.edu.cn/morusdb/),共注释27085个以上基因,其中新增基因1735个(见表)S1).
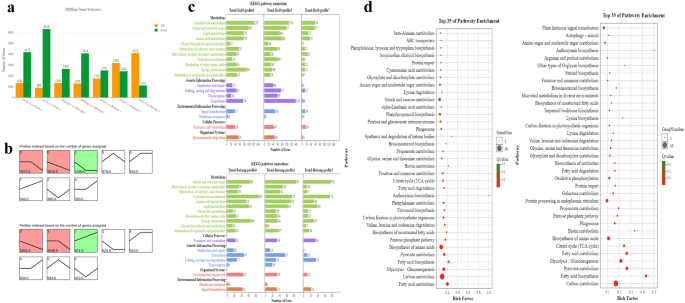
DEGS使用修边器包(标识http://www.rproject.org/).比较在阶段S1和S2获得的测序成绩单,我们发现5513名3973度的视角在大10和Baisang,分别的果实,而我们的阶段,S2和S3之间的比较使我们能够确定7204和5359在达10的水果Baisang,分别。在两个品种之间的比较的基础上,我们发现4256,5612,5226在DEGS发育阶段S1,S2,和S3,分别(图2一个)。
为了分析DEG的表达模式,将不同阶段的表达数据归一化为0,log2(V1 / V0),和日志2(v2 / v0),然后使用短时间系列表达式矿工软件(Stew)群集。基于基因表达模式,将两种品种的果实中的果实中的果实聚集成八种型材。在DA 10中显着富集在型材0,1和3中,而在Baisang中显着富集了曲线0,3和7中的曲线(图。2b)。曲线0和3中的egs在两个基因型中下调。为了检查富集的基因和代谢物积聚之间的关系,曲线0,3和7中的含量为两种品种。轮廓7分别含有25和10°的DI 10和Baisang,其与次级代谢物的生物合成有关。在概况7中,来自碳水化合物,脂质和能量代谢的较大数量的基因来自baisang(图。2C)。途径富集分析表明,酪氨酸,苯丙氨酸,色氨酸,苯丙,类黄酮,花青素的生物合成在型材7被显著富集沓10,这表明,花青素,从该前体苯丙氨酸合成,经由苯丙的生物合成,类黄酮和花色素苷。在Baisang,型材7包含参与果糖和甘露糖代谢,脂肪酸代谢,糖酵解/糖异生,和脂肪酸生物合成(图基因。2d)。
桑树水果的花青素生物合成途径
基于转录组测序和DEG的表达模式来鉴定参与花色素苷代谢的关键转录物的数据,我们比较基因在沓10和Baisang转录丰度。因此,我们发现,参与酪氨酸,苯丙氨酸和色氨酸的生物合成,分支酸变位酶(CM),arogenate脱水酶(PDT)和天冬氨酸 - 预苯酸氨基转移酶(PAT)三个基因,在达10,但不是在Baisang(表上调S2).相对于Baisang在Da 10过表达的其他基因包括那些与苯丙,类黄酮,花青素和生物合成(表S2, 无花果。S1).因此,我们推断,途径参与苯丙氨酸,酪氨酸,色氨酸,苯丙烷类,类黄酮,花色素合成是为大10表型的发展至关重要。有针对性的代谢组学数据表明,与这些途径相关的代谢物类似的趋势。
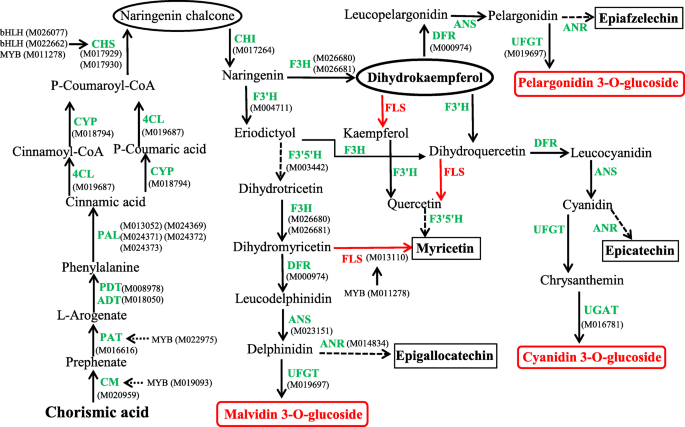
为了在桑树果实中获得花青素生物合成途径的全球图片,比较了参与花青素合成的基因的转录物水平,以及DA 10和Baisang中的主要相关代谢分支。数字3.介绍了桑椹果实中花青素代谢及其核心代谢产物和酶的示意图,突出了两个桑椹品种之间的关键步骤的不同。查尔酮合成酶(CHS)在黑桑葚中的表达水平是白色桑葚的40倍以上。Da 10中进一步上调的一个基因是柚皮素[2-氧戊二酸- 3-双加氧酶(F3H, M026681)],该基因在黑桑葚中的表达水平大约是白色桑葚的12倍。4.和图。S2).这个水平的表达预计会产生大量的另一种中间代谢物,二氢山奈酚。这两个途径的上调会增加柚皮素查尔酮和二氢山奈酚的供应,从而促进黑桑葚中花青素的合成(图。3.).
在水果发育的早期阶段,黑白桑椹均显示出类似水平的花青素和基因表达模式。在发育后一级的黑色桑椹中存在Cy和Pg的存在表明,花青素生物合成途径可能在诸如二氢烷醇4-还原酶(DFR),花青素合酶(DFR)中催化的后期反应下游的点处诱导。(ANS),或花青素3-O.-Lucosylyl转移酶(UFGT)。相比之下,白果中霉菌素的存在表明黄酮醇合酶/黄酮3-羟化酶(FLS)的表达显着上调(图。3.和4.).
桑树水果的花青素合成相关代谢物的定量
在桑树果实中的注释的花青素合成途径的基础上,我们对代谢物进行了绝对的定量分析,即10种黄酮及其前体,包括L-苯丙氨酸,Naringenin和Cyanidin 3-O.-葡萄糖苷,通过靶向代谢物检测(表2).关于苯丙醇化生物合成途径,我们发现,在Baisang,在水果发育的三个阶段的L-苯丙氨酸和羟甲氧基霉素含量高于DA 10中的含量。类似地,在类黄酮生物合成途径中,含量柚皮素,二氢莰非醇,圣草酚,二氢槲皮素和在阶段S1和S2在Baisang均较沓10高,而在第3阶段,这些化合物的含量在Baisang比达10二氢杨梅在阶段S3的含量低在DA 10中发现比在Baisang中更高,尽管未在阶段S1和S2处的任何基因型中检测到。在Baisang的花青素生物合成途径中,我们观察到Cyanidin 3-含量没有显着变化O.葡萄糖苷或矢车菊3-O.- 在三个发育阶段中的疏水化,仅在阶段3中检测到低水平(分别为25.10μg/ g和13.01μg/ g),对比,这两个代谢物在DA 10伴随着果实的发展中逐渐增加,达到最大值分别在阶段3.在Baisang的情况下,分别为9417.323μg/ g和3227.725μg/ g,而L-苯丙氨酸和其他前体丰富,柚皮素和其他中间产物的量显着低于DA中检测到的10在水果开发期间。
与花青素生物合成相关的基因
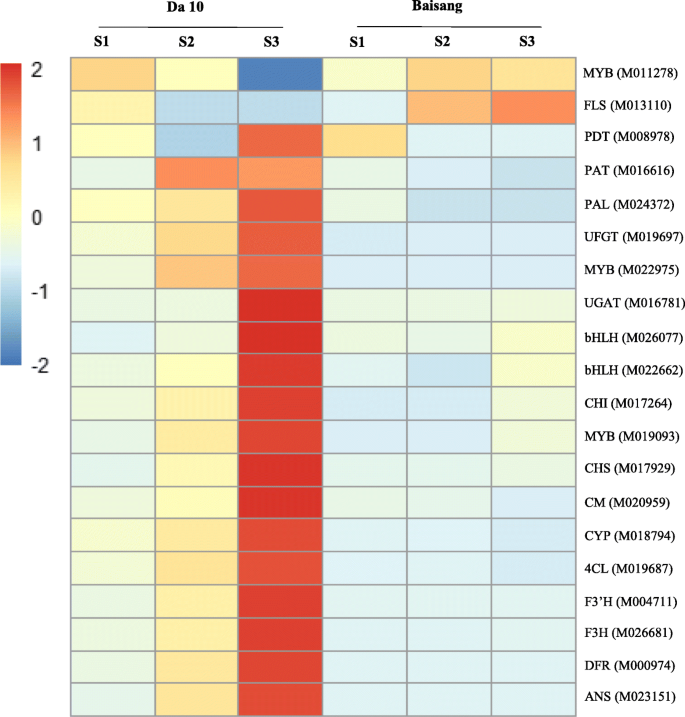
早期基因包括Cm,芳酸酯脱水酶/哌膦脱水酶6(PDA),4-香豆素-CoA连接酶(4Cl),苯丙氨酸氨酶(PAL),CHS,Chalcone-Flavonone异构酶(Chi)和F3'H有助于形成二氢酚酚。晚期基因,DFR,ANS,UFGT和Cyanidin-3-O.-glucoside 2-O-glucuronosyltransferase (UGAT),在花青素的生成中起作用S2, 无花果。3.).在本研究中,我们确定了与花青素生物合成相关的15个核心基因和五种转录因子(表S2),其中,18个上调。只有FLS和MYB转录因子(M011278)相对于白果树(图黑桑葚被下调。4.).值得注意的是,与黑桑葚相比,白桑葚的早期(CM、PAT、PAL、CYP、4CL和CHS)和晚期(DFR、ANS、UFGT和UGAT)基因均显著下调(图2)。4.).UFGT的下调的结果将是Mv和PG的合成的还原,而UgAT的下调将导致较低的Cy水平。
从二氢烷醇中形成黄酮醇均由氟苯催化,其作用于二氢戊戊醇,二氢槲皮素和二氢霉素分别产生kaempferol,槲皮素和霉菌素。与黑桑树相比,我们发现在白色桑树中上调了FLS表达(图。4.).可以想象出,在后一种品种中,低水平的花青素中间体有助于核心花青素生物合成途径基因的下调,从而抑制青霉素的合成,而FLS基因表达的上调将阻断花青素的合成。
我们对Mulberry转录组数据的分析导致注释1217转录因子,其中发现899例差异表达,包括78个MyB转录因子,83个BHLH(基本螺旋环 - 螺旋)转录因子和31 MYB-相关转录因子。涉及与花青素生物合成途径相关的基因调节的大多数转录因子属于MYB和BHLH家族。在本研究中,我们发现DA 10和Baisang之间的转录因子的表达明显不同。涉及花青素生物合成的MYB(M022975和M019093)和BHLH(M026077和M022662)的家族,相对于白色桑椹,在黑色的桑椹中升高,而MYB(M011278)显示出不一致的表达模式。
使用qPCR核心基因和转录因子的表达的验证
为了验证与桑花青素合成基因的核心和转录因子的表达水平,我们选择了Morus010170基因作为参照基因的基础上,在两种基因型果实发育的各个阶段中的稳定表达。然后,我们验证了使用qPCR 19个基因的表达(表3., 无花果。S2).在不同发育阶段这19个基因的表达水平与那些一致的使用RNA测序来确定。发现所有19个基因(特别是CHS,F3'H,F3H,DFR,UFGT和ANS)在沓10显着更高的水平比在Baisang中表达。此外,在所有样品中,基因表达是在阶段S2和S3比在阶段S1显著更高。这些结果因此表明,这19个基因是通过桑椹花青素合成途径参与赛扬和PG的生物合成。此外,我们推测,相关基因的表达的下调(DFR,ANS,UFGT,和UGAT)和FLS的上调表达可能有助于花青素合成的水果Baisang抑制。
讨论
桑树素的化合物和转录体分析
我们通过在桑树品种达10(黑色水果)和Baisang(白果树),其水平的比较研究了桑花色素苷的生物合成。在Da 10中的花色素苷含量由赛扬而Pg,而赛扬是唯一花青素与Baisang低电平检测。在两个花青素赛扬而Pg,这两者都是花青素衍生物的桑葚存在下,与早期研究的结果一致[17.那18.].这些结果证实,在代谢物水平,在桑树品种花青素积累的基因型依赖性差异,以及果色和花青素水平之间的关联。在这方面,赛扬和PG似乎是确定桑果的颜色主要花青素。一旦形成,不稳定cy将被转换为无色表儿茶素,这将永久阻止经由后糖基化等反应稳定着色颜料的形成。
基于比较转录组分析,我们注释了超过27085个基因,其中包括1735个新基因。在发育阶段S1、S2和S3中分别检测到4256、5612和5226个差异表达基因(图2)。2一个)。
桑树水果的花青素生物合成途径
花色苷在叶,果实和花拟南芥蒂利亚纳,葡萄,和风信子已经显示出与三个次级代谢途径,即相关联苯丙,类黄酮,花青素和生物合成途径[19.那20.那21.].缺乏白色桑葚颜色发展将需要花色素苷生物合成途径,这大概之前压差和Cy [的形成发生的完全堵塞22.].在该研究中,在DA 10中升高了酪氨酸,苯丙氨酸和色氨酸生物合成,CM,PDT和PAT中的三种基因,但不在Baisang(表S2).CHS和F3H的表达水平被认为是分别高出40倍和12倍,在黑桑比在白果树(图4.和图。S2).假设这种过度表达将导致大量生产黑桑树中的中间代谢物Naringenin Chalcone。CHS催化花青素生物合成的第一反应,随后有助于螯合酮(中间体)的形成,这是黄酮类化合物的原发性前体[23.].因此,当查尔酮合成受到限制时,花青素的生产和几乎所有其他类黄酮的生产都受到影响[24.].在花青素生物合成途径期间DFR,ANS,UFGT和FLS羟基化反应对不同类型的花青素形成至关重要,最终产生不同的颜色。实际上,花青素积累与编码参与这些反应的酶的基因的表达有关[25.那26.那27.].
在桑果的花青素合成相关的代谢物的定量显示花青素含量的3-O.-葡萄糖苷和花青素3-O.-芦丁苷含量明显低于大10。在两种基因型中,槲皮素都在S1期积累;而在果实发育后期,白桑的表达量逐渐增加,而大10的表达量则减少,说明在果实发育后期表达量上调霉基因促进二氢喹硫汀对槲皮素的转化,并进一步抑制花青素合成。
因素桑果转录核基因的表达和
调节花青素生物合成途径的基因通常被归类为早期和晚期基因[28.].在本研究中,早期(CM,PAT,PAL,CYP,4CL和CHS)和晚期(DFR,ANS,UFGT和UGAT)基因在相对于黑桑椹的白色桑椹中显着下调。并且,在白色桑树上上调了杂种的表达(图。4.).Chalcode合成酶是一种植物特异性聚酮合成酶,其在黄酮类生物合成中起关键作用。在草莓中,CHS不仅表达在花瓣中,而且在水果中表达(其成绩单是丰富的)[29.]草莓的成熟,和上调的CHS,F3'H,DFR和UFGT基因对应的以水果酶促活性的增加[期间30.],产生花青素的在成熟的红色阶段的积累。类似的意见已作出关于ANS表达和花青素积累Allium Cepa.[31.],Duchesnea indica.[32.], 和m·阿尔巴[17.那33.].
几种植物物种(包括稻米)报道了MYB转录因子在与花青素积累相关的基因调节中的作用(栽培稻)[34.],A. Thaliana.[35.),玉米Zea Mays.)[36.),佩妮(矮牵牛织布达)[37.], 葡萄藤 (vitis ViniferaL.)[38.], 苹果 (Malus Domestica.)[39.]和杨树(美洲山杨)[40,基于基因和分子分析。bHLH蛋白是植物中第二大转录因子家族,在植物的代谢、生理和发育过程中发挥重要作用[41.].本结果表明,DA 10和Baisang之间的转录因子的表达明显不同。MYB(M02975和M019093)和BHLH(M026077和M022662)相对于白色桑椹,在黑色的桑椹上上调,而MYB(M011278)显示出一种不一致的表达模式。
结论
本研究的生物化学和分子生物学研究结果为进一步了解桑树不同基因型花青素的合成和积累机制提供了依据。在大10果实的成熟后期,我们观察到两种花色苷Cy和Pg的含量显著增加,而在百桑果实中,只检测到Cy的含量,虽然含量很低,而且只在果实发育的后期。黑桑葚中花青素含量高与花青素合成初始步骤(CM、CHS和CHI)相关基因的上调有关,这些步骤产生中间产物查尔酮和二氢黄酮醇。在黑桑葚中,最终产生Cy、Pg和Mv的基因(DFR、ANS、UFGT和UGAT)的表达也上调。相比之下,白桑葚花青素含量低主要是由于早期基因(MYB、bHLH、CHS和CHI)的下调和FLS表达的上调,导致槲皮素和/或杨梅素的生成。
方法
植物和试剂
两种桑草基因型的水果样品[黑色果实(DA 10品种)和白色水果(Baisang品种)](图。1从中国农业科学院蚕桑研究所的桑树研究所桑树花园收集。每种种类的九种植物被随机选择,每个植物中的每个植物都在三个评估的发育阶段中的每一个中收集,其定义如下:S1(绿色,10dPa),S2(半成熟,19dPa),和s3(成熟,28 dpa)。将在同一阶段的同一阶段收获的果实混合并分成三个复制基团,然后在液氮中冷冻,并立即储存在-80℃下,以进行后续的花青素测定和转录组分析。
从Sigma-Aldrich(圣路易斯,MO,USA)购买了花青素的分析标准(用于Cyanidin,Delphinidin,Peonidin,Pelargonidin和Malvidin)。碘甲烷,碳酸二甲酯,磷酸二甲酯和乙腈由Sangon Biotech(中国上海)提供。使用的其他试剂具有分析等级。
桑椹花青素水平的测定
使用先前描述的方法进行桑树果果果的萃取和测定[42.].花青素提取采用酸化甲醇(甲醇与1.0 N HCl, 85:15, v/v),超声破碎辅助提取。用旋转蒸发器在50℃下蒸发浓缩,然后用酸化甲醇重新溶解。使用高效液相色谱(HPLC)系统(1260 Infinity II LC, Agilent Technologies Inc., CA, USA)对单个花青素进行分离和定量,耦合到双波长紫外可见检测器和数据采集系统(Millennium chromatography Manager version 2.15.01;Waters Corporation, MA, USA)。反相色谱柱(Supelcosil LC-18-dB, 25 cm × 4.6 mm i.d;安捷伦)在室温下使用。
RNA提取和测序
使用基于前述方法的RN09-EASY旋加植物试剂盒(Aidlab生物技术,北京,中国)进行总RNA分离[43.].通过琼脂糖凝胶电泳验证提取的RNA的完整性,使用2100生物分析仪(Agilent Technologies,USA)测量浓度。使用富集的mRNA为每个样品构建cDNA文库。高质量的RNA用于随后的RNA测序,使用Hiseq TM 2500平台(Illumina,San Diego,CA)在广州Gene Denovo Biotechnology Co. Ltd.(中国广州)进行。
规范化和度的视角识别
测序读数被映射到的参考序列m . notabilis使用soapaligner / soap2 [44.].基因表达水平测量为每百万分之外显子模型的千碱基片段读取映射(FPKM),与所使用的时间最长的转录物来计算FPKM。
通过比较da10和Baisang在同一发育阶段转录本的表达水平,鉴定了DEGs。为了校正多次测试,通过分析错误发现率(FDR)来调整p值阈值[45.].为了评估两个基因型果实成熟过程中基因表达模式的变化,使用Short Time-series expression Miner (STEM, version 1.3.8)进行了表达模式分析[46.]基于所有DA 10和Baisang Mulerries。
注释和GO和KEGG功能分类
在NCBI非冗余蛋白数据库(NR),基因的京都与基因组百科(KEGG),蛋白质数据库的直系同源组(COG)和SWISS-PROT数据库的集群:使用以下数据库的所有表达的基因功能注释。用于注释的目的,我们使用BLASTX与1E-5的Blast2GO [电子值截止43.].对于转录本序列,相似性最高的匹配蛋白为最优注释。
使用Web基因本体注释图(Wego)对DA 10和Baisang中的上调基因进行基因本体学(GO)分类进行分类[43.],并且χ2与另一个相比,测试用于识别在一个品种中以1种以上的GO术语。为了鉴定Kegg途径,将每种基因型中的上调基因的数量与参考组中的那些进行比较。
代谢物验证和表达分析
为了分析桑椹果实成熟过程中代谢产物的积累规律,我们进行了靶向代谢组学,对多个花青素相关物质进行了绝对定量分析。LC-ESI-MS/MS系统(HPLC: SHIMADZU CBM30A系统;MS: Applied Biosystems 6500 Q TRAP)对提取样品进行分析。使用三重四极线性离子阱质谱仪(Q trap)和API 6500 Q trap LC/MS/MS系统进行LIT和三重四极(QQQ)扫描,该系统配备ESI Turbo ion - spray界面,在正离子模式下运行,并由Analyst 1.6软件(AB Sciex)控制。采用Waters ACQUITY UPLC HSS T3 C18色谱柱(1.8 μm, 2.1 mm × 100 mm);流动相组成的两个溶剂,0.04%乙酸(溶剂):乙腈0.04%醋酸(溶剂B)。线性梯度洗脱程序被设置为:100% 0分钟,100 - 5% 12.0分钟,12.1分钟5 - 95%,保持在5 - 95%为15.0分钟。流速为0.40 mL/min;温度为40℃,进样量为2 μL。洗脱液连接到esi -三重四极线性离子阱(Q trap)-MS。为确保重现性和可靠性,使用LC-ESI-MS/MS系统对每个样品进行至少3个独立的生物学重复分析。
验证和表达分析
选择一组RNA测序预测的与显色相关的基因进行qPCR检测。采用FastQuant RT试剂盒(天根生物技术,KR106,北京,中国)合成第一链cDNA。利用Primer Premier软件设计qPCR基因特异性引物(见表1)S3).Morus010170基因被用作内部对照以正常化基因表达。使用SYBR预混物进行QPCR测定TaqII交货(Tli RNaseH +;Takara Bio,志贺,日本)在一个LightCycler 480仪器(罗氏)。为确保重现性和可靠性,每个基因进行3次生物重复。我们利用R版本3.1.3 (http://cran.r-project.org/).
统计分析
所有的测试重复3次。数据经由方差(单向ANOVA)的分析来检查。使用PASW统计18进行统计分析。
可用性数据和材料
当前研究期间生成和/或分析的数据集可在NCBI项目PRJNA636910 (https://www.ncbi.nlm.nih.gov/bioproject/PRJNA636910)与登录号SRP265866。
任何合理要求,都可以从相应的作者。
参考文献
- 1。
安德森ØM,Jordheim M的花青素。在黄酮类:化学,生物化学和应用程序,编。ØM安德森,KR马卡姆,页471-552。Boca Raton,FL:CRC压力;2006年。
- 2。
孔建民,谢林林,吴nk,谢淑芬,黄志强。花青素的生物活性分析。Phytochem。2003;64:923-33。
- 3.
齐,Y Y,娄,Q.,李,H.B.,岳,J.,刘,Y.L.,王和解剖Y.J.和双色花发育的生化研究Muscari Latifolium..原生质,250,1273-1281(2013)。
- 4.
Konczak,I.,张,W.花青素 - 不仅仅是大自然的颜色。J. Biomed。Biotechnol。239-240(2004)。
- 5。
Wrolstad,R.E.研讨会12:自然的色彩与其他成分相互作用。花色素苷色素 - 生物活性及着色性能Ĵ食品科学69,C419-C421(2004)。
- 6。
Lee DW,Brammeier S,Smith AP。花青素在芒果和可可叶中的选择性优势。Biotropica。1987; 19:40-9。
- 7。
他j,giusti mm。花青素:具有健康促进性质的自然着色剂。annu rev food sci technol。2010; 1:163-87。
- 8。
狄克逊RA,刘成,君JH。花青素的代谢工程和植物中的凝结单宁。CurrOgin Biotechnol。2013; 24:329-35。
- 9。
阿尔伯特NW,戴维斯KM,刘易斯DH,章H,Montefiori男,Brendolise C,Boase MR,非政府组织H,詹姆森PE,施温KE。转录激活因子和阻遏的保守网络调控真双子叶植物中的花色苷色素沉着。植物细胞。2014; 26:962-80。
- 10。
Chaves-Silva S,Santos Ald,Chalfun-júniorA,Zhao J,Peres Lep,Benedito VA。了解植物的工具,用于养殖品种的紫色水果和蔬菜的花青素合成的基因调控。植物化学。2018; 153:11-27。
- 11.
齐藤R,FUKUTA N,大宫A,伊藤Y,小关Y,Kuchitsu K,参与矮牵牛边际picotee花瓣的形成花青素合成的中山M.调控。植物SCI。2006; 170:828-34。
- 12.
Wu X, Beecher GR, Holden JM, Haytowitz DB, Gebhardt SE, Prior RL。在美国常见食物中花青素的浓度和正常消费的估计。农业食品化学。2006;54:4069-75。
- 13。
李SZ。本草纲目。北京:人民卫生出版社;1982. p。2066-7。
- 14。
康TH,许JY,金HB,刘某JH,金SY。的从对脑缺血桑水果中分离矢车菊素-3-O-β-d-D-吡喃葡萄糖苷的神经保护作用。神经科学快报。2006; 391:122-6。
- 15.
Lu C,Ji DF,朱FR,Zhao Ac,Luo GQ,Su C.中文桑椹品种(中文):中国西南师范大学媒体;2017年。
- 16。
杨G.W.,冯,L.C.,京,C.J.,玉,医学博士,湘,Z.H.遗传结构方差分析桑间(森L.)群体。Seri。SCI。29,323-329(2003)。
- 17。
齐XW,帅Q,陈华,范L,曾QW,他NJ。花色素苷生物合成基因在植物桑树的克隆和表达分析。Mol Gen Genomics。2014; 289:783-93。
- 18。
Dugo P,Mondello L,Errante G,Zappia G,Dugo G.通过窄孔高效液相色谱法用电喷雾电离检测鉴定浆果中的花青素。J. agr。食品化学。2001; 49:3987-92。
- 19。
黄酮醇合成酶和无色花色素拟南芥基因双加氧酶M.佩尔蒂埃表征。对于“早”和“晚”基因的差异调控的进一步证据。植物理性。1997; 113:1437至1445年。
- 20。
Mattivi F,Guzzon R,Vrhovsek U,Stefanini M,Velasco R.葡萄的代谢物分析:黄酮醇和花青素。j农业食品化学。2006; 54:7692-702。
- 21。
摘要:花青素对蓝色花颜色的影响:从化学结构到细胞生理学。ChemInform。2009; 40:884 - 915。
- 22。
Lou, Q., Liu, Y., Qi, Y., Qi, Y.Y., Jiao, S.Z., Tian, F. F, Jiang, L., & Wang, Y.J. Transcriptome sequencing and metabolite analysis reveals the role of delphinidin metabolism in flower colour in grape hyacinth. J Exp Bot 65, 3157–3164 (2014).
- 23。
Koes RE,拼写CE,Elzen PJMV,分子JNM。克隆和查尔酮的分子特征合成酶基因家族矮牵牛织布达.基因。1989;81:245-57。
- 24。
克拉克斯特,韦尔波尔德WS。鉴定植物中彩色色素沉积损失相关基因靶标的系统方法。BMC生物信息学。2011; 12:343。
- 25。
Castellarin SD,Gaspero Gd。天生素生物合成基因在天然存在的葡萄树浆浆性色素型中的转录控制。BMC植物BIOL。2007; 7:46。
- 26。
Wang KL, Bolitho K, Grafton K, Kortstee A, Karunairetnam S, McGhie TK, Espley RV, Hellens RP, Allan AC. R2R3MYB转录因子与调控花青素生物合成途径相关蔷薇科.BMC植物BIOL。2010; 10:50。
- 27。
袁y,ma xh,shi ym,唐dq。六个推定的结构基因的分离与表达分析参与血清素生物合成中的六种推定结构基因Tulipa Fosteriana.SCI Hortic。2013; 153:93-102。
- 28。
植物细胞培养中花青素的生物合成:一种天然着色剂的潜在来源。-见:Kevin G., Kevin D., Chris W.(编):花青素:生物合成,功能与应用。p.107-117,施普林格,纽约(2009)。
- 29。
Almeida, J.R., D’Amico, E., Preuss, A., Carbone, F., de Vos, CH Ric., Deiml, B., Mourgues, F., Perrotta, G., Fischer, T.C., Bovy, A.G., Martens, S., & Rosati, C. Characterization of major enzymes and genes involved in flavonoid and proanthocyanidin biosynthesis during fruit development in strawberry (Fragaria×ananassa.).拱。生物学习。Biophys..465,61-71(2007)。
- 30.
Halbwirth H, Puhl I, Haas U, Jesik K, Treutter D, Stich K,两相jFragaria×ananassa.) 水果。JAgric Food Chem。2006; 54:1479年至1485年。
- 31。
Kim S,Binzel Ml,Yoo Ks,Park S,Pike Lm。粉红色p一个新的轨迹负责洋葱的粉红色特征Allium Cepa.从花色素合成酶的自然突变导致。Mol Gen Genomics。2004; 272:18-27。
- 32。
Debes,M.A.,阿里亚斯,M.E.,Grellet-布农维尔,C.F.,伍尔夫,A.F.,Martinez的-莫拉,M.G.,Castagnaro,A.P.,&迪亚兹-里奇,J.C. WHITR结果实Duchesnea indica.(Rosaceae)受到损害ANS.基因表达。阿米尔。j .机器人。98年,2077 - 2083(2011)。
- 33。
李茹,陆Rh,赵码,王XL,刘海,张Qy,王Xh,umuhoza d,金xy,lu c,li zg,yu md。花青素生物合成基因的分离与表达分析森菊属L. Biol植物。2014; 58:618-26。
- 34。
杨c,李d,刘x,ji c,hao l,zhao x,li x,chen c,cheng z,zhu l.osmyb103l,r2r3-myb转录因子,影响水稻叶片滚动和机械强度(oryza sativa l.。)。BMC植物BIOL。2014; 14:1-15。
- 35。
Stracke R,Werber M,Weisshaar B. R2R3-MyB基因家庭拟南芥蒂利亚纳.CurrOp植物BIOL。2001; 4:447-56。
- 36。
PAZ-ARES J,GHOSAL D,WIIINAND U,Peterson P,Saedler H.监管C1基因座Zea Mays.用同源性与MyB原癌基因产物进行同源性,与转录活化剂的结构相似进行编码。1987年的Embo J.; 6:3553-8。
- 37。
Erika,C.,Sara,Z.,Laura,F.,Flavia,,G.,Anita,Z.,Linda,A.,&Giovanni Battista T.葡萄园MyB5a和MyB5b的功能多样化,控制黄酮类生物合成喇叭花花青素调节突变体。植物细胞生理3那517(2014)。
- 38。
Deluc L,Bogs J,Walker Ar,Ferrier T,Decendit A,Merillon J.转录因子VVMYB5B有助于调节葡萄浆果中的花青素和原霉素生物合成。植物理性。2008; 147:2041。
- 39。
林王K,米凯莱蒂d,帕尔默Ĵ,Volz的R,洛萨诺L,Espley R,艾伦交流。高温通过的花色素苷调节复杂的调制降低苹果果实的颜色。植物细胞ENVIR。2011; 34:1176至1190年。
- 40.
马DW,艾香德男,吉田K,赫尔申宗Ĵ,Constabel CP。两个R2R3-MYB蛋白在杨树类黄酮和苯丙代谢的广泛阻遏。植物杂志2018; 96:949-65。
- 41.
Pires N,Dolan L.植物中BHLH蛋白的早期演变。植物信号表现。2010; 5:911-2。
- 42。
Ajaykrishna,P.G.G,西瓦库玛,T.R.,金,C.,李,S.H.,陈,H.J.,翁,Y.J.,阴,J.,佳J.Q.,与桂,Z.Z.从桑葚水果中富含的酚类提取物的抗氧化和溶血保护作用。Pharmacogn弹匣14,103-109(2018)。
- 43。
尹,J.,Xin,X.D.,Weng,Y.J.,&Gui,Z.Z.转录组范围的分析揭示了进度Cordyceps Militaris.亚文化变性。公共科学图书馆一,https://doi.org/10.1371/journal.pone.0186279(2017年)。
- 44。
Li R,Yu C,Li Y,Lam Tw,Yiu Sm,Kristiansen K,Wang J. Soap2:短读对准的改进超快工具。生物信息学。2009; 25:1966-7。
- 45。
Rajkumar AP, Qvist P, Lazarus R, Lescai F, Ju J, Nyegaard M, Mors O, Børglum AD, Li Q, Christensen JH。RNA-seq中差异基因表达分析和样本池方法的实验验证。BMC基因组学。2015;16:548。
- 46。
恩斯特Ĵ,酒吧-约瑟夫Z. STEM:对于短的时间序列的基因表达数据的分析的工具。BMC生物信息学。2006; 7:191。
致谢
资金
本研究的设计、收集与分析得到四川省创新能力提升计划资助项目(no . 2016ZYPZ-030)的资助。四川省作物育种“十三五”规划项目(2016NYZ0041-01)和四川省促进金融创新能力青年基金专项项目(2020QNJJ-006)。本研究的数据解释由南充市应用技术研发专项(19YFZJ0061)和国家现代农业产业技术体系四川蚕业创新团队(2018CSTD-01)资助。本研究由四川省科技成果转化示范项目(2019ZHCG0032)和农业农村部蚕桑遗传改良重点实验室(KL201912)资助,论文撰写。
作者信息
隶属关系
贡献
GQH, GL, ZZG对实验进行了构思和设计。GQH、YCZ和LW进行了实验。GQH、YCZ、YQY、JD对数据进行了分析。GQH、YCZ、ZZG共同参与了稿件的撰写,并通过了最终稿件。
相应的作者
伦理宣言
伦理批准和同意参与
没有道德的批准和同意参加这个手稿。
利益争夺
提交人声明他们没有利益冲突。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
在三个发育阶段的两种桑树基因型中映射的转录组序列数。
附加文件2:表S2。
桑树果实中的花青素生物合成相关的核心基因。
附加文件3:表S3。
用于QPCR的引物。
附加文件4:图S1。
生物合成途径在桑椹果实。一种。苯丙氨酸,酪氨酸和色氨酸生物合成。湾苯丙醇化生物合成。C。黄酮类生物合成。天。花青素生物合成。
附加文件5:图S2。
利用qPCR检测桑树果实花色苷合成核心基因和转录因子的表达水平。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
黄,G.,Zeng,Y.,Wei,L.等等。桑比较转录组分析揭示了黑花青素合成机制(Morus Atropurpurea的罗)和白色(森菊属L.)水果基因型。BMC植物BIOL.20,279(2020)。https://doi.org/10.1186/s12870-020-02486.1.
已收到:
公认:
发表:
关键词
- 桑树果实
- 花青素
- 生物合成
- 转录组