抽象的
背景
广泛认为机械或噻吩晶型刺激,例如通过通过动物,风,雨滴和洪水,广泛影响植物生长和发育模式来摩擦和弯曲。特别是,已知风力驱动的机械刺激诱导径向膨胀和较短和薄荷雕像的发生率。风刺激也影响了根系在各种植物物种中的自适应传播。然而,植物如何感觉和传递风力衍生的机械信号是未知的,以发动适当的反应,导致风自适应根系生长。
结果
这里,我们发现了Broachypodium distachyon.,一种广泛用于研究生物能量作物和谷物的模型草,通过从非滴组织形成不定根(ARS),有效地适应风介导的住宿压力。风刺激的实验解剖表明,没有叶片的弯曲,但具有土壤颗粒的叶子节点的物理接触触发了编码WUSCHEL相关的Homeobox和横向器官界限域转录因子的一组潜在的疾病响应基因的转录诱导,这可能是可能的参与诱导ar形成。
结论
我们的调查结果将有助于进一步了解有关ars的启动和发展的分子机制,这将适用于极端风中的作物农业。
背景
在整个生命周期中,植物不断挑战周围环境的变化。它长期以来一直被农业育种者和植物科学家所感知的机械刺激,例如通过通过动物,昆虫攻击,雨滴,风和洪水,深刻影响植物生长和形态发生的机械刺激。这种神经骨形成过程被认为是一种适应策略,便于植物应对机械障碍,因此对于农业实践很重要[1].众所周知,植物生长激素,包括生长素和乙烯,介导了thigmomphogenic反应[2那3.那4.].
风引起的机械应力是植物中的代表性Thigmo刺激。在改变自然条件下,风往往会导致茎和叶片的令人遗憾的叶子,导致谷物作物的显着产量丧失[5.].植物已经进化了多功能的自适应策略来管理这些机械风力。风响应形态变化使植物通过增加植物机械强度并最小化风力的扰动力来避免植物破裂和拔除。6.].
风介导的机械干扰的一个常见后果是植物倒伏,即茎或根从其适当的垂直位置错位。许多研究已经探索了植物抗倒伏的形态特征[7.那8.那9.].而细长的茎使水稻更容易受到倒伏压力的影响[10.,更短的茎被认为有助于提高大麦的谷物产量[8.].茎直径和细胞壁厚度对抗倒伏能力也有很大影响。已有研究表明,茎秆厚度与抗倒伏能力呈正相关[11.].另一方面,茎秆直径的增加降低了大麦和燕麦的抗倒伏能力[12.].还有许多额外的形态发生性状,可以在诱导谷物中的宽容耐受性方面发挥作用。值得注意的是,植物住宿响应的模式取决于不同植物物种中的寄生刺激的强度和时间[13.那14.].
倒伏胁迫下的形态改变与木质素、纤维素和糖等生化特性的变化密切相关。纤维素和木质素含量的增加提高了茎壁厚度和柔韧性。因此,倒伏过程中诱导木质素生物合成相关基因[15.].它也被称为较高淀粉含量的帮助植物抵抗恢复风致倒伏刺激正常生长[7.].
风力驱动的植物对加入刺激的反应还包括对根系系统的重新排列和根系生长图案的重组。众所周知,在植物适应风刺激期间加强根/芽比,加强根锚固系统[16.].综上所述,地面风介导的机械力对根系的生长和构型有着深刻的影响。然而,目前还没有在分子水平上研究根系的风驱动的形态形成响应,这主要是因为根系受到广泛的地上部和土壤条件网络的影响[17.].
近年来的研究为阐明根系形态发生的分子机制提供了宝贵的线索。不定根(ARs)是由非根组织形成的,不仅是正常发育的一部分,也是应对环境胁迫的一种适应策略[18.].在粮食作物中,人工鱼礁是植物适应不良应激状态下,如洪水,干旱和土埋重要。近年来,先后有了解的AR中形成的分子机制有了很大的进步拟南芥.已经表明,AR形成不仅是从自行细胞或来自各种细胞类型开始的[19.].此外,已知各种植物生长激素与不同模型物种中的发育和外部刺激结合形成的各种步骤[19.].虽然植物蛋白是AR形成的主要播放器,但它也与其他生长激素相互作用,例如乙烯,芸苔类固醇,甘油酸(GA),脱落酸(ABA),细胞酸钠和茉莉酸(JA),通过枢纽信号串扰[19.].
在水稻中,在正常发展期间和压力刺激下的AR开发是在[20.].众所周知,AR形成由横向器官Boudaries结构域(LBD),偶然roolless1(ARL1)和Wusche相关的Homeobox11(Wox11111)转录因子进行介导[21.那22.].因此,ARL1缺陷的水稻突变体无法形成ARS [21.].这ARL1基因对生长素和乙烯信号敏感,主要在横向根和ari原序,分蘖原基和血管组织中表达。同时,WOX11在AR开发期间在胞内素和养蛋白信号传导途径中起作用[22.].它参与AR的产生和生长,协调刺激细胞分裂的生长素和细胞分裂素信号级联。然而,目前尚不清楚生长素介导的AR形成是否与风诱导的根瘤形成反应有关。
在本研究中,我们系统地研究了如何Broachypodium distachyon.,近年来被广泛应用的单子叶植物模型,适应风介导的倒伏胁迫。人们发现在恒定的风的作用下,犁囊从叶节点,其加强针对茎和根倒伏应力植物的雕像开发拍摄出生的敷设。有趣的是,与土壤颗粒的叶节点的直接接触,所述的中胚轴的未弯曲本身,是主要的刺激提示诱导AR通过WOX-和LBD介导的植物生长素信号转导通路的形成。我们的研究结果表明,thigmomorphogenic AR形成的风致的刺激是倒伏宽容和快速恢复的扁平化在增强,从干必不可少毛花瓣也许还有相关的草类物种。
结果
毛花瓣通过形成ARs来适应风致倒伏胁迫
在前人研究的基础上,我们假设生长素介导的AR形成与风诱导的根系形态形成适应有关毛花瓣.
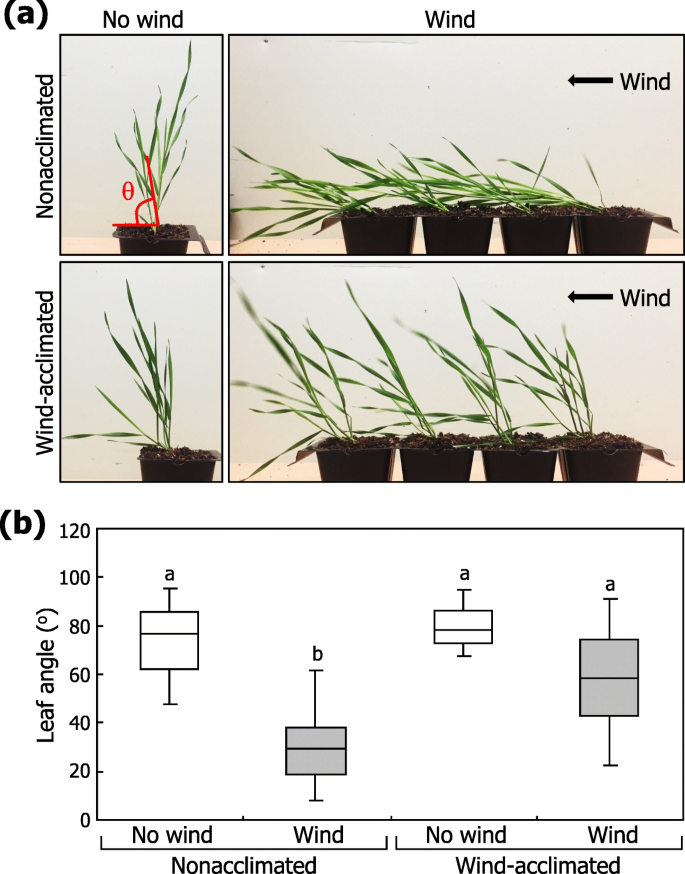
我们首先检查了植物反应对风介导的机械刺激。虽然非循环的植物响应风流动表现出茎坡,但是风适应的植物表现出枝条的相对减少的弯曲(图。1一个;附加文件1:图S1)。通过测量相对于水平面的分蘖角来定量检测风阻,发现非驯化植物的分蘖角约为30度,而风驯化植物的分蘖角大于60度(图1)。1b)。这些观察结果表明毛花瓣是能够适应风介导的倒伏的应力。
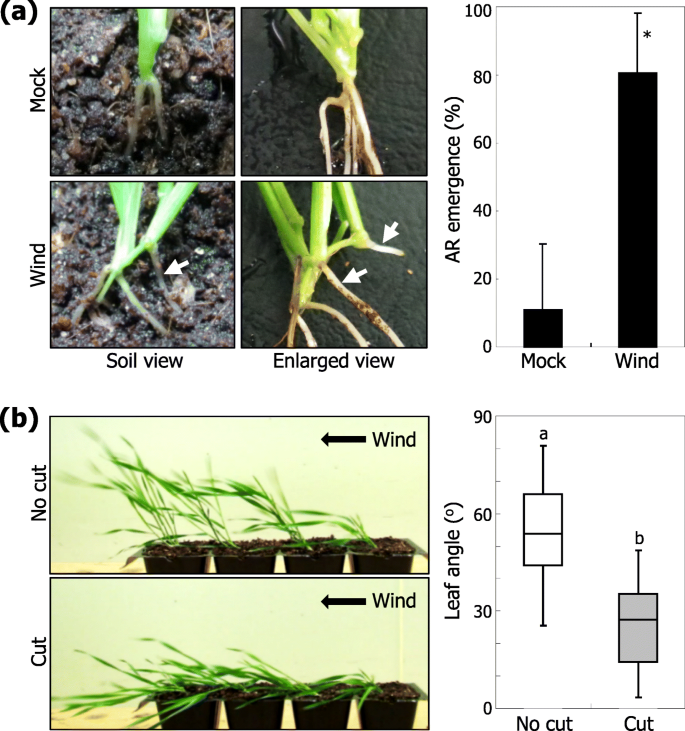
接下来我们研究了伴随风驯化的生长和形态变化。在我们的试验条件下,植物的整体形态和植物空中部分的生长模式没有明显地受到风处理的影响(图。1).有趣的是,我们发现在风处理植株中,更多的ARs来自分蘖的叶节。2a),提出了AR形成与耐倒伏表型有关的可能性。为了检验这种可能性,我们人工移除了风适应植物的ARs,并进行了另一轮风处理。保留ar的植株抗倒伏能力显著降低,而去除ar的植株抗倒伏能力显著降低。2b)。总之,这些观察结果有力地支持了人工鱼礁的风致形成功能上与倒伏耐受性相关的概念。
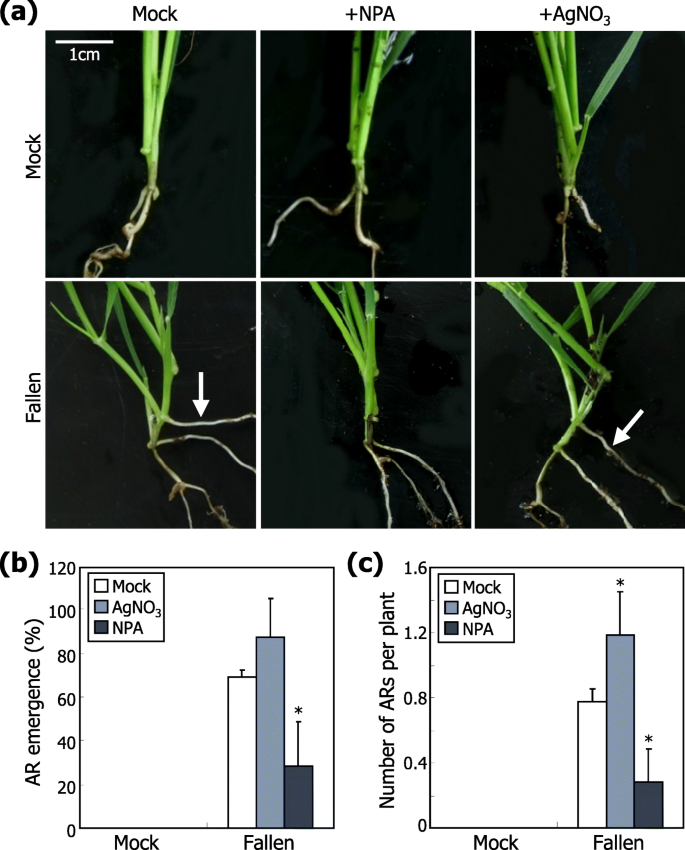
风刺激诱导ar形成。在分析AR出苗之前,将三个周龄植物暴露于单向风流量或在模拟条件下(无风)生长10天。一种AR出现。形成在土壤中生长的植物和它们的放大视图的AR被显示(左照片)。白色箭头表示ars。形成在分蘖叶节点根计为敷设。统计分析了三个独立的实验,每个由16株植物组成(T.-测试, *P. < 0.01) (right graph). Error bars indicate standard error of the mean (SE).B.有或没有ARS的植物的风响应。单向风力处理植物的可见AR被保留(没有切割)或切出,并且植物暴露于风刺激(左照片)。提交耕作的角度在统计上分析(右图,n =20)。不同的字母代表显著的差异(P.< 0.01),由Tukey的HSD测试确定
在风的推动下,炮弹落下,触发AR的形成
风对植物的一个明显影响是植物空中部分的物理下降。同时,风有可能引起空气湿度和植物体温的变化,间接影响茎秆倒伏。我们首先测试了空气湿度是否受风处理的影响。我们发现,在我们的检测条件下,风降低了大约10%的空气相对湿度(附加文件2:图。S2A)。另一方面,在相同的测定条件下,土壤的水状况并不明显地改变(附加文件2:图开通)。植物叶片的水分含量也不受风处理的影响(附加文件2:图。S2C)。此外,空气和植物体的温度没有受风处理的影响(附加档案3.图S3a, b)。这些观察表明,我们的检测系统适合于分析风对诱导AR形成的影响。
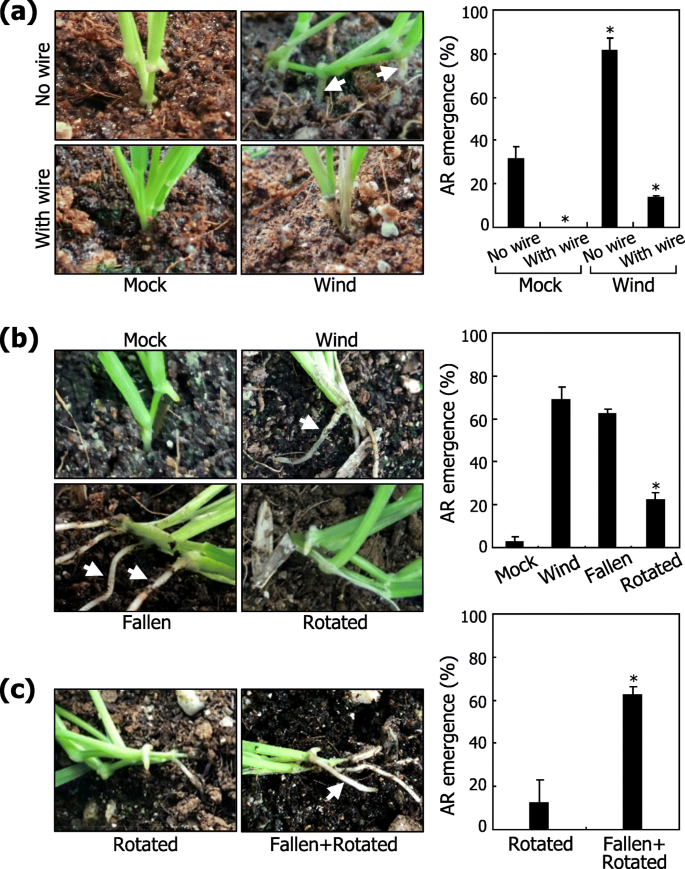
风是一种复杂的环境因素,可以解剖到几个更简单的组件(附加文件4.:图。S4)。一个关键的问题是风的哪个组成部分是AR形成对风刺激的主要决定因素。在风治疗之前,毛花瓣植物配备有支撑线,使得即使在风条件下也不会下降(附加文件5.:图。S5A)。值得注意的是,配备有支撑线的植物表现出显着降低的ARS出苗(图。3.a),说明风致芽的机械坠落在功能上与诱导AR出苗有关。
风力驱动下降对AR形成的影响。在各种实验条件下,在土壤中生长的三周龄植物在土壤中进一步增长10天。统计分析了三个独立的实验,每个由16株植物组成(T.-测试, *P.< 0.01)。误差条表示SE。白色箭头表示ars。一种风诱导的住宿诱导AR形成。植物暴露于有或不带支撑线的风流,保护植物免于下降。在风处理之后,拍摄代表植物(左照片),并且统计分析AR出苗(右图)。B.机械和重力刺激的影响。植物使用电线人为地下降(倒下)。植物也在75的斜坡上生长O.施加重力刺激(旋转)处理后拍照(左图),统计AR出苗情况(右图)。C结合刺激落下和重力的效果。植物人为下降,然后旋转75O.施加组合刺激。代表植物被拍摄(左照片),并且统计分析了AR ar AR reatence(右图)
中胚轴的物理弯曲,这是相对灵活的(附加文件5.:图。S5B),水平地定位叶子节点,在这些植物器官中旋转90度的重力方向。已知重生刺激诱导侧向根出来拟南芥[23.].为了检查重力对AR形成的影响,在土壤中生长的植物使用逮捕线或水平旋转并进一步生长10天(附加文件5.:图。S5C,D)。人工下降的植物表现出高频率的AR出苗,类似于在风力处理的植物中观察到的内容(图。3.b).与风处理和人工倒伏植物相比,旋转植株AR的出现频率明显降低。跌倒和旋转处理的联合刺激恢复了AR的出现频率,与在风处理植物中观察到的频率相当(图)。3.c;附加文件5.:图。S5E)。在一起,这些观察结果表明,落下芽,而不是重子刺激,在AR形成的诱导中起主要作用。
值得注意的是,在通过人工下降和重力刺激的植物中,ARS主要来自叶节点的土壤接触侧(图。3.c),表明不具有中骨髓的物理弯曲,而是与土壤颗粒的叶子节点的直接接触是AR形成的主要决定因素。
叶节与土壤颗粒的直接接触诱发了AR的形成
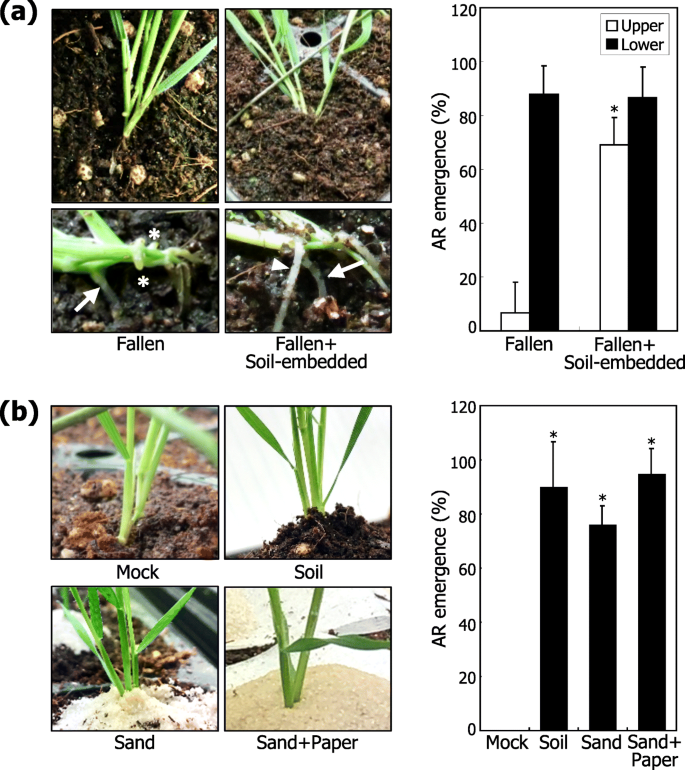
为了验证叶节与土壤颗粒直接接触是诱发AR形成的前提假设,人工将植株倒伏,叶节部分完全嵌入土壤中。令人惊讶的是,嵌入土壤的叶节在上下两侧都产生多个ARs,而不像风驱动的落叶植物,主要在叶节与土壤接触的下侧产生ARs(图2)。4.一种)。
物理土壤接触诱导ar形成。三个独立的实验,每个由16株植物组成,使用学生进行统计分析T.-测试 (*P.< 0.01)。误差条表示SE。一种土壤接触刺激AR形成。植物人为地下降,如图2所述。3.湾然后将落叶植物的叶子节点嵌入土壤中10天。代表植物被拍摄(左照片)。箭头和箭头分别表示在落耕机的下侧和上侧形成的AR。星号标记AR Primordia。出现统计分析(右图)。B.砂驱动机械触控诱导AR形成。叶子节点被土壤或砂堆叠(左照片)覆盖。为了使沙湿度最大限度地减少土壤和砂堆(砂+纸)之间的麦克拉饭。出现统计分析(右图)
接下来,去除叶子节点下面的土壤,使得这些植物器官在风处理期间与土壤颗粒直接接触(附加文件6.:图。S6A)。值得注意的是,AR出苗的频率与在正常条件下种植的植物中观察到的频率相当(附加文件6.:图。S6B)。因此,显而易见的是,叶节点与土壤颗粒中的叶片节点的直接接触,而不是中象素本身的物理弯曲对于诱导AR形成至关重要。
天然土壤除了水外,还含有各种营养物质。有报道称,土壤养分影响叶节AR的出现和伸长毛花瓣[24.].此外,涝渍是一种众所周知的胁迫,会导致谷物作物出现AR [25.那26.那27.].为了检查土壤营养素或水是否会影响叶节点的AR形成,第一片节点被土壤覆盖,但没有弯曲的胚轴(附加文件)7.:图S7a)。从我们的数据推断,对于AR的形成,叶片节点与土壤颗粒直接接触的必要性,土壤覆盖植物在叶片节点周围形成了AR(图。4.b),进一步支持与土壤颗粒的物理接触的观念足以诱导来自叶节点的AR的诱导。
堆叠纯砂颗粒,这将消除或大大减少土壤营养物质的影响,叶节点周围仍然引发了与叶子节点的诱导与在土壤覆盖的植物中观察到的叶片节点(图。4.b)。同时,我们在砂堆叠和土层之间放了两层miracloth,以摆脱从土壤层到砂堆叠的大部分水流(附加文件7.:图。S7B;附加文件8.中:图S8)。再次,AR出现的频率为与那些在覆盖有土壤层或砂堆(图植物中观察到。4.b).综上所述,这些观察结果明确表明,叶节与土壤颗粒的物理接触,而不是土壤养分或渍水,引起AR的出现。
植金蛋白介导风中介导的机械刺激刺激
生长素是调节根形态发生的关键生长激素之一[28.那29.那30.].乙烯是已知的另一种生长激素,它在应激条件下诱导AR出现中发挥作用,正如在洪水地区被淹没的植物中观察到的[25.那26.].我们的观察表明,ARs主要在与土壤颗粒直接接触的叶节处形成。
为了通过与土壤颗粒直接接触地触发机械刺激的洞察力触发AR出苗的诱导,我们采用了特异性改变了植物素或乙烯功能的化学品。用植物素转运抑制剂治疗植物芽,N-1-萘氨基苯氨酸(NPA),或乙烯感知抑制剂,Agno3.[31.那32.].然后使用逮捕线在人工上倒下抑制剂处理的植物。发现NPA的应用显着降低了AR出苗的频率,而AgNO3的施用略微增加Ars的发生率(图。5.).我们验证了1μMNPA的外源性施加足以使用该抑制毒素运输毛花瓣DII-VENUS记者植物(附加文件9.:图S9)。此外,对倒下的植物施用外源IAA促进了AR的形成(补充文件10.:图。S10)。同时,外源性施加1毫米或更高浓度的Agno3.略微增加AR出现(附加文件11.:图。S11),类似于由外源应用的1μmAgno观察到的3..这些观察表明,生长素在调节的AR形成机械性刺激起主要作用毛花瓣.
Brachypodium WOX和的小黑裙基因是毒素响应
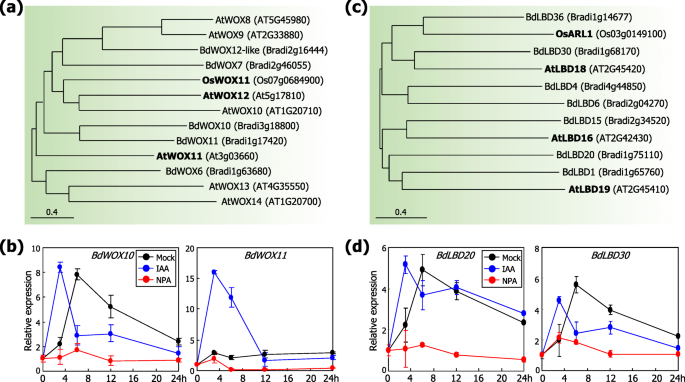
在拟南芥虽然在正常生长和发育条件下形成ar形成,但植物特异性的WOX转录因子,例如ATWOX11和ATWOX12,is功能是有机组织期间AR发育的关键调节因子[33.].同样地,WOX成员的稻米同源物OSWox11在皇冠根的启动和发展中起作用[22.].
系统发育分析表明,存在一组潜在的WOX蛋白毛花瓣基因组(图。6.a).氨基酸序列分析显示多重毛花瓣WOX蛋白和那些鉴定的蛋白质拟南芥而AtWOX11、AtWOX12、OsWOX11等水稻则属于一个普通集群。基于生长素是风致AR形成的关键调控因子这一概念毛花瓣,我们检查了是否BdWOX基因对养肝剂反应。用吲哚-3-乙酸(IAA)或NPA溶液喷洒植物,随后人工下降。为基因表达测定收获第一叶节点及其间区别。发现转录bdwox10和bdwox11.在胃辘尿素施用后的早期时间点,但通过NPA急剧抑制基础水平,通过外源性养蛋白施用诱导基因超过10倍。(图。6.b)。
养阴介导的刺激WOX.和的小黑裙人工下落植物中的基因表达。使用Mega7软件的邻接方法产生系统发育树(https://www.megasoftware.net)(A,B).在系统发育分析中,在功能表征的蛋白质构件以粗体标记。对于基因表达分析,用0.1mm IAA或1μMNPA溶液喷洒土壤中生长的三周大的植物,然后人工下降到土壤表面(c, d).在指定的时间点收获第一个叶节及其节间,提取总RNA样本。RT-qPCR检测转录水平。对15株植物的生物3个重复进行统计分析。误差条表示SE。一种系统发育分析毛花瓣WOX蛋白质。B.生长素和NPA对植物转录的影响Brachypodium WOX基因。C系统发育分析毛花瓣小黑裙的蛋白质。D.生长素和NPA对植物转录的影响的小黑裙基因
ARL1是LBD转录因子的水稻同源物[21.].已经表明缺乏水稻突变体ARL1基因无法诱导ar形成[21.].也有报道说拟南芥LBD成员,如ATLBD16,ATLBD18和ATLBD19,在侧面的形成中起关键作用[34.那35.].系统发育分析显示,多个BdLBD蛋白,特别是BdLBD20和BdLBD30,与atlbd和OsARL1同源(图。6.C)。基因表达测定显示转录BdLBD20和BdLBD30由外源性毒素施用显着诱导基因,但是由NPA抑制(图。6.d),类似于植物素和NPA对的影响BdWOX基因的表达。这些观察表明BdWOX和BdLBD蛋白参与了生长素信号通路在诱导AR形成过程中的作用毛花瓣.
WOX.和的小黑裙基因通过风介导的机械性刺激诱发
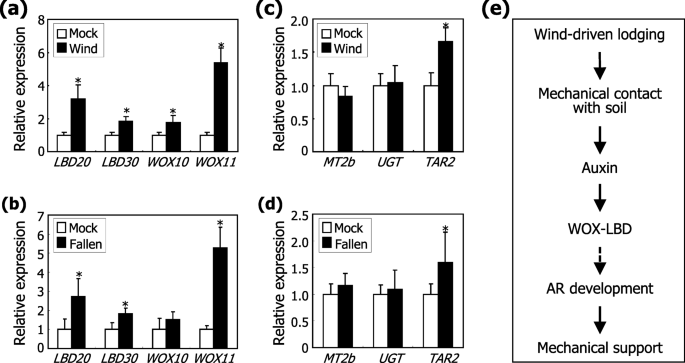
最后一个问题是BdWOX和BdLBD蛋白是否与风致AR形成的机械刺激有关毛花瓣.我们检查了是否表达了BdWOX和BdLBD基因会因风和机械刺激而改变。基因表达分析表明,在生长素处理6 h后,其转录的生长素响应性达到峰值(图。6.).因此,在风或机械处理后6小时收获植物材料。从概念预期的那样WOX.和的小黑裙基因参与水稻和横向根部发育或ar形成拟南芥[21.那22.那33.那34.那35.,的抄写BdWOX和BdLBD风处理和人工倒地均能显著诱导基因的表达。7.a,b)。在土壤覆盖的叶节点中也观察到基因诱导(附加文件12.:图。S12),支持BDWOX和BDLBD转录因子可能涉及脉冲介导的AR形成的机械刺激毛花瓣.
感应的WOX.和的小黑裙基因介导的机械刺激。通过风和人工下降刺激后,将第一叶节点及其节点收获用于总RNA提取,并通过RT-QPCR分析转录水平。统计分析了由15株组成的生物三倍体,每个植物组成(T.-测试, *P.< 0.01)。误差条表示SE。A,B转录WOX.和的小黑裙基因。在土壤中生长了三周的植物暴露在持续的风中(一种)或人工倒下(B.)6小时。c, d乙烯反应基因的转录。用风(C)或跌倒(D.), 6 h。E.风诱导的住院胁迫条件下的植物蛋白介导的AR形成的示意图。响应风流量,植物落下,在叶节点上施加机械刺激。机械刺激会诱导依赖于毒素的表达WOX.和的小黑裙基因。我们认为,WOX/ lbd介导的生长素信号触发了ARs的启动和发育,从而导致植物对倒伏胁迫的适应
编码UDP-糖基转移酶76C2样(UGT76-4)和色氨酸氨基转移酶相关蛋白2样(Tar2)的基因已被鉴定为乙烯反应标志物毛花瓣[36.].金属硫onein2b (MT2b)是一种有效的活性氧(ROS)清除剂,在AR出现期间诱导细胞死亡[19.].基因表达测定揭示了转录BdUGT76-4和BdMT2b基因对风处理或人工落在叶节点的下降(图。7.c, d).此外,生长素和NPA处理对基因的转录没有明显的影响(附加文件13.:图。S13)。总的来说,明显是通过调节表达式的AR形成的机械刺激在机械刺激中起主要作用BdWOX和BdLBD这与生长素抑制剂对AR形成的影响相一致。5.).相反,乙烯似乎在这种形态形成过程中没有直接作用。
同时,转录BDTAR2.基因在风处理和人工下降植物(图轻微诱导。7.c, d).预计TAR2参与了在风条件下根构型的重编程过程毛花瓣,正如已建议的那样拟南芥[37.].
总之,我们的发现说明了一个独特的生长素信号通路,介导风诱导的机械刺激AR的形成毛花瓣(无花果。7.e).在极端风况下,植物倒下,导致叶节与土壤颗粒直接接触。叶节的物理接触诱导生长素介导的表达BdWOX和BdLBD基因可能导致诱导ar出苗。我们提出,ARIN介导的AR开发的机械刺激是一种适应性策略,通过该策略,植物在极端风区域维持其正常的生长和生产率。
讨论
AR作为风致机械应力下的适应性发育装置
ARS从初级和横向根部显成,它们主要来自来自非热组织,例如根射线连接和茎节点。它们在草地和谷物作物中突出正常发育过程和应力响应途径[18.].不仅是ARS的经济和生态价值,而且在过去的几十年中也显而易见。经济上,切割的AR部件能够生产新的个人,从而常用于园艺行业。此外,ARS在改变环境下的工厂自适应过程中发挥着关键作用,强调了他们在农业产业中的经济价值。
众所周知,ARs帮助植物在某些非生物和生物胁迫条件下生存,如洪水和营养缺乏,这是自然界经常遇到的[38.那39.最广泛的研究是农业和自然生态系统中植物的淹没,通常伴随着植物的缺氧。米饭是一个半决植物,在洪水洪水时容易产生ARS,并在洪水中刺激刺激的分子信号传导事件已经深入研究[25.那26.那27.].淹没诱导乙烯生物合成,气态生长激素被水屏障捕获。累积的乙烯触发活性氧的产生,活性氧与乙烯一起触发表皮程序性细胞死亡,诱导AR的出现[19.].
ARs的起始和发育差别很大,这取决于养分类型、胁迫和根系类型。例如,当暴露于局部高浓度硝酸盐时,来自于冠根中柱环细胞的侧根密度增加,而来自种子根的侧根在玉米中类似的营养条件下则不受影响[39.那40.].众所周知,在不同土壤深度中形成的各种根类型具有营养上升的差异效率,因为营养素经常与土壤层的关系不均匀地分布。一个典型的例子是磷的吸收,主要在土壤表面层中可用。因此,虽然表面根数增加增加对磷缺乏的耐受性,但深层根深蒂固只应对缺乏磷的土壤[41.].这些现象凸显AR出现的多样化的营养缺乏条件下的复杂调控。
胚胎根部形成的激素调节
AR器官发生是通过各种激素信号网络的协调相互作用来调节的。一般来说,生长素在胚后根形成过程中起主要作用[29.].在拟南芥,已证实生长素控制侧根的形成[29.那42.].通过调节生长素响应转录因子和销形成(PIN)毒素转运仪的吞吐素响应转录因子以及侧重根的启动和伸长伸长,植金蛋白在整个启动和伸长率下发挥重要作用30.].在米饭中,证明通过销传输器流动流动对AR出苗的诱导至关重要43.].
其他生长激素,如胞内素,胞嘧啶,芸苔类化合物,JA,ABA和GA也参与AR形成的诱导[44.].例如,植物生长素信号激活的基因的编码格雷哈根表达式3样蛋白,其在AR形成维持JA稳态[45.].已知细胞分裂素和生长素在调节AR形成中起拮抗作用[46.].同时,ABA在AR出苗和伸长率的过程中抑制GA和乙烯信号传导[25.].
在这项研究中,我们证明了这一点毛花瓣有效地适应风力应力,其中抗芽的风引起的掉落通过WOX / LBD介导的养蛋白信号传导途径促进AR形成。系统发育分析,基因表达研究和机械刺激的转录响应鉴定了一种子集Brachypodium WOX/的小黑裙可能参与生长素介导的机械应激适应的基因。这些基因主要在形成ARs的叶节点中表达。它们的基因转录是在暴露于风和机械落节的情况下诱导的。有趣的是。最近的研究表明,茉莉酸与生长素相互作用,调控逆境条件下AR的形成拟南芥[47.].基于JA在触摸响应中的作用[48.,有可能ja -生长素信号串扰也参与了AR的形成毛花瓣.
有人发现诱导WOX./的小黑裙基因未发生在NPA处理的植物中,表明植物素转运对于WOX / LBD介导的机械适应方法很重要。目前尚不清楚机械刺激在分子水平上与毒素信号传导有何相关联。疾病传输和生物合成既可能也有可能涉及风诱导的机械应力响应。由于具有NPA的扩展治疗可以引发其他发育过程,例如冠根,侧根和原源根生长,因此内源性毒素含量的直接测量将有助于阐明其在触摸诱导的AR形成期间的作用。蟾蜍蛋白生物合成酶和风/机械刺激栓蛋白的功能鉴定以及机械应力条件下内源性毒素含量的直接测量有助于阐明潜在的分子和生物化学机制。
这TAR2乙烯反应标记基因[36.],被风暴露略微诱导。同时,NPA治疗降低了其转录,而养肝蛋白对基因转录没有任何影响。这拟南芥tar2基因编码色氨酸转氨酶,介导生长素生物合成响应乙烯信号[49.].据报道了拟南芥tar2基因是低氮胁迫条件下侧根出现所必需的[37.].可以预见,TAR2介导的信号乙烯不玩风致thigmomorphogenic适应过程有直接作用,而是影响间接影响生长素生物合成的AR形成。
根据乙烯反应标记UGT76-4和TAR2似乎有限的作用,用乙烯感知抑制剂检测表明,风诱导的AR形成不明显受乙烯信号传导的影响。用乙烯感知抑制剂AgNO处理3.只是略微诱导AR出现。然而,化学治疗不表现出对AR出现发病任何剂量的影响。因此,据推测,硝酸银的边际效应3.在Ar形成可能是由化学物质发生期间化学物质发生的副作用引起的[50.].然而,乙烯仍然可能在通过患有植物蛋白的尚未识别的信号串扰中的ThigmomorphogenicAR形成中起一定的作用。进一步使用毛花瓣具有生长素和乙烯生物合成或信号传导和基因组范围的基因表达研究的缺陷将是很大的突变体有助于探索的可能性。
风介导的机械刺激诱发AR的发展
水稻对AR形成的机械刺激已被证实[51.].乙烯通过抑制活性氧清除剂MT2b的功能促进活性氧的积累。内外机械压力同时促进表皮细胞死亡,促进ARs的发生。这两个相互协作的信号为水稻非根组织AR的形成提供了精细的时空信息。
我们的研究结果表明,风介导的摔倒并不会影响Broachypodium mt2b.基因,表明风介导的热晶体发生毛花瓣有些不同于水稻中的r型ros介导的机械刺激。关键问题是能够感知机械信号的细胞受体或感觉分子。一种这样的潜在候选者是细胞溶质CA2+离子,在所有生物体中普遍存在的保守信号成分[52.那53.].已经观察到,在机械扰动之后,胞质钙迅速增加2+以剂量依赖性的方式烟草plumbaginifolia[54.].这拟南芥水稻基因组拥有十和五个机械敏感的CA2+离子通道,分别支持Ca的参与2+作为机械适应过程中的传感分子或第二信使的离子[55.].有趣的是,已知Ca2+-EmereMETERMEREMON敏感的通道1(MCA1)MEDIATES CA2+对培养基上琼脂硬度的响应拟南芥[56].综上所述,表观形态发生反应是应对机械干扰环境胁迫的关键适应过程,其信号机制和分子机制有待进一步研究。
风对植物生态系统和作物生产力的危害日益受到人们的关注,因此进一步了解风对植物形态发生适应的分子机制是当前研究的重要课题。在这种情况下,我们的研究结果将有助于进一步阐明介导AR发育的分子信号级联,这些级联易于应用于机械抗作物的开发。
结论
在这里,我们演示一下Broachypodium distachyon.,一种广泛用于生物能量作物和谷物研究的模型草,通过促进信号传导诱导AR形成有效地适应风力驱动的机械应力。我们发现没有弯曲的鞘内石斛本身,但它们与土壤颗粒的直接接触触发了编码WOX和LBD蛋白的一组疾病响应基因的转录诱导,这可能与AR形成相关。
方法
植物材料和生长条件
Broachypodium distachyon.来自John P.Vogel博士获得的社区标准二倍体近交系的生态型BD21-3,并在所有实验中使用。这Brachypodium proZmUbi: DII-VENUS从Devin Lee O'Connor获得转基因种子。毛花瓣植物与长日照条件(16小时光照/ 8小时黑暗)下的60%相对湿度的受控生长室中生长。Growth conditions were set at 23 °C with white light illumination provided by FLR40D/A fluorescent tubes (150 μmol photons/m2S,欧司朗,首尔,韩国)。
风治疗
用于产生风力的电子风扇(EF-73HK,Hanil),使用风速计(ST-112,韩国)测量风流的速度。对于风适应分析,在土壤中生长的三周大植物首先暴露于恒定的单向风流量(2.8米/秒)10天。在预处理期间,使用相对低的风速诱导风速加速过程。然后将风向植物进行风流量并拍照。通过测量相对于土壤表面的成因分蘖角来分析风敏感性。除非另有提及,否则所有实验均重复三次统计分析。
使用USB数据记录器(SL170, SELCO,丹麦)测量空气的温度和湿度。使用土壤水分计(0101HHEHAY, HUIXUAN, China)测定土壤水分状态。使用红外相机(T420, FLIR, USA)记录植物的热图像,并使用FLIR软件(http://www.flirkorea.com/home/).
为了研究AR在抗倒伏方面的作用,我们将生长在土壤中3周大的植物暴露在恒定的单向风下10天。对含有ARs的植物进行鉴定,人工去除可见的ARs。将ar去除或保留的植株置于气流中,测量分蘖角。
下落和重力
为了检查落下Ar形成诱导的影响,在土壤中生长的三周大的植物通过使用逮捕线弯曲在小吃节点下方的中间骨髓下方的叶片,使得叶节点直接触及土壤颗粒。巧妙地配备逮捕导线不触及叶子节点零件,这可能会引发触摸诱导的触发致致血管内反应。落下处理后十天,测量了AR出苗的频率,其中计算了长度超过5mm的ars。除非另有提及,否则所有实验均重复三次统计分析。
在妊娠刺激试验中,将植株旋转75度并进一步生长10天。为了保持茎和叶节的水平位置,植物配备了支持电线。为了测定垂直定位植株的倒伏效应,将人工倒伏植株旋转至茎和叶节的垂直位置。允许叶节点的一侧与土壤颗粒直接接触。在测量AR出苗率之前,这些植株再生长10天。
机械接触
为了研究机械触摸对诱导AR出苗的影响,将3周龄植株的第1节完全覆盖在土壤或沙土层。此外,在沙堆和接地土层之间放置了两层miracloth (Merck, Germany),以保持沙堆处于半干燥状态。为了研究在不接触土壤的情况下摔倒的影响,将植物摔倒,并小心地将叶节下的土壤移走,使土壤颗粒不接触叶节。植株生长10天,然后测量AR的出苗率。
测量水含量
在土壤中生长3周的植物暴露在风中10天。新鲜的叶子被收获并称重,然后在65°C干燥2天。称量干燥后的叶片,含水量按以下公式计算:含水量(%)=(鲜重-干重)/鲜重× 100。除非另有提及,否则所有实验均重复三次统计分析。
化学处理
促进型转运抑制剂NPA(Sigma,USA),乙烯感知抑制剂Agno3.(Sigma,美国)和生长素IAA (Sigma,美国)溶液在吐温20 (Amresco,美国)制备。NPA (1 μM in 0.05% (v/v) aqueous Tween 20), AgNO3.(1μM或100μM在0.5% (v / v)水渐变20)解决方案,IAA(10μM或10μM在0.5% (v / v)水渐变20)或0.5% (v / v)水渐变20就一天喷一次10天到3个植物生长在土壤上,每个喷雾使用约1毫升/工厂。在第一次喷洒后,植物被人工倒下,并进一步生长10天,然后进行分析。除非另有提及,否则所有实验均重复三次统计分析。
验证NPA对植物生长素积累的影响毛花瓣,Brachypodium proZmUbi: DII-VENUS转基因植物已成功用于监测该植物物种中的养猪分布[57]分析。记者植物下降并进一步生长2天以诱导ar形成。将1μMNPA的溶液喷涂在倒塌的植物上并孵育6小时。使用剃刀刀片收获和切割形成ar基金的节点。将切片的节点放置在滑动玻璃上,并使用Olympus BX53显微镜进行荧光成像。使用以下激光和滤波器设置:奥林巴斯U-HGLGPS激光器,励磁488nm,498至544nm,用于检测金星信号。放大值设置为4.在相同的微观设置下使用LSM710激光扫描共聚焦显微镜(Zeiss,德国)也获得了共焦图像。
对于基因表达测定,将NPA(0.05%(v / v)吐温20)或Iaa(0.5%(v / v)水吐温吐温为0.5%(v / v)水溶液)溶液中的NPA(0.5μm)溶液喷洒到三周的植物中,随后下降。在用于提取总RNA样品的化学处理后,在0,3,6,12和24小时内收获第一叶节点及其间度。
系统发育分析
WOX蛋白的氨基酸序列毛花瓣(BdWOX6, BdWOX7, BdWOX10, BdWOX11, BdWOX12-like),拟南芥(ATWOX8,ATWOX9,ATWOX10,ATWOX11,ATWOX12,ATWOX13和ATWOX14)和稻米(OSWOX11)获取NCBI数据库(https://www.ncbi.nlm.nih.gov/pubmed).来自的LBD蛋白的氨基酸序列毛花瓣(BdLBD1、BdLBD4、BdLBD6、BdLBD15、BdLBD20、BdLBD30和BdLBD36),拟南芥(ATLBD16,ATLBD18和ATLBD19)和稻米(OSARL1)与NCBI类似地获得。使用邻近加入方法进行系统发育分析(Bootstrap方法,自举复制数:500,泊松模型,站点之间的费率:统一率,空隙/缺失数据处理:从Mega 7软件中完成删除)(完整删除)(https://www.megasoftware.net/).
基因转录分析
根据制造商的程序(Qiagen,美国),使用RNeasy plant Mini Kit从合适的植物材料中提取总RNA。采用逆转录介导的定量PCR (RT-qPCR)分析转录本水平。
All RT-qPCR reactions was performed in 96-well blocks with the 7500 Real-Time PCR System (Applied Biosystems, USA) using the KAPA SYBR Green master mix (Sigma, USA) in a reaction volume of 20 μl. The two-step thermal cycling profile employed was 15 s at 95 °C for denaturation and 1 min at 60-65 °C, depending on the calculated melting temperatures of PCR primers, for annealing and polymerization. TheBrachypodium UBC18基因(Bd4g00660)作为内对照纳入PCR反应,以规范使用的初级cdna数量的变化。PCR引物采用系统自带的Primer Express软件设计,列于附加文件中14.S1:表。
统计分析
使用多种生物学独立的样品进行所有实验和分析,并在每个实验中指定生物重复的数量。使用后HOC Tukey Test使用单向分析(ANOVA)的单向分析来确定统计显着性(P. < 0.01) or two-sided StudentT.以及与P.用于确定多于三个群体或成对比较的显着差异的值<0.01。
数据和材料的可用性
当前研究期间生成或分析的所有数据都包含在本发表的文章中及其补充信息文件中。在作品发布后,原始数据可以从相应的作者获得合理的请求。
缩写
- ar:
-
不定根
- 小黑裙:
-
外侧器官Boudaries域
- ARL1:
-
偶然rootless1.
- WOX11:
-
WUSCHE相关Homeobox11.
- NPA:
-
N-1-萘酞酸
- UGT76-4:
-
UDP-glycosyltransferase 76 c2
- tar2:
-
色氨酸氨基转移酶相关蛋白2
- MT2B:
-
Metallothionein2b
- ROS:
-
反应性氧气
- 别针:
-
PIN-FORMED
- JA:
-
茉莉酸
- 阿坝:
-
脱盐酸
- GA:
-
赤霉酸
- MCA1:
-
机械敏感频道
参考文献
- 1。
水稻倒伏胁迫的研究进展与展望。环境科学与技术;2017;24:5222-37。
- 2。
高桥,Jaffe MJ。形态发生:机械扰动与诱导子类活性和乙烯生产的关系。杂志。1984;61:405-11。
- 3。
纱丽吉,约旦WR,摩根PW。来自玉米的乙烯进化(Zea Mays.幼苗根系和芽对机械阻抗的响应。植物杂志。1991;96:1171-7。
- 4.
王志强,王志强,王志强,等。根系形态发生:植物对机械刺激的复杂反应。J Exp Bot. 2009; 60:43-56。
- 5。
宓C,张X,李S,杨洁,朱d,使用模糊综合评判玉米倒伏环境应力阳Y.评估。数学建模比较。2011; 54:1053年至1060年。
- 6.
Gardiner B,Berry P,Moulia B.风力影响植物生长,力学和损伤。植物SCI。2016; 245:94-118。
- 7.
Ishimaru K,Yano M,Aoki N,Ono K,Hirose T,Lin Sy,Monna L,Sasaki T,Ohsugi R.朝着米函数映射的生理和农艺性状的映射:QTL分析和QTL和表达序列的比较标签。Al Appl Genet。2001; 102:793-800。
- 8.
Tammü。欧洲麦芽大麦品种农艺特征的变化。Agron Res。2003; 1:99-103。
- 9.
姚杰布,马HX,张PP,任立力,杨XM,姚GC,张P,周MP。茎强度的遗传及其与小麦秆形态特征的相关性。可以j植物sci。2011; 91:1065-70。
- 10。
李家,张力,龚杰,张y,戴qg,霍泽,魏海。不同种植方法对超大米秆抗膨胀性的影响。科学科学罪。2011; 44:2234-43。
- 11.
直播水稻抗倒伏生理生态特性研究。作物学报1994;63:34-41。
- 12.
邓恩GJ,Briggs kg。植入抗性抗性大麦品种中秆解剖学的变异。可以j bot。1989; 67:1838-43。
- 13。
城市ST, Lieffers VJ, Macdonald SE。云杉树干和结构根径向生长释放量的年代学测定。Can J For Res. 1994; 24:1550-6。
- 14。
三种植物的阻力系数和植物形态对风速的响应:燃烧灌木(euonymus alatus.),科罗拉多蓝云杉(云杉pungens和喷泉草(Pennisetum setaceum.).地球物理学报(地球物理学报)2002;
- 15.
Ma QH,Xu Y,Lin Zb,HE P.从小麦中克隆cDNA,差异表达在植物敏感和蛋白质中的差异表达。J Exp Bot。2002; 53:2281-2。
- 16.
杜普拉茨,张志强,张志强,等。机械刺激对树木生物量分配的影响李属鸟结核树。Ann Bot。2008; 101:1421-32。
- 17.
Reubens B,Pannemans B,Danjon F,De Provent M,De Baets S,De Baerdemaeker J,Poesen J,Muys B.机械刺激对年轻集装箱的根和拍摄发展的影响Quercus栎树和洋槐pseudoacacia树。树木。2009;23:1213。
- 18.
陈志强,王志强,王志强,等。植物不定根的生理特性。植物杂志。2016;170:603-17。
- 19.
Lakehal A,Bellini C.控制不定根形成:洞察协同和拮抗荷尔蒙互动。physiol植物。2019; 165:90-100。
- 20。
Steffens B,Sauter M.水稻表皮细胞死亡被局限于具有不同分子标识的细胞,并由乙烯和H介导2O.2通过自动放大的信号通路。植物细胞。2009;21:184 - 96。
- 21。
刘虎,王某,yu x,yu j,他x,张某,shou h,wu p. arl1,一种稻米不定根形成所需的淋巴结域蛋白。工厂J. 2005; 43:47-56。
- 22.
赵颖,胡颖,戴敏,黄磊,周大东。这WUSCHEL- Hellated Homeobox基因WOX11需要激活稻米的射击冠冠开发。植物细胞。2009; 21:736-48。
- 23.
OttenschlägerI,沃尔夫P,沃尔弗顿C,Bhalerao RP,Sandberg的G,石川H,埃文斯男,小柱从帕尔梅K.重力调节差动生长素输送到侧根帽细胞。国家科学院院刊美A. 2003; 100:2987-91。
- 24.
Poirér,chochois v,sirault xr,vogel jp,watt m,furbank rt。数字成像方法,用于表型氮素和磷反应Broachypodium distachyon..J Intent Plant Biol。2014; 56:781-96。
- 25.
Steffens B,Wang J,Sauter M.乙烯,赤霉素和脱落酸之间的相互作用调节深水水稻中不定根的出现和生长速率。Planta。2006; 223:604-12。
- 26.
Vidoz Ml,Loreti E,Mensuali A,Alpi A,Perata P.洪水番茄植物中不定根形成期间的荷尔蒙相互作用。工厂J.2010; 63:551-62。
- 27。
陈志强,陈志强,陈志强,等。小麦不定根及其出苗过程中激素的调控。J Exp Bot. 2018; 69:4065-82。
- 28。
Sabatini S, Beis D, Wolkenfelt H, Murfett J, Guilfoyle T, Malamy J, Benfey P, Leyser O, Bechtold N, Weisbeek P,等。生长激素依赖的模式和极性的远端组织者拟南芥根。细胞。1999;99:463 - 72。
- 29。
卡西米罗I,Marchant的A,Bhalerao RP,Beeckman T,Dhooge S,Swarup R,格雷厄姆N,Inzéd,Sandberg的G,卡西奥PJ,等人。生长素运输促进拟南芥侧根起始。植物细胞。2001;13:843-52。
- 30.
Dubrosky Jg,Sauer M,弥敦亚州门维尔S,Ivanchenko Mg,Friml J,Shishkova S,Celenza J,BenkováE.Auxin充当局部形态发生触发器,以指定横向根创始人细胞。Pro Natl Acad Sci U S A. 2008; 105:8790-4。
- 31.
Thomson KS, Hertel R, Müller S, Tavares JE。1- n -萘基酞酸和2,3,5 -三碘苯甲酸。足底。1973;109:337-52。
- 32.
植物中乙烯作用的有效抑制剂。植物杂志。1976;58:268 - 71。
- 33。
刘军,盛丽,徐勇,李军,杨智,黄慧,徐丽。WOX11和12.在从头根器官中都参与了第一步骤的细胞命运过渡拟南芥.植物细胞。2014; 26:1081-93。
- 34。
ARF7和ARF19通过直接激活LBD/ASL基因调控侧根的形成拟南芥.植物细胞。2007; 19:118-30。
- 35。
李HW,金NY,李DJ,金J. LBD18 / ASL20调节组合侧根形成与LBD16 / ASL18 ARF7和ARF19的下游拟南芥.植物理性。2009; 151:1377-89。
- 36。
Kouzai Y, Kimura M, Yamanaka Y, Watanabe M, Matsui H, Yamamoto M, Ichinose Y, Toyoda K, Onda Y, Mochida K,等。植物防御相关激素水杨酸、茉莉酸和乙烯响应标记基因的表达谱分析Broachypodium distachyon..BMC Plant Biol. 2016;16:59。
- 37。
Ma W,Li J,Qu B,他X,Zhao X,Li B,Fu X,Tong Y.Auxin Biosynthetic基因TAR2涉及低氮介导的根系结构重新编程拟南芥.工厂J. 2014; 78:70-9。
- 38。
等足虫和昆虫根系蛀虫可能有益于佛罗里达的红树林。科学。1978;201:630-2。
- 39。
于平,李超,李春华。玉米根系对氮素利用率的响应。足底。2014;240:667 - 78。
- 40。
Yu P, Eggert K, von Wirén N, Li C, Hochholdinger F.基于RNA-Seq的细胞型特异性基因表达分析揭示了高硝酸盐通过调控生长素相关细胞周期而触发了玉米茎生根的侧根起始。植物杂志。2015;169:690 - 704。
- 41。
Bonser Am,Lynch J,Snapp S.磷缺乏对基底根生长角的影响菜豆.新植物。1996年; 132:281-8。
- 42。
De Smet I,Tetsumura T,De Rybel B,Frei Dit Frey N,Laplaze L,Casimiro I,Swarup R,Naudts M,Vanneste S,Audenaert D等人。基础重新分析中的侧根定位依赖性调节拟南芥.发展。2007; 134:681-90。
- 43。
徐敏,朱玲,寿辉,吴培安PIN1.家族的基因,OsPIN1,参与水稻生长素依赖的不定根出苗和分蘖。acta botanica yunica sinica(云南植物学报)2005;
- 44。
Jung JK,McCouch S.到了它的根源:根系结构的遗传和激素控制。前植物SCI。2013; 4:186。
- 45。
古铁雷兹,孟吉拉尔,Floková K, Pacurar DI, Novák O, Staswick P, Kowalczyk M, Pacurar M, Demailly H, Geiss G, et al.;生长素控制拟南芥通过调节茉莉酸稳态来偶然根起因。植物细胞。2012; 24:2515-27。
- 46.
Ramírez-Carvajal Ga,Morse Am,Davis C,Davis JM。细胞素蛋白型-B反应调节器PtRR13是杨树不定根发育的负调控因子。植物杂志。2009;150:759 - 71。
- 47.
Lakehal A,Chaabouni S,Cavel E,Le Hir R,Ranjan A,Raneshan Z,Nováko,păcurardi,perrone i,Jobert F等人。通过在拟南芥中控制TiR1 / AFB2-AUX / IAA依赖性植物素信号传导的偶然生根的分子框架。莫尔植物。2019; 12:1499-514。
- 48.
Chehab EW,姚C,亨德森Z,金S,Braam在J.拟南芥触摸诱导的形态发生是茉莉酸介导的,可以保护害虫。咕咕叫医学杂志。2012;22:701-6。
- 49.
Stepanova An,Robertson-Hoyt J,Yun J,Benavente Lm,谢Dolezal K,Schlereth A,JürgensG,Alonso JM。Taa1介导的养肝生物合成对于激素串扰和植物发育至关重要。细胞。2008; 133:177-91。
- 50.
Kumar V, Parvatam G, Ravishankar GA。AgNO3.- 乙烯活性和植物生长调节剂的潜在调节剂。电子J Biotechnol。2009; 12。https://doi.org/10.2225/vol12-issue2-fulltext-1.
- 51.
Steffens B,Kovalev A,Gorb Sn,Sauter M.通过机械和反应性氧物种信号传导来改变表皮细胞命运。植物细胞。2012; 24:3296-306。
- 52.
TREWavas A,骑士M.机械信号,钙和植物形式。植物mol biol。1994年; 5:1329-41。
- 53.
Marchadier E, Oates ME, Fang H, Donoghue PCJ, Hetherington AM, Gough J.钙基细胞内信号系统的进化。基因组生物学进展。2016;8:2118-32。
- 54.
Knight Mr,Smith Sm,Trewavas Aj。风诱导的植物运动立即增加细胞溶质钙。Proc Natl Acad Sci U S A. 1992; 89:4967-71。
- 55.
Haswell ES, Peyronnet R, Barbier-Brygoo H, Meyerowitz EM, Frachisse J-M。两种MscS同源物提供机械敏感通道活性拟南芥根。Curr Biol。2008; 18:730-4。
- 56.
Nakagawa Y, Katagiri T, Shinozaki K, Qi Z, Tatsumi H, Furuichi T, Kishigami A, Sokabe M, Kojima I, Sato S, et al.;拟南芥质膜蛋白对钙离子至关重要2+涌入和触摸感应在根中。Proc Natl Acad Sci U S A. 2007; 104:3639-44。
- 57。
O'Connor的DL,埃尔顿S,Ticchiarelli女,夏MM,沃格尔JP,则PIN生长素外排蛋白家族内Leyser O.跨物种功能多样性。Elife。2017; 24:e31804。
致谢
我们感谢戴文·李·奥康纳医生提供的Brachypodium proZmUbi: DII-VENUS转基因种子。
资金
该工作得到了韩国国家研究基金会(NRF)的跨越式研究(NRF-2018R1A2A119020840)的支持,并由韩国农村发展管理局提供的下一代生物绿色21节目(PJ013134)提供。融资机构在研究,收集,分析和解释方面没有发挥作用,也没有在书面上写作稿件。
作者信息
隶属关系
贡献
CMP和KEG构思了项目,设计了实验。KEG、BEN、PYJ和JHK进行了实验。KEG、BEN、JGK和CMP分析了数据。CMP, KEG和PYJ准备了手稿。所有的作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1图S1
.将刷毛植物适应风刺激。
附加文件2
.风刺激对空气与土壤水分含量的影响。
图S3
.风对空气和植物体温的影响。
附加文件4图S4
.物理解剖风刺激。
附加文件5图S5
.铜卷曲植物对机械和重力刺激的实验组。
附加文件6图S6
.没有与土壤直接接触的下落对诱发AR形成的影响。
图S7附加文件7
.机械触摸植物AR表型分析的实验组。
附加文件8图S8
.测量土壤和沙层含水量的原理图。
附加文件9
.DII-VENUS报告植物AR原基的荧光成像。
附加文件10图S10
.IAA对AR形成。
附加文件11图S11
.乙烯感知抑制剂对AR形成诱导的影响。
图S12 . txt文件
.感应的BdWOX和BdLBD基因靠土壤接触。
图S13附加文件13
.生长素和NPA对乙烯反应基因转录的影响。
附加文件14表S1
.使用的引物。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
南,b.e.,朴yj。吉尔·柯。等等。在风的条件下,植金蛋白介导触摸诱导的机械刺激不定根形成Broachypodium distachyon..BMC植物BIOL.20,335(2020)。https://doi.org/10.1186/s12870-020-02544-8
收到了:
公认:
发表:
关键词
- 不定根
- 生长素
- Broachypodium distachyon.
- 重力
- 住宿
- Thigmomorphogenesis
- 风