摘要
背景
花粉的形成和发育对作物的育性非常重要,是杂种发育的关键因素拟南芥绒毡层(附件1)和它的米(水稻)同源物,OSTPD1.式(OsTDL1A),是细胞特化所必需的,并极大地影响花粉的形成和发育。关于TPD1同源物在香蕉花粉发育中的作用知之甚少。
结果
在此,我们报道了二倍体香蕉(穆萨itinerans)通过过表达最近的同源物,审查它们在花粉发育中的作用,MaTPD1A。MaTPD1A在雄蕊中表达量高,定位于质膜。MaTPD1A-与野生型植物相比,过度表达的植物不产生花粉粒和更小的无核果实。转录组分析表明,在植物激素、淀粉和蔗糖代谢以及亚麻酸代谢相关途径中,过表达MaTPD1A,以及几个关键调节因子的表达,如PTC1.和myb80.已知影响花药的发展,受到影响MaTPD1A-overexpressing线。
结论
我们的结果表明,MaTPD1A在二倍体香蕉的花粉形成和果实发育中起着重要作用,可能通过影响花粉发育的一些关键调节因子的表达。
背景
花粉发育,释放和授粉对世界成功的植物性繁殖和遗传多样性至关重要。杂交系具有遗传修饰(GM)花粉的发展可能会聚在一起多重重要的农艺性状并导致巨大的混合活力。在花植物的花粉中,花粉形成是由生殖细胞(Microcorocytes)的分化和相互作用与体细胞壁细胞(Tapetum)进行分化和相互作用[1].在拟南芥和水稻中,通过对两个物种的雄性不育突变体的表征,已经确定了越来越多的参与花粉发育和形成的基因,并且控制花粉发育过程的关键基因在两个物种中都相对保守[2那3.那4.].
在拟南芥、水稻和玉米中,拟南芥中一对复杂的蛋白质-蛋白质相互作用体——绦虫决定因子1 (AtTPD1):过量的小孢子细胞1/额外孢子生细胞(AtEMS1/EXS) [5.那6.那7.],OSTDL1A:水稻中的多个Sporocyte1(OSMSP1)(水稻)[8.那9.那10.): ZmMSP1(MULTIPLE SPOROCYTE1 (ZmMAC1))Zea Mays.)[11.那12.已被鉴定为用于花药细胞分化的临界调节剂。ATTPD1的突变导致由于缺失的花粉颗粒导致完全雄性不育[5.那13.,分析TPD1- 大规处植物表明表达增加TPD1通过与EMS1/EXS受体蛋白激酶相互作用,激活细胞分裂,导致心皮细胞数量增加[14.].
香蕉是热带、亚热带地区重要的水果作物。野生香蕉树是二倍体,如果授粉,果实就会发育,并且完全播种。15.].通过交叉研究,在某些二倍体香蕉中的普迟人在一些二倍体香蕉中涉及至少三个主导地位穆萨acuminata(非孤雌果)及可食二倍体香蕉(孤雌果)[16.]。食用香蕉为营养单性结实,无核果实发育而不授粉。香蕉花序复杂,包含雌花、雄花和中性花。雌花和雄花是香蕉的主要花类型。通常雌花有一个细长的三眼子房,有三个花冠雄花有一个较小的子房,纤细的花柱和五个雄蕊,雄花有长的花药,可能产生也可能不产生花粉。在肥沃的野生香蕉中,可以产生有活力的花粉,但一些花粉也由食用香蕉产生[17.].雌花的子房发育成果实或手指,香蕉果实指串排列成手。花束中手的数量取决于花序中雌花簇的数量,并随基因型和环境条件而变化。1953年,法恩报告说,在矮卡文迪什香蕉植株中,第一朵花在右手边形成,而其余的花在顶部和底部之间形成一个之字形[18.].在野生香蕉中,有五种不同的模式用于花开发。其中两个类似于Fahn的报告的模式。有一种图案,鲜花从左侧到右侧的鲜花形式,花形式的顺序与所描述的fahn相反19.].野生香蕉植物是二倍体,一般交叉授粉,并具有肥沃的种子。栽培的香蕉是三倍体,具有多度的疗效和无菌性,并且呈现低数量或完全没有种子[20.].香蕉杂交是创造新品种的最重要方法。在过去的三十年里,许多香蕉种植国家推出了一系列杂交计划并发布了许多有用的品种[21.那22.].
花粉形成和活力是杂交的重要因素,但对香蕉的花粉发育和形成的分子机制很少。在这里,我们鉴定了基于释放的香蕉的TPD1的四种同源物。为了调查MATPD1A的作用,attpd1最接近的Attpd1,我们过度表达MaTPD1A在野生品种M. Inerans。表征MaTPD1A-overexpressing(MaTPD1A-OE)植物表明,TPD1A会损害果实和花粉的形成,转录组分析表明,许多以前已知的花药发育相关基因在植物中表现出差异表达MaTPD1A- 与wt相比植物。这些数据表明,MATPD1A通过影响这些过程中涉及的基因的表达来调节水果和花粉发育。
结果
香蕉中Attpd1同源物的确定与表征基因组
以拟南芥TPD1 (AAR25553)蛋白序列为查询对象,对香蕉a基因组数据库进行TBLASTN搜索。四个TPD1同源基因被鉴定并命名MaTPD1A(无花果。1一个),MATPD1B,MATPD1C和MaTPD1D并且分别推断出MA00_P03730.1,MA08_P27040.1,MA06_P0710.1和MA09_P01210.1的相应蛋白质序列。它们分别具有183,105,201和206个氨基酸。此外,MATPD1C和MATPD1D的9.05和10.05等电量分别大于MATPD1A和MATPD1B的5.74和5.15pi。BLAST搜索显示MATPD1A具有保守的ATTPD1结构域,与拟南芥TPD1蛋白共享54%的序列同一性和75%序列相似度(图。1和表格1).与其他三个TPD1同源物相比,MaTPD1B与AtTDL1具有更高的同一性和相似性。系统发育分析表明,4个香蕉TPD1同源基因聚为1类,其中2个同源基因来自Elaeis Guineensis.与OSTDL1A和玉米多阵列细胞1(ZMMAC1)有关,并且据报道,据报道在花药开发中具有重要作用[8.那10.那11.](图。1b)。TPD1的所有同源物在C末端具有高度保守的区域(图。1c).蓝色箭头表示4个保守的半胱氨酸残基,红色箭头表示AtTPD1的双碱裂解位点。在一些物种中TPD1同源物的N端存在明显的信号肽或跨膜结构域,但在香蕉中四个TPD1同源物中没有检测到信号肽或跨膜结构域(图)。1b).随后,为了确定TPD1同源物在香蕉中的作用,我们选择了AtTPD1最保守的同源物MaTPD1A进行进一步分析。
香蕉TPD1同源物的序列分析。一种序列组织的示意图MaTPD1A。B.TPD1和相关同源物的系统发育分析。氨基酸序列使用分类ω对齐,并使用Mega Software 5.0使用邻接加工方法绘制树(http://megasoftware.net/).使用结构分析功能从SMART获得每个基因的结构。红色框表示信号肽;蓝色框表示一个跨膜结构域。EgTPD1A、PpTPD1B、SmTPD1A、SmTPD1B、MaTPD1A、MaTPD1C和MaTPD1D在智能数据库中没有匹配项。详细序列信息如下:AtTPD1(AAR2553.1);AtTDL1(ABF59206.1);EgTPD1A(XP_010936413.1);EgTPD1B(XP_019703285.1);GmTPD1A(XP006581852.1);GmTPD1B(XP_014630314.1);OsTDL1A(BAG98429.1);OsTDL1B(BAH00567.1);PpTPD1A(XP_024360232.1);PpTPD1B(XP_024403645.1);SmTPD1A(XP_002981330.2);SmTPD1B(XP_002966893.2);VvTPD1A(XP_002280540.1);VvTPD1B(XP_010646260.1);ZmMAC1(AEN03028.1);ZmTPD1(ACG48634.1);MaTPD1A(Ma00_p03730.1);MaTPD1B(Ma08_p27040.1);MaTPD1C(Ma06_p07710.1);和MaTPD1D(Ma09_p01210.1)。C来自各种生物的TPD1与显示高度保守区域的共簇ω。在,拟南芥蒂利亚纳;例如,Elaeis Guineensis.;通用汽车,甘氨酸最大;OS.,oryza sativa粳稻;PP,Physcomitrella patens.;SM.,Selaginella Moellendorffii.;Vv,vitis Vinifera;ZM,Zea Mays.;妈,穆萨acuminata。带下划线的区域是TPD1的保守的C末端结构域及其同源物;蓝色箭头表示保守的半胱氨酸残留,这对于Attpd1的正常功能至关重要;红色箭头表示Attpd1的二维裂解位点。Star表示所有序列中相同的氨基酸
表达水平MaTPD1A在香蕉的不同组织中
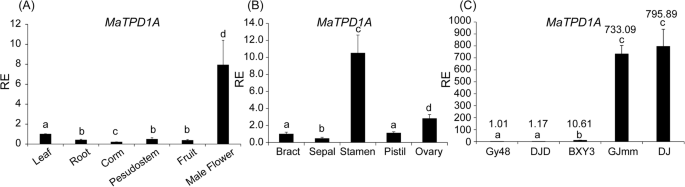
QRT-PCR分析表明MaTPD1A与其他组织相比,雄花芽中表达量较高(图2)。2一种)。为了进一步表征在雄花的不同部分中的表达,收集野生型植物的雄花,用于QRT-PCR测定。结果表明,与其他雄性花组织相比,MATPD1A在雄蕊中显示出高表达。(无花果。2b)。此外,我们发现了MaTPD1A在新建立的胚性细胞悬浮液(ECS)中显示出从两个香蕉品种的高表达和三个香蕉品种的非胚胎源细胞悬浮液中的弱表达(图。2c).此外,表示MaTPD1A野生香蕉的非胚性愈伤组织几乎检测不到(数据未显示)。这些结果表明,MaTPD1A可能在植物胚性愈伤组织再生中发挥重要作用。
巴纳MATPD1A的亚细胞定位
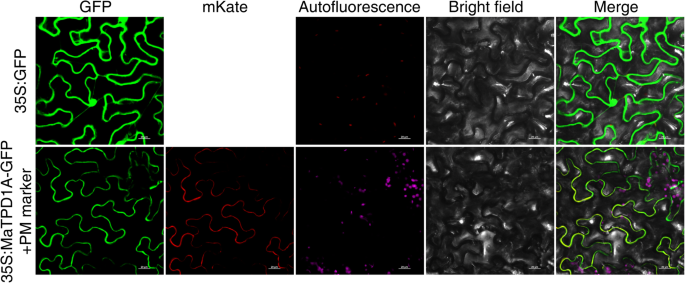
为了表征MATPD1A蛋白的亚细胞定位,我们产生了一种构造,其中MATPD1a的ORF与GFP的N-末端和Cauliflower马赛克病毒35s启动子(CAMV 35s)的控制。通过烟草表皮细胞中这些构建体的瞬时表达来确定定位农杆菌肿瘤术-介导转化。作为对照,在整个细胞中观察到GFP荧光。当MaTPD1A GFP载体和质膜标记载体共转化到烟叶中时,MaTPD1A GFP融合蛋白与质膜标记共定位,这表明MaTPD1A仅定位于质膜(图。3.).
MaTPD1A-OE株系表型特征分析
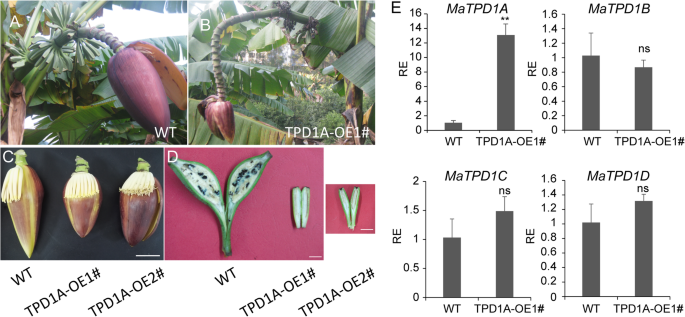
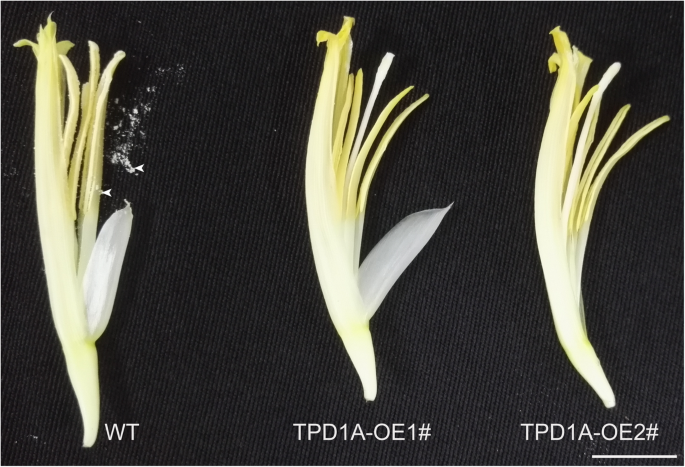
阐明MaTPD1A香蕉的cDNAMaTPD1A在组成型花椰菜马赛克病毒35s启动子(35s)的控制下在野生型植物中过度表达。过表达的构建体用于通过农杆菌介导的转化转变二倍体香蕉胚胎蛋白悬浮液。TPD1A同源物理抑制植物被转移到土壤中并生长直至开花。野生型和野生型之间没有明显的差异MaTPD1A-OE植物营养生长阶段。在生殖生长阶段,过表达matpd1a的植株可以产生正常的芽(图。4.A,B),但转基因植物的雄花比野生型植物的较短(图。4.C)。此外,大多数果子手指在Matpd1a过度抑制植物的晚期开发阶段枯萎和死亡,剩余的果子手指显得小而无籽(图。4.b、 更重要的是,转基因植物是雄性不育的,产生不含花粉粒的正常花药(图。5.),表明MATPD1A在香蕉花粉发育中的临界功能。我们获得了8.MaTPD1A-OE线总数。所有转基因株系的表型均相同,与上述两种株系的表型相似MaTPD1A- 一条线(图。4.)因此,选择了一条具有代表性的MaTPD1A OE生产线进行进一步分析MaTPD1A成绩单MaTPD1A-oe1#线比非转化植物高约13倍,以及其他三个的成绩单TPD1同系物不受MaTPD1A超表达(无花果。4.e)。
之间的转录组分析MaTPD1A-oe和野生型线
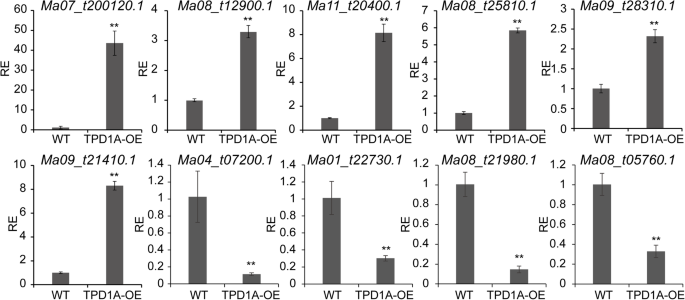
进一步描述…的效果MaTPD1A在整个转录组上过表达,用野生型和雄性型花蕾进行RNA-SEQ分析TPD1A-overexpressing植物(MaTPD1A-OE1 #)。每个样品的三个生物重复中每千碱基的转录本/百万片段映射(FPKM)值被给出(附加文件)2:表S2)。基于截止阈值|log2(折叠变化)| > 1 and False Discovery Rate (FDR) < 0.01, a total of 3832 genes in the male flower were found to be differentially expressed inMaTPD1A-oe与wt相比(附加文件3.:表S3)。其中,2188例上调,1644例下调(补充文件3.:表S3)。为了检验转录组数据的可靠性,我们选取了10个植物激素信号转导相关基因,在转录组中进行了差异表达MaTPD1A选择植物在逆转录定量实时PCR(RT-QPCR)测定中检查。RT-QPCR的基因表达结果表现出类似的转录组数据的趋势,其幅度的一些变化(图。6.).
在野生型和转基因植物中涉及植物激素途径的十种选定基因的表达水平。基因表达值相对于野生型植物(设定为1)。RE为相对表达水平。MA07_T00120.1.(吲哚-3-乙酸 - 氨基合成酶GH3.1);Ma08_t12900.1(乙烯受体2);Ma08_t25810.1(茉莉酸酰胺合成酶)jar1.);MA09_T21410.1.(auxin-induced蛋白质15像);MA09_T28310.1.(乙烯不敏感3样3蛋白);MA11_T20400.1.(乙烯响应转录因子1b样);MA08_T05760.1.(Gibberellin受体GID1C样);Ma08_t21980.1(脱落酸受体PYL4-like);Ma01_t22730.1(类油菜素内酯LRR受体激酶);Ma04_t07200.1(可能的吲哚-3-乙酸 - 氨基合成酶GH3.8)。实验进行三次,并提出了一种实验的代表性数据。使用学生的T检验确定显着差异(** P <0.01)。条表示标准差
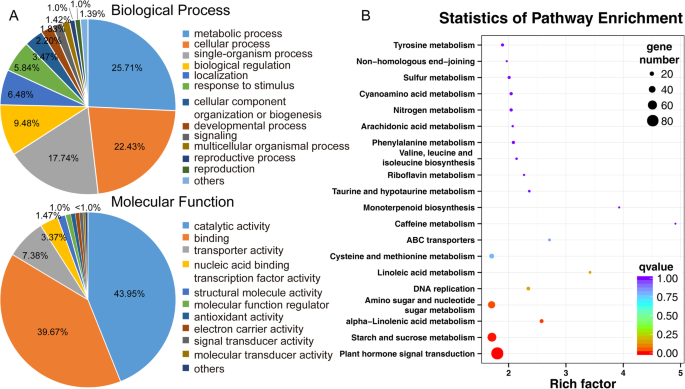
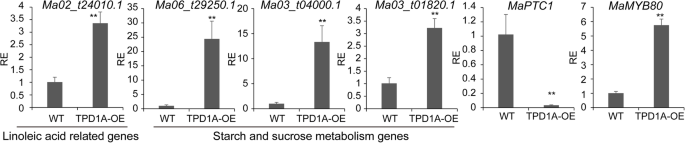
为了将这些基因划分到不同的生物学和分子功能类别,确定了基因本体论术语并计算了它们的富集度。从香蕉基因组数据库(m . acuminata,dh pahang,版本2)。代谢过程的调节,细胞过程,单生体过程,生物调节,催化,结合和转运活性相关的GO术语在差异表达基因中富集TPD1A- 植物(图。7.a).此外,为了确定差异表达基因的生物学解释,我们进行了KEGG通路分析。结果表明,335个基因被分配到前20个富集途径4.:表S4与图7.b)。前四个显着富集的术语是“植物激素信号转导”,“淀粉和蔗糖代谢”,“氨基糖和核苷酸代谢”,和“α-亚麻酸代谢”。P.-Values(附加文件4.:表S4)。共85,58和17个基因,分别与植物激素,淀粉和蔗糖代谢和亚麻酸代谢分别有关(额外文件5.:表S5,附加文件6.:表S6,附加文件7.:表S7);在上面的那些中,上调了三分之二的基因MaTPD1Aoe植物。此外,668个差异表达基因被归为转录因子类别,表明MaTPD1A过表达影响多种转录因子的调控(Additional File)8.:表S8)。我们还通过QRT-PCR分析证实了结果(图。8.).值得注意的是,发现一系列是水稻或拟南芥在水稻或拟南芥中关键基因的同源物的基因,以差异表达MaTPD1A- 植物(图。8., 桌子2).PTC1在绒毡层的形成和降解中起重要作用。MYB80、UTD1和ZmMADS2转录因子是花粉和花药发育的关键调控因子。在拟南芥或水稻中,MST8、UGP2、CP1和SUT3是糖分配所必需的。这些结果表明,过表达MaTPD1A通过调节花药或花粉发育相关基因的转录来影响花粉发育。
讨论
花粉的发育是一个受到严格控制的过程,由一系列特定的功能因子决定[3.那23.].基因功能的损害可能会影响花粉或花粉形成或导致花粉流产和雄性不育。了解花药和花粉发育相关基因的分子和生化机制对于Banana交叉育种的基本和应用研究非常重要。在这项研究中,我们首先在香蕉中鉴定了Attpd1同源物,并检查过过表达的效果TPD1香蕉花粉发育的同源物。结果建立了进一步了解MATPD1A在花药和花粉形成中的作用的基础。
在拟南芥中,TPD1和EMS1是花药细胞分化的重要调节因子,任何一个基因的突变都会导致过量的小孢子母细胞而没有绒毡层细胞[5.那24.].附件1是表达在叶子、幼苗和花蕾,而它的水稻同源物OsTDL1A和OsTDL1B主要在根和花中表达[4.那8.].此外,在花芽发展的不同阶段,TPD1拟南芥和稻米的表达是动态的。还有另一个TPD1-like基因命名附件1在拟南芥中,但其在花粉发育中的作用是未知的。最近的报告表明,在两种TPD1的水稻同源物中,只有OSTDL1A在胚珠中用MSP1共压制,并结合MSP1以限制孢子细胞数,但它们在不同组织中表现出类似的表达模式[8.].本研究表明,它们在花的发育过程中可能有不同的作用。在香蕉基因组中,通过TBLASTp查询,鉴定了4个与AtTPD1蛋白序列同源的TPD1同源物。香蕉MaTPD1A转录物主要在雄性花芽和雄蕊中鉴定(图。2),这与其在花粉发育中的作用一致。此外,我们的结果表明表达水平与不同ECS的再生能力密切相关。有必要进一步确定MATPD1A在EC的再生中的作用。
在拟南芥中,TPD1的突变分析表明其N端信号肽是花药细胞分化正常功能所必需的[6.], AtTPD1可通过在KR裂解位点切割加工成一个小蛋白。在正常情况下,AtTPD1定位于运输囊泡,在EMS1存在时,TPD1可分泌到质膜[6.].水稻的两个TPD1同系物也具有N端信号(图。1b) 这表明水稻的TPD1同系物可能具有类似的机制。TPD1决定功能性绒毡层细胞的命运,而信号肽的突变或破坏影响其质膜定位,无论是否存在EMS1[6.].在香蕉中,在所有四个TPD1同源物中缺少N末端信号肽和KR切割位点(图。1b,c)。这意味着MATPD1可能不是分泌的蛋白质和具有完整蛋白质的功能。在MATPD1同源物中,KR裂解位点代替'RR',其类似于OSTDL1A和ZMMAC1(图。1C)。MAC1蛋白是除了除去推定的信号肽之外,似乎似乎似乎没有处理的完整蛋白质[11.].在拟南芥中,一些半胱氨酸的蛋白质atralf含有RR Dibasic位点(RRX1),可以通过植物枯草杆菌素样丝氨酸蛋白酶加工[25.].如果MATPD1可以在'RR'网站上可以切割MATPD1,则需要进一步的实验。此外,在这些蛋白质的其他地方可能存在一些裂解位点。MATPD1a的亚细胞定位分析确定其在质膜中的定位。但没有发现使用智能的N末端信号肽。一种可能的解释是,有在MaTPD1A的其他位置潜在的信号肽,另一种可能的解释是,在质膜MaTPD1A威力功能通过与质膜本地化伙伴相互作用如拟南芥[该EMS1同源物6.].将来值得考虑它。上述结果表明,花粉形成中的MATPD1A可能通过不同机制函数而不是ATTPD1和OSTDL1A。
在拟南芥中,TPD1突变植物没有花粉粒,产生没有种子的小角果[4.,过度表达TPD1结果表皮细胞增多,角质变宽[13.].MaTPD1A过度表达的植物雄花不产生花粉粒,转基因植物的雌花发育成没有种子的小果实(无花果。4.那5.).一种可能的解释是,二倍体香蕉的TPD1在花粉形成和发育过程中具有不同于拟南芥的机制。此外,我们的转录组分析表明,花粉和花药发育相关的一系列基因在两种植物中有差异表达MaTPD1A-overxcressing植物和野生型植物(表2).在我们的MaTPD1A-过表达植物的转录本PTC1.直脑被显着抑制(图。8., 桌子2).之前的报告显示了PTC1.- 润肤水稻植物有较小的花药,没有可行的花粉谷物[26.],在同源基因沉默的大麦植株中也观察到类似的表型[27.],类似于我们的MaTPD1-overexpressing植物,意味着下降PTC1.香蕉的同源基因可能与雄性不育表型有关。此外,上游转录因子的表达atmyb80和osutd1.orthologs也受到过度表达的影响MaTPD1A(无花果。8., 桌子2).据报道,AtmyB80和osutd1分别是拟南芥和稻米花粉发育的关键调节因素[28.那29.].糖分配相关蛋白MST8、UGP2和SUT3也参与水稻花粉发育[30.那31.].此外,我们发现一些含有差异表达的淀粉和蔗糖和亚油酸相关基因MaTPD1A-OE香蕉雄花(图。8.额外的文件6.:表S6,附加文件7.:表S7)。许多雄性无菌线的研究表明,碳水化合物涉及花药和花粉发育作为营养素和信号传导因子[32.那33.].在黄瓜中,下调蔗糖转运蛋白CSSUT1通过影响碳水化合物供应来导致雄性不育[34.]亚油酸也是影响花粉发育和育性的关键因素[35.].激素信号传导,例如养肝信号通路,也涉及花药和花粉发育[36.].有报道称生长素生物合成基因表达增加fvyu6.影响草莓花发育和雄性育性[37.[拟南芥中的高温引起的雄性不育可以通过疾病应用来逆转[38.].我们的qRT-PCR结果表明MaTPD1A大大影响了几种无毒信号传导相关基因的转录(MA09_T21410.1,MA07_T00120.1,MA04_T07200.1)在二倍体香蕉中。在一些单性结实的香蕉中,发育程序控制一系列关键基因,以支持无受精和雄性不育胚胎的形成,这让人想起MaTPD1A过度表达诱导的雄性不育。类似的程序可在MaTPD1A-OE植物。因此,我们认为,在这两种基因型的植物中,存在一些控制相似表型的重叠基因。进一步研究比较基因表达谱MaTPD1A- 普迟老律香蕉的植物将有利于理解潜在的分子机制。此外,女性和中性花的表达谱也有助于我们披露MATPD1A对花粉和水果发育的作用。
综上所述,我们的研究结果表明MaTPD1A在二倍体香蕉中,影响许多与花粉发育相关的基因的表达水平,并导致雄性不育表型,其潜在机制尚不清楚MaTPD1ACRISPR/Cas9介导的基因编辑或RNA干扰MaTPD1A将提供更多信息的作用MaTPD1A本研究为进一步研究香蕉花粉在花药和花粉发育中的作用以及香蕉育性的调控奠定了基础。
结论
在这项研究中,我们检验了过度表达的影响MaTPD1A论二倍体香蕉的花粉与果实开发。MATPD1A是香蕉中最接近TPD1的最接近的同源物,并局限于质膜。过度表达MaTPD1A在二倍体香蕉中导致雄性花花粒缺失,生产小而无籽水果。进一步的转录组分析表明,此前据报道的许多基因涉及花粉发育是在上调的或下调的MaTPD1A-overexpressing植物。因此,我们的研究结果揭示了MaTPD1A通过调控一些相关调控因子的表达来调控花粉形成,这为进一步确定其在花药和花粉发育中的作用以及未来对香蕉育性的调控提供了基础。
方法
植物材料和生长条件
M. Inerans又名云南香蕉,广泛分布于中国亚热带地区,在中国潮湿的沟壑和山区均有分布(https://banana-genome-hub.southgreen.fr/organism/Musa/Itinerans).这M. Inerans本研究以广西萍乡市金鸡山香蕉为材料,在广东省农业科学院果树研究所国家级香蕉种质资源库进行繁殖和保存。样品采集得到了当地行政部门的许可。经过多年从事香蕉种质收集和鉴定工作的欧胜博士的鉴定,香蕉的多芽丛生M. Inerans还在IFTR,GaAs和沉积数量的克隆香蕉种质中存放在公共体外储存库中,并且沉积数量是NYBGZXJ01404。其基因组序列已在2016年确定并释放[39.].用于转化的胚性细胞悬浮液(ECS)由雄花诱导M. Inerans保存在国家香蕉种质库中。对于香蕉植株培养,盆栽香蕉植株在温室中生长至五片真叶期,然后在以下条件下移植到试验田进行进一步培养:自然光周期(11/13 h) 温度在18-30度之间 °C,相对湿度为60–80%。在塑料室内进行的现场试验获得了广东省农业科学院(GAAS,广州,中国)生物安全监管机构的许可,可以进行该试验。
矢量建筑和转型
全长TPD1A引物正向(5 ' -ATGGCCTGCTTCCACGGTTTG-3 ')和反向(5 ' -TCAGCAAGTGACGGAGGAGAC-3 ')扩增同源物开放阅读框(ORF)。反应条件为:94°C 3 min;94℃15 s、55℃30 s、72℃30 s共32个循环,PCR产物在1.0% (w/v)琼脂糖凝胶中分离提取。将该ORF导入pMD18-T载体(D101A, TaKaRa, Dalian, China)进行测序。收集正确的MaTPD1A ORF片段,经双酶切后亚克隆到pBI121载体中囊我(TaKaRa,中国大连)和XBA.I(中国大连塔卡拉)。pBI121:MaTPD1A质粒被消化生态R I(塔卡拉,中国大连)和欣D III并克隆到PCAMBIA1301 Vector(Cambia)中。获得的pcmabia1301:MaTPD1A构建体变成了A. Tumefaciens.菌株EHA105用前面描述的方法进行转化[40]简言之,胚胎细胞悬浮液(ECS)是M. Inerans与...共携带A. Tumefaciens.在26°C下放置24小时,在黑暗中轻轻摇晃。去除上清收集ecs,用无菌水洗涤2次,置于添加25 mg/L潮霉素B和200 mg/L头孢噻肟的增殖培养基中,于26℃、110 rpm、黑暗条件下摇匀培养。然后,在再生培养基中培养ecs,每3周传代一次,共培养3次,直到产生抗性成熟体细胞胚。再生苗通过对抗潮霉素基因的PCR扩增确定,并利用离体植株分生组织扩增阳性植株。将生根苗移栽到温室中进行栽培,以便进一步研究。
亚细胞定位
的全长ORFMaTPD1A在pCMABIA1300-GFP载体中克隆到GFP框架内。pCMABIA1300-GFP载体是由pCMABIA1300的二进制载体修饰而成,将CaMV 35S启动子、GFP、RBS终止子导入pcmbia1300生态伊恩德囊我,太平洋标准时间我,太平洋标准时间我和欣将获得的构建物转化为A. Tumefaciens.菌株EHA105,以供进一步使用。MaTPD1A:GFP的瞬时表达如前所述[41.].使用共聚焦激光扫描显微镜(尼康C2-ER,东京,日本)获得图像。
RNA提取及qRT-PCR分析
根据制造商的说明,使用植物RNA分离试剂盒(柱植物RNAOUT 2.0,Tiandz,Tiendz,中国)从不同样品中提取总RNA。在开花后30天从香蕉植物收集不同的组织样品,包括叶,根,肠,伪升光,水果和雄花。对于香蕉花序,雌花首先出现,花序的远端部分细长并产生雄花的簇。当女性花朵发展成水果时,我们同时收集雄性花和未成熟的水果样品。CDNA模板使用具有GDNA橡皮擦(Takara,China)的Primescript RT试剂盒合成1μg总RNA。对于QRT-PCR测定,5μLTB绿色预混物EXQI II(Takara),4.0μL稀释的cDNA,0.8μl基因特异性引物,以及0.2μl的ROX参考染料将其混合在一起,并在A中运行反应Stepone Plus(abi)具有以下程序:30秒在95°C,然后40个95°C循环,5 s和60°C。这UBQ2.(HQ853254.1)选择表达式作为内部控制[42.].目的基因的相对表达量用2-△△Ct方法(43.[与内部控制有关。本研究使用的引物列于附加文件1:表S1。所有实验均重复三次,并提出了一个代表性实验。
转录组分析
野生型和野生型的雄性花蕾TPD1A-OE1#系植株在开花后约90天采集,用液氮研磨成细粉。每个样品有三个重复。用上述方法提取总RNA。RNA质量和浓度由NanoDrop 2000紫外-可见分光光度计(Thermo Fisher Scientific, Wilmington, DE, USA)评估,RNA完整性由安捷伦2100生物分析仪(Agilent Technologies, Palo Alto, USA)测定。使用TruSeq RNA样品制备试剂盒(Illumina, San Diego, USA)制备对端文库,测序文库由Biomarker Technologies Corporation (Beijing, China)使用HiSeq × 10平台进行RNA-seq分析。
数据和材料的可用性
该转录组数据可在NCBI知识库中获得,登录号为PRJNA606623 (https://www.ncbi.nlm.nih.gov/sra/?term=PRJNA606623).支持本文结果的数据集包含在本文及其附加文件中。
缩写
- TPD1:
-
毯DETERMINANT1
- TDL1:
-
TPD1像1
- PTC1:
-
宿存绒毡层细胞1
- GM:
-
转基因
- MAC1:
-
多孢原细胞1
- EMS1/EXS:
-
多余的微孢子囊肿/额外孢子细胞
- MSP1:
-
多孢子细胞1
- orf:
-
开放阅读框
- 绿色荧光蛋白:
-
绿色荧光蛋白
- OE:
-
超表达
- 罗斯福:
-
错误发现率
工具书类
- 1。
桑德斯PM,Bui AQ,Wettersings K,McIntire Kn,Hsu Y-C,Lee Py,Truong Mt,Beals TP,Goldberg RB。拟南芥拟南芥雄性无菌突变体的花药发育缺陷。性植物团体。1999; 11(6):297-322。
- 2。
威尔逊za,张db。从拟南芥到米饭:花粉发育的途径。J Exp Bot。2009; 60(5):1479-92。
- 3.
Gomez JF,Talle B,Wilson Za。花药和花粉发育:保守的发展途径。J Intent Plant Biol。2015; 57(11):876-91。
- 4.
施杰,崔米,杨立,金yj,张达遗传与生化机制花粉墙发育。趋势植物SCI。2015; 20(11):741-53。
- 5。
杨少林,谢丽芳,毛洪志,Puah CS,杨卫文,姜玲,孙达生,叶丹。拟南芥花药细胞特化的必需绒毡层。植物细胞。2003;15(12):2792 - 804。
- 6.
贾克,刘X,欧文哈,赵达。TPD1小蛋白和EMS1受体激酶的细胞命运测定的信号传导。Proc Natl Acad SCI U S A. 2008; 105(6):2220-5。
- 7.
黄建军,张涛,黄建军,赵丹丹。拟南芥小蛋白配体TPD1及其受体EMS1对花药细胞分化的调控作用。公共科学图书馆麝猫。2016;12 (8):e1006147。
- 8.
Nonomura K, Miyoshi K, Eiguchi M, Suzuki T, Miyao A, Hirochika H, Kurata N.在水稻中,MSP1基因是限制进入雄性和雌性孢子发生的细胞数量和启动花药壁形成所必需的。植物细胞。2003;15(8):1728 - 39。
- 9.
Zhao X,de Palma J,Oane R,Gamuyao R,Loo M,Chaudhury A,Herve P,Xue Q,Bennett J.OsTDL1A与水稻受体激酶MSP1的LRR结构域结合,并被要求限制孢子细胞数量。植物杂志2008;54(3):375-87。。
- 10。
洪L,Tang D,Shen Y,Hu Q,Wang K,Li M,Lu T,Cheng Z.Mil2(microporeless2)调节水稻花药中的早期细胞分化。新植物。2012; 196(2):402-13。
- 11.
Wang CJ, Nan GL, Kelliher T, Timofejeva L, Vernoud V, Golubovskaya IN, Harper L, Egger R, Walbot V, Cande WZ。玉米多孢原细胞1 (mac1)是水稻TDL1A的同源细胞,在花药发育早期调节细胞增殖和鉴定。发展。2012; 139(14):2594-603。
- 12.
van der Linde K, Timofejeva L, Egger RL, Ilau B, Hammond R, Teng C, Meyers BC, Doehlemann G, Walbot V.病原体特洛伊木马传递生物活性宿主蛋白来改变玉米花药细胞的原位行为。植物细胞。2018;30(3):528 - 42。
- 13。
陈志强,王志强,王志强,等。增强子诱捕和基因诱捕转座元件在植物发育中的作用。基因Dev。1995;9(14):1797 - 810。
- 14。
杨少林,姜玲,Puah CS,谢丽芬,张晓琴,陈丽琴,杨卫文,叶东。绒毡层决定因子1的过表达通过与过量小孢子细胞1/产孢外细胞的遗传互作改变拟南芥心皮和绒毡层细胞命运。植物杂志。2005;139(1):186 - 91。
- 15.
Simmonds NW。香蕉水果的发展。J Exp Bot。1953; 4(10):87-105。
- 16。
Simmonds NW。一些二倍体香蕉的隔离。J Genet。1953; 51:458-69。
- 17.
以色列Y,Blumenfeld A. Musa。in:halevy啊,编辑。开花手册:第III卷。博卡拉顿:CRC压力;1985. p。390-402。
- 18.
Fahn A.香蕉花序的起源。Kew Bull。1953; 8(3):299-306。
- 19.
Kirchoff BK, Bruenn RA。香蕉花是如何生长的?《年轻心灵的前沿》2018;6:60。
- 20。
Soares TL.Souza EHd、Costa MAPdC、Silva SdOe、Santos Serejo JAd:《香蕉体内受精》,Ciência Rural.2014;44(1):37-42。
- 21。
Batte M,Swennen R,Uwimana B,Akech V,Brown A,Tumuhimbise R,Hovmalm HP,Geleta M,Ortiz R.杂交东非Highland Bananas:在21年后遗传增强后的作物的植物学有关的经验教训。前植物SCI。2019; 10:81。
- 22。
从杂交到生物技术促进香蕉和大蕉的改良。Biotechnol放置2014;32(1):158 - 69。
- 23。
皮尔斯S,弗格森A,金J,威尔逊ZA。花网:花药和花粉发育的基因表达相关网络。植物杂志。2015;167(4):1717 - 30。
- 24。
赵德志,王广发,马辉。拟南芥花药中过量小孢子细胞1基因编码的富亮氨酸重复受体蛋白激酶。基因Dev。2002;16(15):2021 - 31所示。
- 25。
Srivastava R,Liu JX,Gu H,Yin Y,Howell Sh。拟南芥植物肽激素的调节与加工atralf23。工厂J. 2009; 59(6):930-9。
- 26。
李H,袁Z,Vizcay-Barrena G,Yang C,Liang W,Zong J,Wilson Za,张D.持久性塔皮特Cell1编码了锭剂细胞死亡和水稻花粉发育所需的Phd-Finger蛋白。植物理性。2011; 156(2):615-30。
- 27。
Fernandez Gomez J,Wilson Za。大麦PHD手指转录因子通过影响Tapetal发育来赋予雄性不育性。植物Biotechnol J. 2014; 12(6):765-77。
- 28。
Phan Ha,Iacuone S,Li SF,Parish RW。花粉发育和调节拟南芥拟南芥中塔皮特编程细胞死亡所需的MYB80转录因子。植物细胞。2011; 23(6):2209-24。
- 29.
Jung Kh,Han MJ,Lee Ys,Kim Yw,Hwang I,Kim Mj,Kim Yk,Nahm BH,G.米未发育Tapetum1是早期绦虫发育的主要调节因素。植物细胞。2005; 17(10):2705-22。
- 30.
李恩,张多,刘HS,尹cs,李xx,梁wq,元z,徐b,楚hw,王j等。Tapetum降解和花药的发育需要稻瘟病退化基因。植物细胞。2006; 18(11):2999-3014。
- 31。
张H,梁W,杨X,罗X,江九,马H,张达碳饥饿的花药编码了调节水稻花粉发育所需的糖分配的MyB结构域蛋白质。植物细胞。2010; 22(3):672-89。
- 32。
《花药壁层对花粉糖营养的控制》。原生质体。1995;187:172–81。
- 33。
陈志强,陈志强。植物中糖类和氨基酸的代谢:对传粉昆虫的偏好和坐果的影响。植物杂志。2017;175(4):1510 - 24。
- 34。
孙丽,隋旭,Lucas WJ, Li Y, Feng S, Ma S, Fan J, Gao L, Zhang Z.通过改变碳水化合物供应下调蔗糖转运体CsSUT1引起雄性不育。植物杂志。2019;180(2):986 - 97。
- 35。
McConn M,浏览J.在拟南芥突变体中,亚麻酸的关键要求是花粉发育,而不是光合作用。植物细胞。1996; 8(3):403-16。
- 36。
Eveland AL, Jackson DP。糖、信号传导和植物发育。中国生物医学工程学报。2012;63(9):3367-77。
- 37。
刘虎,谢WF,张L,瓦普斯塔v,ye zw,gao qh,杜鹃酸盐生物合成林地草莓中的玉米甘草单氧基酶基因。J Intent Plant Biol。2014; 56(4):350-63。
- 38。
Sakata T,Oshino T,Miura S,Tomabechi M,Tsunaga Y,Higashitani N,Miyazawa Y,Takahashi H,Watanabe M,Higashitani A.患者逆转植物雄性不育,由高温引起的抗植物雄性不育。Proc Natl Acad Sci U S A. 2010; 107(19):8569-74。
- 39。
吴文,杨友,他wm,rouard m,li wm,xu m,roux n,ge xj。香蕉野性相对的全基因组测序穆萨itinerans提供对Musa属的谱系特定多样化的见解。SCI批准。2016; 6:31586。
- 40.
胡c-h,wei y-r,黄yh,yi g-j。高效的CHIT42 Transgenic Furenzhi香蕉生产方案(穆萨SPP。AA组)抵抗Fusarium oxysporum.体外细胞开发-Pl.2013;49(5):584-92。
- 41。
Sparkes IA,Runions J,Kearns A,Hawes C.荧光融合蛋白在烟草植物中的快速、瞬时表达和稳定转化植物的产生。Nat Protoc.2006;1(4):2019-25。
- 42。
关键词:香蕉果实,基因表达,RT-qPCR,内参基因引用本文:足底。2011;234(2):377 - 90。
- 43。
Livak KJ, Schmittgen TD。利用RealTime定量PCR和2-delta deltaC分析相关基因表达数据T.方法。方法。2001;25:402-8。
致谢
不适用
资金
该研究得到了中国国家重点研发计划的财政支持(2019YFD10001,2018YFD1000122),中国自然科学基金(31772267,31772289),以及广州市科技局(201707010154,201904020033)和普通计划的项目广东省技术创新团队对农产品保存及物流(2019KJ145),科学创新战略专项基金 - 高层农业科学院(R2017PY-JX002,R2018PY-QY004)和广东科技项目(2019B030316007,2018B020202005)和广州国家现代农业产业科技创新中心项目(2018KCZX06),13日五年期间广东农业科学院纪律队伍建设项目(201803XX)。该资助者在实验设计,数据分析,数据解释和稿件的准备中没有作用。
作者信息
隶属关系
贡献
构思和设计实验:CH,FB和GY;执行实验:CH,GD,FB和WH;分析了数据:OS,TAD,CL,HG,QY和TOD;写论文:FB和GD。所有作者阅读并认可的终稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者宣称没有利益冲突。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充资料
附加文件1:表S1。
本研究中使用的引物。
附加文件2:表S2。
在转录组分析中检测的完整基因。
附加文件3:表S3。
差异表达基因MaTPD1Aoe植物。
附加文件4:表S4。
前20条富集路径。
附加文件5:表S5。
差异表达植物激素信号转导的基因。
附加文件6:表S6。
差异表达基因涉及淀粉和蔗糖代谢。
附加文件7:表S7。
差异表达基因涉及亚麻酸代谢。
附加文件8:表S8。
转录因子差异表达MaTPD1Aoe植物。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条中提供的数据,除非数据信用额度中另有规定。
关于这篇文章
引用这篇文章
胡,C.,Sheng,O.,Dong,T.et al。过度表达MaTPD1A通过调节植物体内的某些调节因子来损害果实和花粉的发育穆萨itinerans。BMC植物BIOL.20,402(2020)。https://doi.org/10.1186/s12870-020-02623-w
已收到:
公认:
发表:
关键字
- 野生香蕉果实发育
- TPD1
- 雄性不育
- 穆萨itinerans
- 超表达