摘要
背景
在土地资源不丰富的茶产区,常采用间作方式,根据当地农民的经验,通过茶-板栗间作系统,生产出的绿茶味道更鲜美。间作条件下,茶树叶长、叶重增加,根系垂直分层,共生协调。然而,间作的微妙机制还不完全清楚。
结果
与同一地区的纯茶园相比,1980年代建立的板栗-茶间作系统的绿茶排名最高。基于非靶向代谢组学分析,间作系统与单作系统的茶叶共有100种差异代谢产物上调。基于靶向代谢组学,21种氨基酸在间作条件下表达上调,3种氨基酸在间作条件下表达下调;半数上调的氨基酸对茶的口感有正面影响。间作系统中尿囊酸、糖、糖醇和油酸的含量高于单作系统,苦味类黄酮含量低于单作系统。上调的代谢产物可以提高茶叶的品质和保健作用。黄酮和黄酮醇的生物合成和苯丙氨酸代谢表现出最大的差异。与氨基酸代谢相关的许多途径发生了改变,表明板栗-茶间作对茶树氨基酸代谢有很大影响。
结论
这些结果加深了我们对板栗-茶叶间作系统中茶叶品质改善的代谢机制的理解,并证明采用这种间作系统在代谢水平上改善茶叶品质有很大的潜力。
背景
茶[山茶花Sinensis.(L.)O。昆茨]是世界范围内消费的一种重要作物,主要以鲜叶以不同方式加工的饮料形式存在[1]. 茶起源于热带雨林的一种林下植物,因此,它喜欢温暖、潮湿、阴暗的环境,有漫射的光线和酸性土壤[2]. 鉴于这些偏好,农林间作系统为茶树栽培和保护提供了便利的策略。农林间作是一种古老而有效的种植方法,一种植物与另一种植物并驾齐驱,从而提高产量和经济效益,减少杂草和害虫,提高光截获和利用率,增加铁营养等[3.那4.那5.那6.].农业剧间交流在世界许多地方普遍实行耕地稀缺,饥饿仍然存在[7.那8.].
茶树间套种策略已发展出多种形式,并在不同的产茶地区得到应用。一些高大的树种在茶园被用作遮荫树,包括椰子(椰子)、橙(网状柑橘),杨梅(杨梅),枇杷(枇杷),还有银杏(银杏)[9.].由于在间作茶叶种植园中使用农药的使用减少,所得到的茶叶可能具有较少的化学污染问题[9.].在易受土壤侵蚀的山区的山区实施了橡胶和茶叶和茶叶的茶叶和茶。例如,在20世纪70年代推荐给中国一些省份橡胶和茶厂的间作栽培,导致茶品质和水土保持和茶品质的积极成果[10.].
中国栗子(齿栗叶mollissimaBlume)和茶叶植物是经典的间作合作伙伴,研究人员研究了中国栗子茶间系统的一些不同方面。中国栗子是栗子物种中主要重要的物种之一[11.].在中国北方,板栗-茶间作降低了茶树的光照强度,降低了植株周围的空气和土壤温度,从而增加了空气湿度。这种改变的小气候可以提高茶叶质量和产量[12.].间作系统允许栗子和茶叶植物的根系垂直分层并协调共生,这增加了茶叶植物根系的干重[13.]. 此外,间作系统中土壤结构的改善也导致植株叶长和叶重的增加[14.].因此,板栗与茶叶间作不仅提高了茶叶产量,而且具有生态效益,是一种可持续的茶园经营方式[15.].
宝红茶[山茶花Sinensis.(L.)O。Kuntze简历。宝红]是中国云南省唯一的小叶茶。它通常被制成具有独特的天然花香的绿茶;这种高香气绿茶被认为几乎可以与中国杭州的龙井茶相媲美。自1965年以来,宝红茶树已种植近40余种 云南省宜良县宝洪山下。然而,在那个经济社会发展相对落后的年代,光卖宝红茶的收入就相对较低。板栗也是当地传统的木本作物。因此,一组板栗树也被种植在大约10年 上世纪70年代在宝红茶园种植。在宜良,板栗种植后5年左右开始收获,板栗的市场很旺,板栗的存在并没有影响茶树的生长。一块地的收入翻了一番,增加了茶农的盈利能力,于是宝红茶园又增加了一批板栗(~ 10 ha)分别在20世纪80年代和90年代。上世纪90年代末,随着世界茶叶消费量的增加,纯茶园也开始盈利,宝红茶园在剩下的几公顷土地上也没有再种植树木。对宝红山茶树的灌溉施肥进行了系统管理,每年修剪一次,使其高度保持在1 M经过几十年的发展,这些栽培体系,包括纯茶体系和板栗茶间作体系,一直保存至今,成为昆明周边乃至全国板栗茶间作的典范。虽然板栗-茶叶间作的生态效益和经济效益在宝红茶园已经得到了明确的证明,但是,由于所有宝红生产系统的新鲜茶叶传统上都是采摘和混合在一起的,因此,间作是否能提高茶叶质量尚不清楚。
茶叶品质是以茶叶中的氨基酸、有机酸、糖类、脂类等特征性感官物质以及酚类等生物活性物质的含量来评价的[16.]. 氨基酸有助于绿茶的风味,并赋予一些健康的好处,如消炎,抗微生物和积极的神经作用[17.].由于味道及其生物学活动,有机酸也有很大的健康益处,可以影响茶质品质[16.]. 游离糖是合成儿茶素所必需的,儿茶素在加工过程中有助于形成茶的风味[16.]. 茶叶中存在的各种形式的脂类,在加工过程中可被加热或氧化改变,可产生挥发性化合物并产生绿茶特有的味道[18.]. 因此,有效、准确地描述茶叶中这些复杂化学物质的动态变化是茶叶品质评价的关键。到目前为止,已有研究表明,栗茶间作可以通过测定茶叶中一类或少量的化学物质来改善茶叶品质,但这并不能完全反映茶叶品质的复杂性。
代谢组学技术为茶叶中复杂化学成分的测定提供了更全面的方法[19.].到目前为止,尚未研究中栗子茶与新鲜茶叶代谢组科剖面的影响。通过农艺实践和茶园管理,可以为进一步提高绿茶质量的基础,茶组合物的全身表征。因此,通过对主要绿茶组分进行感官评估和测量,通过针对LC-MS进行靶向和非靶向代谢组织的感觉评估和测量,调查了中国栗子茶间作系统对茶品质的影响。我们鉴定了超过100种差分代谢物,在来自间作系统的茶叶中上调,相对于单一栽培系统。途径分析表明,Lavone和黄酮化合物生物合成和苯丙氨酸代谢,氨基酸代谢显着改变,表明中栗子茶的间作可以大大影响紫杉醇,糖,糖醇和油酸,以及茶中的氨基酸代谢植物与改善的茶口呈正相关。我们的成果为开发与中国栗子的间作生态模型提供了理论基础,甚至与其他树种。
方法
植物材料和生长条件
宝红茶种植于上世纪60年代的宝红山上,隶属于中国宝红茶产业有限公司。这座山平均海拔约1900米 属北亚热带季风气候,平均气温16.3℃ °C,平均湿度80%。抽样是在私人土地上进行的,我们确认土地所有者对此给予了许可。我们收集了四组,三组来自70年代、80年代和90年代种植的栗茶间作系统的茶树,一组来自纯茶园,作为对照(表1)S1)。2019年3月24日,该组被指定为70t,80t,90t和t.芽和两片叶子从茶厂仔细收集芽植物。栗子冠盖的茶厂在栗子茶中取样间作系统。我们总共服用了150株植物,将它们分成50个植物的组,以及每组作为生物重复,然后从每株植物中挑选5至10个芽和叶。这是随机完成的。这是随机完成的。对于每组的每个生物重复,我们将叶子划分为两部分。对于每种生物重复,将50种植物的所有叶子置于相同的竹袋中,然后分成两个部分。将一部分置于取样管中,然后迅速冷冻并暂时储存在液氮中,以实验室储存,并储存在-80℃的冷冻机中,用于靶向和非靶向的代谢组学测量。另一部分被采用到宝红茶处加工车间,在电动蒸锅中蒸煮4分钟。 After steaming, the tea leaves were thinly spread on a bamboo mat and dried under the sunshine outdoors for about 4 h. It was performed from 1 to 5 p.m. of March 24, with the temperature from 25 to 23 °C, the wind of SW 12.3 ~ 17.7 mph, and the solar radiation 682 kJ/m2。将干茶叶密封在一个自密封袋中,用于感觉评估和咖啡因,茶多酚和游离氨基酸的测量。
茶叶样品感官评价
茶的感官评价是根据中华人民共和国国家标准(GB/T 23776–2018)由5名高级品茶师组成的培训小组进行的。建立外观、茶液颜色、香气、口感、灌叶的偏好等级,分别按20分、20分、25分、25分、10分进行评分,评分越高,得分越高。每个分项分别评分,最后汇总为最终得分。采用盲评制,即品茶员对每一个茶叶样品都一无所知,只能得到样品编号。他们被提供了一份规定的问卷来记录他们的感官评价。感官评价是在一个有25名儿童的房间里进行的 摄氏度,湿度67%。
测定咖啡因含量,茶多酚和游离氨基酸
咖啡因的测定采用高效液相色谱法(HPLC),符合中华人民共和国国家标准(GB/T 8312–2013)。标准曲线绘制为y = 32.064倍-8.2625(R.2 = 0.9999). 部分溶液通过0.45的滤膜过滤 μm,准确测定并注入HPLC,与标准曲线比较。
茶多酚的测定按中华人民共和国国家标准(GB/T 8313-2008)进行。根据没食子酸工作液的吸光度和浓度,得到标准曲线y = 0.005倍 + 0.0728 (R.2 = 0.997)。吸收测定在765 使用紫外-可见光谱法(UV-2401,岛津)。
氨基酸采用中华人民共和国国家标准(GB/T 8314-2013)方法检测。根据吸光度和茶氨酸浓度绘制标准曲线,得到y = 2.7841x-0.1534 (R.2= 0.9929)。以试剂溶液为空白对照,测定样品的吸光度,并与标准曲线比较得到氨基酸含量。
非靶向代谢组学
非靶向代谢组学方法按照Zeng等人的报告进行[20.]. 简而言之,提取代谢物用于UHPLC-QTOF-MS分析。LC-MS/MS分析通过UHPLC系统(1290,安捷伦科技)和UPLC BEH酰胺柱(1.7)进行 μm 2.1*100 mm,Waters)耦合到6600(Q-TOF,AB-Sciex)的三倍。利用ProteoWizard将MS未处理的数据文件转换成mzXML格式,并用R包XCMS(版本3.2)进行处理。预处理结果生成了一个包含保留时间(RT)、质荷比(m/z)和峰强度的数据矩阵。XCMS数据处理后,采用R封装摄像机进行峰值标注。第二个质谱(MS2)数据库用于代谢物鉴定。利用HMDB、PubChem、KEGG和METLIN的代谢组学数据库,筛选MS2定性分析的代谢物。
靶向代谢组学
靶向氨基酸的分析方法主要提到了朱等人的指示。[21.]. UHPC分离由安捷伦1290 Infinity II系列UHPC系统(安捷伦技术公司)进行,配备Waters ACQUITY UPLC BEH酰胺柱(100 × 2.1 毫米,1.7 μm)。柱温35℃,自动进样器温度35℃ °C和4 摄氏度。采用带有AJS电喷雾电离(AJS-ESI)接口的Agilent 6460三重四极质谱仪(Agilent Technologies)进行分析开发。MRM数据由安捷伦Mass Hunter工作站软件(B.08.00,安捷伦科技)收集和处理。如果S/N(信噪比)小于或等于20或校准精度超过80–120%,则从校准中消除该水平。
统计分析
为了勾勒出80年代化学变化的图形 采用SIMCA软件(V14.1,Sartorius Stedim Data Analytics AB,Umea,Sweden)对T和T样本进行PCA模式识别。以获得更高水平的群体分离,更好地理解T和80 采用有监督的OPLS-DA对T样本进行分类。代谢物(VIP > 1.0)被认为是OPLS-DA模型中潜在的样品鉴别的重要代谢物。我们使用了学生测试,这是常用的代谢组学统计分析。P. < 在学生的测试中,0.05被认为具有统计学意义。
结果
从20世纪80年代的栗子培养的绿茶排名最高的感官评估
80 在四种绿茶样品中,T的感官评价最高。味觉得分70分 T、 80个 T和90 T分别为88.5、91和81.5(表1)S2). 80 它新鲜,香气浓郁,味道最好。70 它鲜嫩,有香味。品茶师对T样品的品评结果表明,T样品味道纯正,风味清爽,评分为82.5分。这些结果表明,板栗-茶间作对宝红绿茶的风味和香气有积极的影响,特别是对80年代种植的板栗茶。
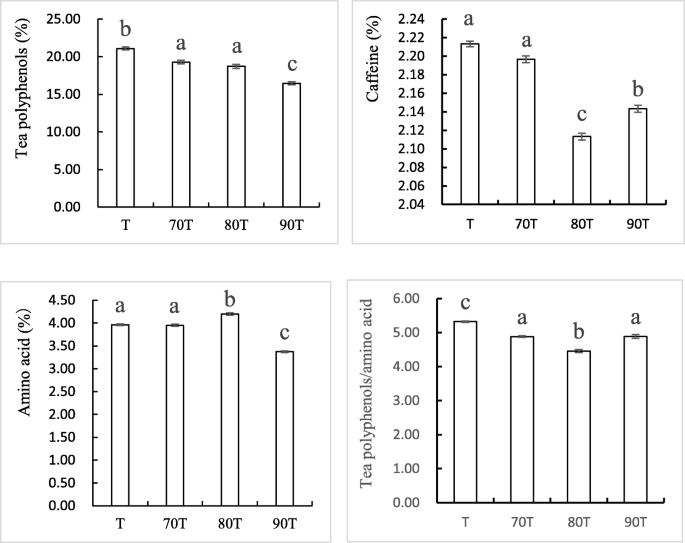
20世纪80年代间作板栗栽培的绿茶多酚氨基酸比最低
间作系统的宝红绿茶氨基酸含量较高,多酚含量较低,导致茶多酚与氨基酸的比值较低,尤其是80年代 T样品。这种低比率通常被认为是绿茶质量的一个良好指标[22.]. 这一结果与感官评定结果一致,表明80 绿茶味道最好。如图。1茶多酚含量为70 T、 80个 T和90 T分别为19.28%、18.73%和16.48%,低于T对照组(21.09%)。同样,他们的咖啡因含量分别为2.19%,2.12%和2.15%,再次低于T样品(2.22%)。
80年代 选择T样品作为间作样品,与单作样品进行代谢组学分析 T样品的感官评价最高,主要化学成分含量也最适宜。
间作和单作条件下的代谢物分布不同
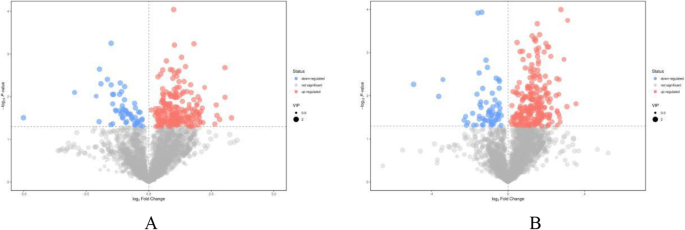
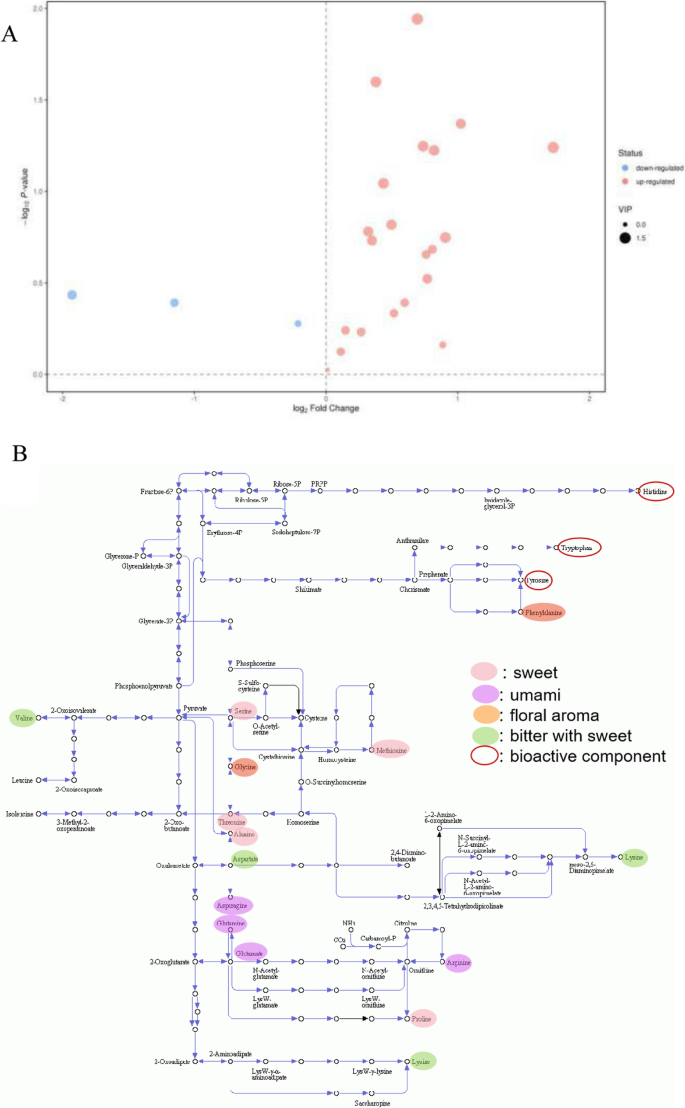
数字2给出了间作与单作条件下样品正、负电离模式下的基峰强度(BPI)色谱图。间作系统和纯茶系统样品的代谢产物差异显著。总的来说,3450和3538代谢物离子特征在两种模式下与两种培养系统不同(图1)S1),分别。火山图(图。2)表明,在间作与单一栽培中的间作下调的代谢物比下调的代谢产物更加上调,表明间产不仅造成代谢物的差异,而且促进了代谢物积累。
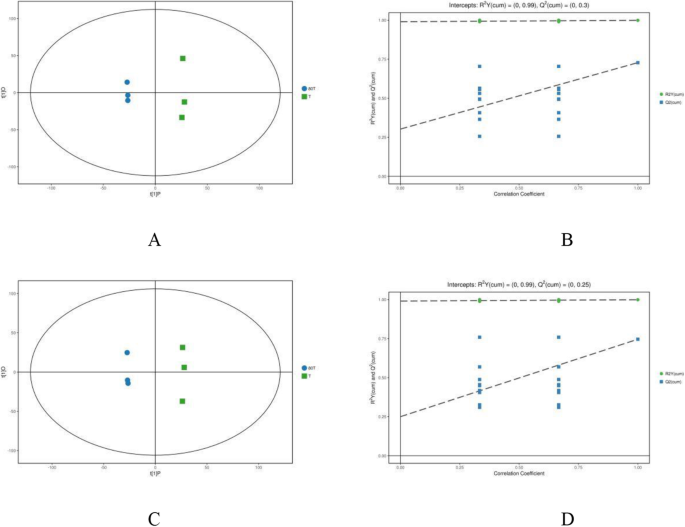
OPLS-DA模型都显示出良好的健康状况(R.2x)和高可预测性(问:2),0.478和0.728处于正模式(图。3.a)、0.445、0.746(图1)3.c)用于在间作与单一栽培中的样品。通过响应排列测试(RPT)确认OPLS-DA模型,揭示了过度拟合的情况(图。3.b和d),在我们的数据中没有发现假阳性。PCA评分曲线表明,间作与单作条件下茶叶的代谢特征存在显著差异。对两种阳性模式的数据建立四组分PCA评分图(R.2十 = 0.99,问:2 = 0.3) and negative modes (R.2十 = 0.99,问:2 = 0.25). All samples were in the 95% confidence interval (Hotelling’sT.-正方形椭圆)。
间作和单作条件下,MS2鉴定的许多代谢物存在差异
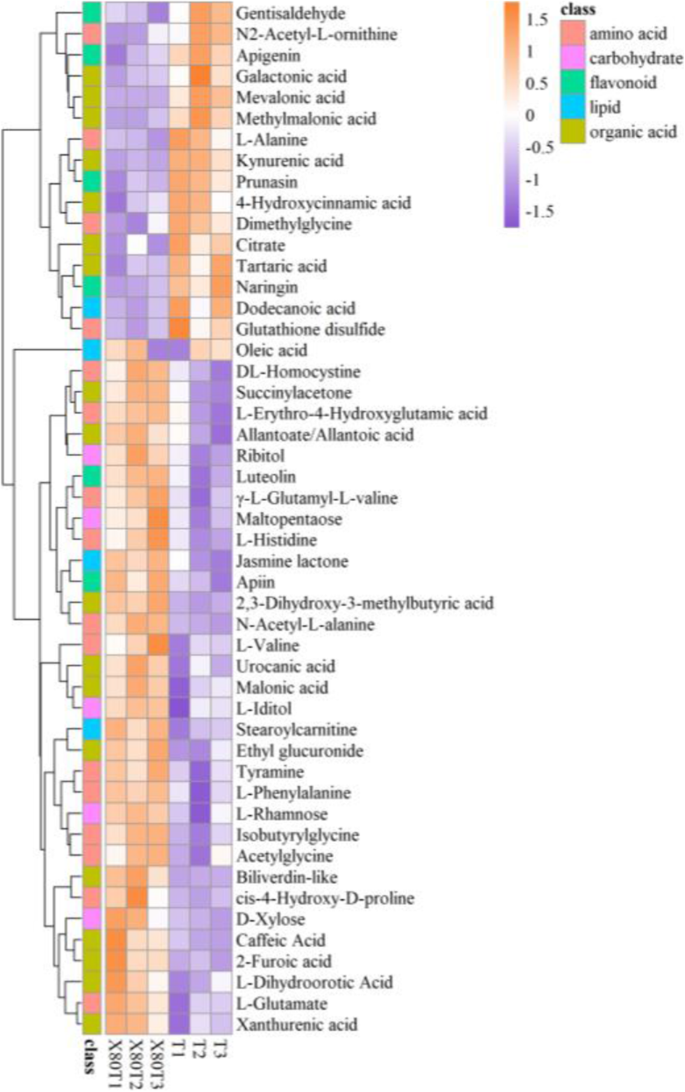
共有100种MS2代谢物,其中65种为阳性模式,35种为阴性模式,在间作与单作条件下差异显著(VIP>1.0,p<0.05)P.<0.05)取决于HMDB、PubChem、KEGG和METLIN代谢组数据库。不同的代谢物可分为氨基酸、有机酸、碳水化合物、脂质和类黄酮(表1)1). 这些化合物是风味化合物、生物活性成分或在制茶过程中释放挥发物的化合物,被认为是香气前体[23.]. 它们是鲜茶叶中最重要的基本物质,决定着茶叶的品质。绘制热图以获得样品之间代谢物的明显轮廓(图。4.). 不同的代谢物可以清楚地分为上调组和下调组,大多数(68%)是上调的。
为了更好地了解间作系统中茶叶代谢产物与茶叶品质之间的关系,我们在下面详细讨论了主要种类的差异代谢产物。
氨基酸
在基于非靶向代谢组科的非靶向与单殖民文献中,鉴定了11个上调和四个下调氨基酸。有趣的是,Theanine以两种模式上调,[1.06倍以正模式(VIP = 0.69和P. = 0.54)和1.48倍(VIP) = 0.94和P.= 0.40)],虽然不满足VIP>1.0和的统计条件P.<0.05. 茶氨酸是茶中最丰富和最重要的成分,主要负责其鲜味[24.].Theehine的差异在统计学上没有统计学意义,表明与间作相关的味道不依赖于Theanine。Theanine在味觉感知中的作用在这里没有否认,但它只表明在间作系统和纯茶园之间的茶碱含量差异。
为了验证游离氨基酸的含量,并且由于游离氨基酸对茶的风味至关重要,我们进一步利用靶向代谢组学对用于非靶向代谢组学的相同样品进行了游离氨基酸的深入分析。
靶向的代谢组科确定了21个上调和三个下调氨基酸在间作的与单一栽培中显示2还有无花果。5.A.γ-氨基丁酸(GABA)是一种非蛋白氨基酸,是茶叶中重要的生物活性成分,具有多种保健作用[25.],在间作样品中比单作样品中上调1.62倍。与单作相比,间作的l -丙氨酸(Ala)、l -脯氨酸(Pro)、丙氨酸(Phe)、l -丝氨酸(Ser)和l -谷氨酰胺(Gln)水平显著升高。
一半的上调的氨基酸在改善绿茶风味方面起到了作用,而没有一种下调的氨基酸能影响茶的风味。在促进风味的上调氨基酸中,L-蛋氨酸(Met)、脯氨酸(Pro)、丙氨酸(Ala)、L-苏氨酸(Thr)和丝氨酸(Ser)是甜味化合物;Glu、Gln、L-天冬酰胺(Asn)和L-天冬氨酸(Asp)有助于改善鲜味;苯丙氨酸和L-甘氨酸(Gly)产生花香[于和杨评论][18.]. 间作中Asn的表达上调幅度最大(3.30倍)。值得注意的是,对味觉做出最大贡献的氨基酸,如谷氨酸、天冬氨酸和谷氨酰胺,浓度在10000以上 为间作系统生产优质绿茶提供了丰富的原料。
为了更直观地显示上调的风味和生物活性氨基酸,它们用图1中的椭圆标记。5.b和颜色根据它们的特性进行编码:粉红色的甜,兰花的鲜味,橙色的花香,绿色的苦和甜。根据KEGG途径“氨基酸生物合成”(map01230),生物活性氨基酸以暗红色环表示。间作系统中丰富的上调氨基酸表明,间作系统的鲜叶更适合生产绿茶。
在间作与单甲醇中下调的氨基酸包括4-羟脯氨酸,1-甲基-1-组氨酸(1-MHI)和3-甲基-1-组氨酸(3-MHI)。甜味的识别阈值比在4-羟基脯氨酸中低于其他甜氨基酸,例如Pro,Ala和Thr [26.]. 1-MHis和3-MHis尚未被报道为味觉化合物。因此,我们推测间作条件下其下调可能对茶叶甜度影响不大,特别是在其他甜味氨基酸上调的情况下。
有机酸
在间作和单作条件下,我们检测到11种有机酸显著上调,7种有机酸显著下调。尿囊酸(尿囊酸的结合酸)上调幅度最大(3.3倍)。含咖啡因植物的咖啡因降解过程中存在尿囊素和尿囊酸盐;具体来说,咖啡因通过茶碱、3-甲基蒽醌、黄嘌呤和尿酸转化为尿囊酸[27.那28.]. 植物中尿囊素的相对含量可能反映了咖啡因的降解[29.]. 因此,我们推测咖啡因可能在间作系统中被降解为尿囊酸,导致尿囊酸的积累,这与间作中测得的较低咖啡因含量一致(图。1)。
在两种模式下,间作样品中的黄嘌呤(XA)含量均高于T样品,而kynurenic acid(KA)含量则低于T样品。XA和KA都是色氨酸降解的犬尿氨酸途径的组成部分[30,如图所示S3. 额外的差异丰富的有机酸可能是造成茶叶风味差异的原因。据报道,丙二酸和咖啡酸(上调)以及酒石酸和柠檬酸(下调)都有酸味[31]其含量的变化可能影响了间作系统绿茶与纯茶园绿茶风味的差异。
碳水化合物
糖酚醛糖,麦芽蛋白酶和D-木糖和糖醇核糖,L-iditol和D-Threitol在间作与单一栽培中的样品中全部上调。rhamnose显示出最大的上调(2.7倍)。D-麦芽蛋白,上调1.30倍,是一种低甜味的低聚糖,广泛用于食品工业,并具有营养和医疗保健的应用[32]. 右旋形式的木糖D-木糖被上调1.49倍;它被广泛用作食品和饮料中的糖尿病甜味剂,比D-葡萄糖甜得多[33]提示其对改善茶的口感有一定作用。
在间作与单一栽培中的样品中,糖醇也在各种量增加,并且最强烈上调的是D-血糖(2.21倍)。Ribitol,也称为Adonitol,被上调1.33倍;它由某些植物中的核糖还原并有助于核黄素的结构[34]. 乙二醇,上调1.40倍,是一种具有甜味的己糖醇,在食品工业中有应用。大多数糖醇都不如蔗糖甜。然而,它们的食物能量也较少,在当今食物和热量过剩的时代,这对人类健康尤为重要[35那36].
总的来说,甜度不同、口味不同的碳水化合物的增加,可能为间作样品冲泡的绿茶提供了原料,使绿茶更甜、更丰富,口感更好。
脂类
在间作与单一栽培中的样品中上调茉莉酸内酯,油酸和硬脂酰肉碱,并且仅下调十二烷酸。茉莉内酯和油酸分别上调1.21倍和1.68倍。
类黄酮
黄酮类化合物仅在阳性模式下检出;两个显著上调,四个显著下调。芹菜素增加1.76倍,芹菜素减少1.16倍。芹菜素(芹菜素7-O-芹菜葡萄糖苷)是一种水溶性二糖苷,其疏水性更强[37]间作的茶叶在食用时可提供更多的水溶性芹菜素。更重要的是,芹菜素没有味道,而芹菜素是苦的:因此,增加芹菜素和减少芹菜素应减少冲泡茶的苦味,增加其适口性。另外下调的黄酮类化合物包括柚皮苷和李子苷。木犀草素在间作和单作条件下被上调了1.53倍。综合以上结果,我们的结果表明,间作样品与T相比,苦味化合物芹菜素、柚皮苷和李子苷的含量较低,而无味化合物芹菜素的含量较高,这与他们的茶的更好的味道是一致的。
次级代谢物途径分析
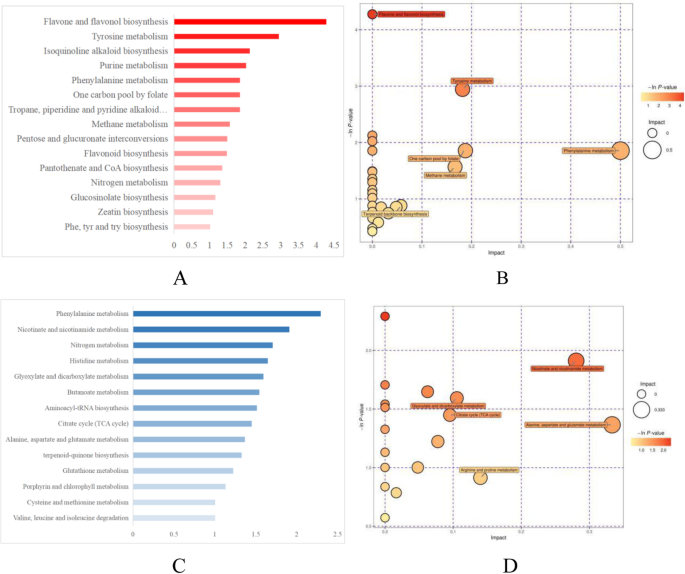
差异丰富的代谢物映射到KEGG数据库,如图所示。6.15代谢或生物合成途径(图。6.a,b)显示阳性模式和14的差异(图。6.c、 d)间作与单作条件下样品呈阴性模式(−项次(P) > 1).
在阳性模式下,黄酮和黄酮化生物合成途径显示出最大程度的变化。上调的肝素和叶黄素和下调的Apigenin参与了这种生物合成途径,并且Apiin和叶氏菌素位于Apigenin的下游,表明在间作系统中激活了Apiin和叶黄素生物合成的酶。叶黄素和Apigenin也参与了黄酮类生物合成。此外,柚皮素也被下调。此外,VAL和PHE似乎具有重要作用:它们一起参与了四种途径,包括氰基氨基酸代谢,氨基酰基-TRNA生物合成,2-氧代羧酸代谢,以及氨基酸的生物合成。糖和糖醇主要参与戊糖和葡糖醛酸酯互联和ABC转运蛋白。
在消极模式中,PHE代谢途径显示间作和单一栽培之间的差异。植物合成挥发性有机化合物的类型通过PHE代谢与周围环境相互作用[38].细胞存活不需要该途径的产品,但可以增加整个植物的健身。在我们的研究中,八种差异丰富的代谢物参与了phe代谢。PHE本身不仅参与了苯丙氨酸代谢,还参加了另外四个途径,突出了其多种功能和多功能性。一些与phe相关的代谢物也有利于芬芳的形成:苯吡咯酸具有轻微的蜂蜜样气味,反式肉桂酸具有轻的肉桂香气,而苯甲醛具有强果香,螺母状,花香和甜味。这些代谢物一起为绿茶香气生产提供丰富的原料。最后,苯乙基乙胺是一种神经递质,其在细胞外液中提高多巴胺水平,让人们感觉更积极和满足;它的存在可以解释为什么茶饮料可以在一定程度上改善情绪。
Glu和His同时出现在阴性模式下确定的前10个差异表达途径中的4个,表明它们具有多种功能。Glu单独参与丙氨酸、天冬氨酸和谷氨酸的代谢;碳代谢;2-氧代羰基酸代谢;乙醛酸和二羧酸代谢。同样,His单独参与β-丙氨酸代谢。
五种途径显示出阳性和阴性模式的显着差异:氨基酸的生物合成,氨基酸-TRNA生物合成,碳代谢,2-氧代羧酸代谢和ABC转运蛋白。与阳性和阴性模式中的氨基酸代谢相关的途径数量显着高:五个途径(氨基酸生物合成;精氨酸和脯氨酸代谢;甘氨酸,丝氨酸和苏氨酸代谢;酪氨酸代谢;和色氨酸代谢)定义两种模式和四种途径(氨基酸的生物合成;丙氨酸,天冬氨酸和谷氨酸代谢;仅在负模式中鉴定了β-丙氨酸代谢)。该结果表明,间间系统显着影响了氨基酸代谢,从而改变了氨基酸的积累和降解。结合靶向氨基酸代谢组学的结果,这些结果表明,与单一栽培相比,在间作中含有良好的味道的氨基酸,而无味的氨基酸较小。
讨论
上调的美味氨基酸可能是美味绿茶的原料,而下调对味道的反应不太响应
游离氨基酸有助于茶的味道,并且随着氨基酸浓度的增加而增加,味道强度增加[39那40].在先前研究中的绿茶提取物中鉴定了29个氨基酸,11个氨基酸负责茶输液和抗氧化剂和抗炎功能的质量12.那41].
氨基酸结合其独特的口味可以扩大新茶口味或功能的可能性。例如,天冬氨酸有点鲜味,而苯丙氨酸有点苦。而阿斯巴甜是这两种氨基酸的结合物,比糖甜200倍[42]. 天冬氨酸和苯丙氨酸的同时增加可为提高阿斯巴甜产量提供依据。综合以上结果,我们认为间作样品中多种甜味氨基酸、鲜味氨基酸和花氨基酸的上调可能是绿茶风味优良的直接原因。
与单作相比,间作样品中精氨酸(Arg)、缬氨酸(Val)、赖氨酸(Lys)、色氨酸(Trp)、酪氨酸(Tyr)、His等苦味氨基酸含量也存在显著差异。这六种苦味氨基酸可以进一步分为两类:精氨酸、缬氨酸和赖氨酸构成苦味和甜味,而Tyr、Trp和His是神经递质前体[43那44那45]. 由于其重要的生物活性,间作系统中氨基酸含量的提高可能会提高茶叶的保健效益。这些好处是茶叶质量的另一个方面。
m -his和3-m -his主要分别由anserine (β-alanyl-1-甲基组氨酸)和balenine (β-alanyl-3-甲基组氨酸)衍生,而且anserine和balenine都具有抗氧化功能[46]. 间作系统中1-MHis和3-MHis的下调可能反映了鹅绒碱和缬草碱形成1-MHis和3-MHis的能力降低,从而允许更多的鹅绒碱和缬草碱积累并发挥抗氧化功能。抗氧化剂可以通过清除活性氧(ROS)来保护细胞[47].他们还可以在食物治疗疾病和保护健康方面清除人类的自由基[48].在间作茶叶植物中的Anserine和Balenine的潜在积累需要进一步的实验调查,并可为茶的抗氧化作用提供新的证据。
上调的GABA可能对绿茶的增加的生物活性响应
GABA是中枢神经系统重要的抑制性神经递质,具有多种神经功能;人脑中GABA浓度的改变可能与多种神经系统疾病有关[49]. 富含GABA的食品由于其保健功能,近年来得到了积极的发展。各种富含GABA的食物,包括GABA茶,都在探索和生产中,据报道,摄入富含GABA的食物有助于预防糖尿病和控制或抑制癌细胞[50].GABA茶已作为日本高血压的人交付为商业产品。新鲜茶叶中的GABA含量较高,从间作系统较高,这表明该生产系统可用于勘探和生产加油茶。
有机酸可能有助于增加美味的味道和神经递质
尿囊酸盐对氮形态的转运和代谢至关重要宏碁是春季糖枫树液中的主要氮形态[51].部分复杂的枫叶源自在加热过程中发生的美丽反应,其中丙二醇蛋白和/或丙酸盐与SAP中存在的还原糖反应[52]. 在茶叶中,尿囊素可能参与氮的运输和代谢,并可能通过美拉德反应影响后续茶叶加工,改善间作样品中的茶叶风味。
XA合成途径被认为是减少3-羟基犬尿氨酸含量的部分解毒过程,3-羟基犬尿氨酸的自发氧化导致自由基形成和细胞凋亡[53]. XA作为具有神经活性的犬尿氨酸代谢产物之一,影响多种分子靶点和信号系统,广泛影响脑功能和神经传递[54]. 此外,XA可以减少DNA氧化损伤[55]. 尽管如此,尽管在茶叶中发现了KA,但在高等植物中,特别是茶树中XA的报道很少[56].这可能是间作系统中对XA的首次报道。
同样,在食品工业中,上调代谢产物2-糠酸也被报道用于改善风味和新鲜度[57]. 新鲜茶叶在生产过程中蒸制后,茶叶的有机酸组成发生变化:有的降解,有的酯化,有的有不同程度的增加[58].因此,鲜叶中存在的有机酸为茶的最终风味提供了原料,并在加工过程中影响风味物质的形成,除了简单地促进其自身的酸味外。绿茶中的有机酸也能抑制苦味,延缓对甜味的感知,尤其是柠檬酸能保持茶的口感[59].此处的替代有机酸可能是来自间作系统的改善的绿茶风味,尽管它们中的一些以极低的量存在,并且很少在茶叶中报道。
上调的碳水化合物都有助于甜味
单糖和低聚糖及其相应的糖醇是甜的,只有少数例外[60]. 虽然最重要的甜味剂是蔗糖,但其他糖和糖醇也很重要,它们的甜味质量和味道强度不同,提供的甜味程度也不同[61].茶中的游离糖的存在也是对儿茶素合成至关重要的,有助于可溶性固体,并在加工过程中促进风味组分的生物合成[62]. 因此,碳水化合物的上调有可能改善冲泡绿茶的口感。
rhamnose,普及对细菌的高等植物[63]; 其甜度为蔗糖的33%,可用作甜味剂[61].当鼠李糖和葡萄糖同时消失,味觉就消失了[64]这一结果突出了鼠李糖在茶的味道中的重要作用,尽管它的甜度相对较低。
Jasmine内酯有助于果味,甜味,花香香气和油酸对健康益处
茉莉内酯是一种内酯类香气成分,具有浓郁的桃子和杏子香味,天然存在于茉莉油、栀子、百合、茶叶和其他植物中,有助于形成茶的果香和花香[65].茉莉内内酯是茶中重要的香气成分之一[66]茉莉内酯的上调可能有助于解释间作绿茶香气浓郁的原因。油酸是一种C18:1的单不饱和脂肪酸,新鲜茶叶富含油酸,在茶叶加工过程中可以分解[67]. 油酸对细胞健康、心脏健康、体重控制、脑功能和2型糖尿病有许多有益的作用[68]. 油酸在间作系统中有助于提高绿茶品质,提高茶叶品质。
黄酮类化合物可降低间作绿茶的苦味,增加绿茶的溶解度
柚皮苷是一种常见的植物黄酮苷,对茶叶有苦味[69]. 柚皮素是柚皮苷的苷元,被黄烷酮合酶氧化为芹菜素[70]. 产氰葡萄糖苷prunasin是杏仁苷的前体,也是植物中苦味的主要来源[71]. 间作样品中黄酮类化合物的分布与苦味降低和黄酮类化合物溶解度增加一致,这可能改善了绿茶的口感和生物活性。
叶氏菌素提供特异性的抗炎和抗致癌作用,并控制癌细胞的发展[72]. 木犀草素与癌细胞的相互作用类似于EGCG,EGCG是一种绿茶多酚抑制肿瘤[73].此外,还据报道,肝病展示抗炎和抗癌的功能[74].事实上,许多黄酮类化合物起到自由基清除剂,以保护人类免受自由基[75].
与黄酮类化合物相关的途径包括许多具有不同代谢功能的次生代谢产物,包括色素合成、胁迫反应和病原防御等[76]这些在茶树中都是非常重要的。在以往的研究中也发现了这些途径的显著变化[77].
结论
80年代在宝红山建立的板栗-茶间作系统中种植的植物酿造的绿茶 T) 感官评价最高,茶多酚与氨基酸的比例最低。采用基于LC-QTOFMS的非靶向代谢组学、uhpc-MS/MS靶向代谢组学和多变量分析相结合的方法,研究了间作系统鲜茶叶与纯茶树栽培系统鲜茶叶代谢谱的差异。我们鉴定了100种差异丰富的代谢物,包括氨基酸、有机酸、脂类、碳水化合物以及类黄酮。许多与风味和生物活性有关,似乎为改善绿茶品质提供了丰富的原料,包括更好的口感和更大的健康效益。与风味和生物活性关系最密切的两条途径黄酮和黄酮醇的生物合成以及苯丙氨酸的代谢在正模式和负模式上分别表现出最大的差异。两种种植方式的茶树叶片氨基酸代谢途径存在差异,说明间作方式对氨基酸代谢影响较大,改变了氨基酸的积累和降解。这些结果加深了我们对板栗-茶叶间作体系中茶叶品质改善的代谢机制的认识,有利于在土地资源日益短缺的现状下科学推进板栗-茶叶间作体系。至于代谢物水平改变的原因,可能包括多种因素,包括树木提供的遮荫、树木与茶树之间潜在的化感作用、它们根系之间的地下相互作用、落叶树木产生的有机物质的积累等。,所有这些都需要今后进一步调查。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。本研究中使用和/或分析的数据集可根据合理要求从相应作者处获得。
缩写
- 方差分析:
-
方差分析
- 原料药:
-
基峰强度
- CE:
-
碰撞能量
- ISVF:
-
离子喷涂电压浮动
- KEGG:
-
京都基因和基因组百科全书
- LC-MS:
-
液相色谱-质谱联用
- m/z码:
-
质荷比
- 女士:
-
质谱
- MS2:
-
第二种质谱仪
- OPLS-DA公司:
-
隐结构判别分析的正交投影法
- PCA:
-
主成分分析
- QC:
-
质量控制
- 数量:
-
四极飞行时间
- ROS:
-
反应性氧气
- RT:
-
保留时间
- UHPLC:
-
超高效液相色谱法
- 贵宾:
-
投影中的变量重要性
工具书类
- 1。
王Y,高LP,山Y,刘yj,田YW,xia t.阴影对黄酮类生物合成的影响(山茶花Sinensis.(L.)O.Kuntze)。科幻电影。2012;141:7–16.
- 2。
Janendra WA、DeCostal M、Mohotti AJ。茶的生态生理学。植物生理学杂志。2007;19:299–332.
- 3.
利伯曼M,戴克E。轮作与间作杂草管理策略。Ecol应用。1993;3:92–122.
- 4.
辛格A、韦瑟W、汉娜R、霍姆尼R、兹廷斯卡SE。减少有害生物,提高产量,为喀麦隆黄秋葵农民提供高密度间作效益。害虫管理科学。2017;73:2017–27.
- 5.
支XY,韩YC,邢FF,雷YP,王GP,冯L,杨BF,王ZB,李XF,熊SW,范ZY,李YB。棉花光截获和碳水化合物分配对单作、麦间作和麦后直播等种植制度的响应如何?公共科学图书馆一号。2019;14:e0217243。
- 6.
戴J,邱W,王N,Nakanishi H,Zuo Y.间断花生和玉米根系的比较转录组分析揭示了对花生铁营养的新颖见解。植物理性生物化学。2018; 127:516-24。
- 7.
Craswell et,Sajjapongse A,Howlett DJB,Dowling AJ。亚洲和太平洋倾斜土地管理中的农业遗产。Agrofor Syst。1998年; 53:121-37。
- 8.
Chauhan SK,Gupta N,Walia R,Yadav S,Chauhan R,Mangat PS.印度灌溉农业生态系统中杨树-小麦间作系统的生物量和碳吸收潜力。农业科学技术杂志。2011;1:575–86.
- 9
Xue J,Tang R.中国树茶间交流系统的实践与调查。int树作物J. 1998; 9(3):179-85。
- 10。
郭Z,张Y,Deegen P,Uibrig H。海南橡胶茶园与橡胶茶间作经济分析。农林系统。2006;66:117–27.
- 11.
李强,史旭,赵强,崔艳,欧阳娟,徐峰烹饪方法对板栗营养品质及挥发性物质的影响(齿栗叶mollissima布卢姆)。食品化学。2016;201:80-6。
- 12.
王宏、吴莉、周敏。北方板栗茶树间作对茶树生长及茶叶品质的影响。农业气象杂志。2005;26(2):139–41.
- 13。
万义,刘克,周M.栗子茶与茶叶植物园重大生态因素研究。Nonwood Forest Res。2009; 27(3):57-60。
- 14
Ma yh,fu s,zhang x,zhao k,chen hyh。间作改善土壤养分可用性,土壤酶活性和茶度数量和质量。苹果土壤Ecol。2017; 119:171-8。
- 15
于乐、刘乐、陈思杰、王乐、史乐。栗茶间作条件下茶树根系的基本特征。2006年非木材森林研究;24(3):6–10.
- 16
DAS PR,KIM Y,HONG SJ,EUN JB。通过不同的提取技术获得的挥发性和非酚醛化代谢物 - 氨基酸,有机酸和糖的仿形物的分析。食品化学。2019; 296:69-77。
- 17
Saeed M、El Hack MEA、Alagawany M、Naveed M、Arain MA、Arif M。绿茶的植物化学、作用方式及有益健康的应用(山茶花Sinensis.)在人类和动物中。int j pharmacolol。2017; 13(7):698-708。
- 18
yu zm,杨z.了解茶叶中蛋白质和非蛋白质氨基酸形成的不同调节机制(山茶花Sinensis.)提供了新的洞察力,以安全有效地改变茶叶和功能。CRIT REV FOOD SCI NUTR。2020; 60:844-58。
- 19
Kellogg JJ、Graf TN、Paine MF、McCune JS、Kvalheim OM、Oberlies NH、Cech NB。评估复杂植物制剂绿茶变异性的代谢组学方法比较(山茶花Sinensis.)作为案例研究。《国家生产杂志》,2017年;80(5):1457–66.
- 20
曾策,林希,刘志新,刘志新。安吉白茶幼枝分析(山茶花Sinensis.),利用基于非靶向lc - ms的代谢组学。J Food science . 2019; 84:1746-57。
- 21
朱乙、李丽、魏赫、周伟、周伟、李芙、林平、盛杰、王Q、闫丙、程Y。采用亲水作用液相色谱-串联质谱联用技术,建立了同时测定细胞中40种内源性氨基酸及其衍生物的定量分析方法。塔兰塔。2020;207:120256.
- 22。
李NN,吕JL,李QS,郑XQ,王XC,王L,王YC,丁CQ,梁YR,杨YJ。对色素缺乏型茶树品种‘小雪芽’的化学成分和相关基因表达的解剖揭示了一种白化表型和代谢产物的形成。前植物科学。2019;10:1543.
- 23。
杜孙A, Güler Z, Şekerli YE。四砖纸盒包装的超高温牛奶中挥发性化合物和有机酸的表征。Int J Food Prop. 2017; 20:1511-21。
- 24。
方R,雷德芬SP,柯库普D。茶氨酸、酚类和甲基黄嘌呤化合物在21个茶树品种中的变异山茶花Sinensis.在不同的季节收获。食品化学。2017;220:517–26.
- 25。
廖吉,吴谢,兴宗,李Qh,段y,方wp,zhu xj。γ-氨基丁酸(GABA)在茶中积累(山茶花Sinensis.L.)通过缺氧下的GABA分流和多胺降解途径。JAgric Food Chem。2017; 65:3013-8。
- 26
Belitz HD,Chen W,Jugel H,Treeleano R,Wieser H,Gasteiger J,Marsili M.甜味和苦味的化合物,结构和品味关系。食物味道化学。1979年; 4:93-131。
- 27
Ashihara H,Crozier A.植物中咖啡因和相关嘌呤生物碱的生物合成和代谢。ADV BOT RES。1999; 30:117-205。
- 28
Mazzafera公司。咖啡因在植物和微生物中的分解代谢。前Biosci。2004;9:1348–59.
- 29
Mohanpuria P、Kumar V、Joshi R、Gulati A、Ahuja PS、Yadav SK。茶叶中咖啡因的生物合成与降解[山茶花Sinensis.(L.)O。在发育和季节性调节下。摩尔生物技术公司。2009;43:104–11.
- 30.
哈德兰R.Zsizsik公司。甲藻中犬尿氨酸和3-羟基犬尿氨酸形成犬尿氨酸和黄嘌呤酸,一种新的氧化途径的作用。通用域名格式。生物化学生理学C部分毒理药理学。2002;133:383–92.
- 31
Muchuweti M,Zenda G,Ndhlala Ar,Kasiyamhuru A.糖,有机酸和Ziziphus Mauritiana果实的酚类化合物。EUR FOITE RECONGOL。2005; 221:570-4。
- 32
Ali MB、Mhiri S、Mezghani M、Bejara S。非典型麦芽六糖形成α-淀粉酶的纯化及序列分析。嗜热脂肪菌US100。酶微生物技术。2001;28(6):537–42.
- 33
罗比特JF。甜蜜。碳水化合物化学基础;1998年。142–56.
- 34。
Derollez P,Guinet Y,Affougarf,Danèdef,Carpentier L,HédouxA.通过粉末X射线衍射的L-阿拉伯醇的结构测定。Acta Crystallogr B. 2012; 68:407-11。
- 35。
范恩斯·阿吉。膳食能量密度对糖醇替代糖的影响。生产营养物质。1991;50(2):383–90.
- 36。
风马,阮TM。山梨醇与木糖醇预防龋齿的比较。安,你的医生。2000;34:98–100.
- 37。
超临界二氧化碳萃取法从预处理过的西芹叶中提取芹菜素,以提高得率。食品科学与技术;2018;24(1):63-73。
- 38
Dong F,Yang Z,Baldermann S,Kajitani Y,Ota S,Kasug H,Imazeki Y,Ohnishi T,Watanabe N。香茅花中l-苯丙氨酸代谢为苯乙酮和1-苯乙醇的特性山茶花Sinensis.使用稳定同位素标记。植物生理学杂志。2012;169(3):217–25.
- 39
Ekborg-Ott KH, Taylor A, Armstrong DW。茶叶中茶氨酸总成分和对映体成分的品种差异。农业食品化学,1997;45:353-63。
- 40。
Narukawa M,Morita K,Hayashi Y。L-茶氨酸与5′-单磷酸肌苷一起引起鲜味。生物技术生物化学。2008;72(11):3015–7.
- 41。
李LS,金SH,金YB,金YC。不同采摘期绿茶主要成分的定量分析及其抗氧化活性。分子。2014;19:9173–86.
- 42。
精益MEJ,Hankey Cr。阿斯巴甜及其对健康的影响。BMJ。2004; 329:755。
- 43
小川T、中村T、筑地E、三宅男Y、中川H、平川H、内田T。L-精氨酸和氯化钠对氨基酸溶液苦味抑制的联合作用。化学制药公牛。2004;52:172–7.
- 44
宫崎骏。亚临界水浸提改善绿茶苦涩的研究。食品科学技术研究,2013年;19(3):471–8.
- 45
Moya Garcia AA、Medina MA、Sánchez Jiménez F。哺乳动物组氨酸脱羧酶:从结构到功能。生物测试。2005;27(1):57–63.
- 46。
吴国庆。氨基酸、新陈代谢、功能和营养。氨基酸。2009;37:1–17.
- 47。
邵H,朱L,邵M,贾利尔CA,米H。环境胁迫下高等植物抗氧化剂与氧化还原信号转导。C R生物。2008;331(6):433–41.
- 48。
Devasagayam TPA,Tilak JC,Boloor KK,Sane Ks,Ghaskadbi SS,Lele Rd。人类健康中的自由基和抗氧化剂:现状和未来的前景。j associens印度。2004; 52:794-804。
- 49。
Ben Ari Y、Khalilov I、Kahle KT、Cherubini E。GABA在脑成熟和神经系统疾病中的兴奋性/抑制性改变。神经学家。2012;18:467–86.
- 50
Dhakal R、Bajpai VK、Baek KH。微生物生产γ-氨基丁酸的研究进展。Braz微生物学杂志。2012;43(4):1230–41.
- 51
巴恩斯RL。小麦叶片腺嘌呤合成尿囊素和尿囊酸的研究糖槭L自然。1959;184:1944.
- 52。
佩里JJ,菲奥雷MC。枫树汁液微生物群及其对枫糖浆品质的影响。《国际食品评论》,2020年。https://doi.org/10.1080/87559129.2020.1788579。
- 53。
魏H,利兹P,Chen Rw,Wei W,Leng Y,Bredesen de,Chuang DM。通过3-羟基脲烯酮的药理浓度诱导的神经元凋亡,丁醇和BCL-2过表达的表征和保护。J neurochem。2000; 75:81-90。
- 54。
Fazio F、Lionetto L、Curto M、Lacovelli L、Copeland CS、Neale SA、Bruno V、Battaglia G、Salt TE、Nicoletti F。朱砂酸和黄嘌呤酸:与代谢型谷氨酸受体相互作用的两种犬尿氨酸代谢物。神经药理学。2017;112:365–72.
- 55
Lopez-Burrillo S,Tan DX,Mayo JC,Sains Rm,Manchester LC,Reiter RJ。褪黑激素,X硫酸,白藜芦醇,EGCG,维生素C和脂肪酸差异地降低了FENTON试剂诱导的氧化DNA损伤:对其个人和协同作用的研究。j pineal res。2003; 34:269-77。
- 56
Yilmaz C, Özdemir F, Gökmen V.不同类型茶叶中游离氨基酸、生物活性和神经活性化合物的研究及其对红茶加工的影响。轻型。2020; 117:108655。
- 57
Hucker B,瓦雷塞斯P. 2-糠酸的热脱羧及其在食品中形成呋喃的含义。食品化学。2011; 126:1512-3。
- 58。
Sanderson GW,塞尔文德兰RR。茶树中的有机酸。硅胶分离非挥发性有机酸的研究。食品农业科学杂志。1965;16(5):251–8.
- 59。
Chaturvedula VSP,Prakash I.茶的香气,味道,颜色和生物活性成分。J MED植物RES。2011; 5(11):2110-24。
- 60
罗杰斯WJ,米肖S,巴斯汀M,布切利P。不同罗布斯塔品种籽粒发育过程中糖、糖醇、肌醇、羧酸和无机阴离子含量的变化(中粒咖啡)和阿拉比卡(C。阿拉比卡咖啡。植物SCI。1999; 149(2):115-23。
- 61
Belitz HD、Grosch W、Schieberle P。糖,糖醇和蜂蜜。食品化学;2004年。862–91.
- 62
徐一秋,陈思琦,袁海斌,唐平,尹建福。不同固体浓度绿茶浓缩液中奶油形成的分析。食品科技。2012;49(3):362–7.
- 63
Giraud MF,奈史密斯JH。鼠李糖途径。货币结构生物学。2000;10(6):687–96.
- 64。
霍洛维茨RM,Gentili B。酚苷的味道和结构。农业食品化学杂志。1969;17:696–700.
- 65。
曾令堂,周奕,傅XM,廖YY,袁YF,贾YX,董F,杨ZY。茶叶中茉莉内酯的生物合成(山茶花Sinensis.)叶片及其形成对多重胁迫的响应。农业化学学报。2018;66:3899-909。
- 66。
王X,王D,李J,叶C,久保田K。可可茶的香气特征(毛叶茶Chang)。生物化学学报。2010;74(5):946-53。
- 67
钟泰,郭,廖震,谢烨,杨ml,cheng ml,wu cc,tzen jtc。粘土茶壶表面涂层茶叶脂质化合物的分析。J食物药物肛门。2015; 23(1):71-81。
- 68
销售Campos H、Reis de Souza P、Crema Peghini B、Santana da Silva J、Ribeiro Cardoso C。油酸对健康和疾病的调节作用综述。迷你版医学化学。2013;13(2):201–10.
- 69
Pękal A、Biesaga M、Pyrzynska K。不同类型茶叶中的微量金属和黄酮类化合物。食品科学与生物技术。2013;22:925–30.
- 70。
大山K,近藤T。丹参蓝花色素组分芹菜素7,4′-二-O-β-吡喃葡萄糖苷及7种手性类似物的全合成。四面体。2004;60(9):2025–34.
- 71
Sánchez-pérezr,howad w,garcia-mas j,arúsp,martínez-gómezp,dicenta f.杏仁内核苦涩的分子标记。树遗传学基因组织。2010; 6:237-45。
- 72
Seelinger G、Merfort I、Schempp CM。木犀草素的抗氧化、抗炎和抗过敏活性,木犀草素是一种从染料中提取的黄酮淡黄木犀草L. planta med。2008; 74:1667-77。
- 73
陈丽,庄海辉。绿茶多酚的防癌机制(−)-表没食子儿茶素没食子酸酯。分子。2007;12:946–57.
- 74
Siddique YH,Beg T,Afzal M. Apigenin对抗癌药物的抗原毒性作用。毒素体外。2008; 22(3):625-31。
- 75
Moridani MY、Pourahmad J、Bui H、Siraki A、O'Brien PJ。膳食黄酮铁复合物作为细胞保护性超氧自由基清除剂。自由基生物医药。2003;34(2):243–53.
- 76
Ferreyra MLF,Rius SP,Casati P.Flavonoids,生物合成,生物功能和生物技术应用。前植物SCI。2012; 3:222。
- 77。
刘丽丽,李云英,佘国标,张学成,Jordan B,陈强,赵军,万学成。代谢物分析和转录组分析揭示了uvr8介导的信号转导途径在调节茶树类黄酮生物合成中的重要作用(山茶花Sinensis.)作为对阴影的回应。BMC植物生物学。2018;18:233.
致谢
感谢中国云南宝红茶场董事长苏天水先生为本次研究所做的抽样工作,对抽样地点的详细介绍,以及提供蒸绿茶。我们非常感谢中国上海碧欧特生物技术有限公司对代谢组学分析的建议。我们也衷心感谢资深品茶师沈小金女士和周金燕女士对茶叶样品感官评价的支持。
资金
这项工作得到中国教育部中国西南山区森林资源保护利用重点实验室(KLWWF-20440)和中国学术委员会(201908535030)基金的资助。我们设计了本研究,收集和分析了前一笔资金资助下的数据,并在后一笔资金资助下完成了弗吉尼亚理工大学的手稿撰写和修改。
作者信息
从属关系
贡献
TW设计实验,对代谢组学数据进行分析,完成实验稿;参与茶叶感官评价,完成茶叶主要功能成分的检测和数据分析;ZL协调实验取样现场,组织取样和茶叶感官评定;DP参与代谢组学数据的采样和分析;BZ对实验设计提出了许多建设性的建议,并对稿件进行了多次修改。所有作者都已阅读并批准了手稿。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者声明他们没有相互竞争的利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充资料
附加文件1:图S1。
用液相色谱-质谱法测定了80份茶叶样品中正(A)和负(B)离子模式的总离子流 间作与单作。图S2。80t(间作)和80t(单作)中随机选择的氨基酸绝对定量箱形图。每个盒子里都有来自80t和T样本的氨基酸浓度。图S3。色氨酸降解为KA和XA的示意图。表S1。茶叶样品的基本信息。表S2。绿茶样品的感官评价
权利和权限
开放访问本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非信用额度中另有规定。
关于这篇文章
引用本文
吴涛,邹瑞,濮德培。等。茶树非靶向和靶向代谢组学分析(山茶花Sinensis.)针对其与板栗间作。BMC植物生物学21,55(2021)。https://doi.org/10.1186/s12870-021-02841-021-02841-021-02841-021-02841-0.
关键词
- 山茶花Sinensis.
- 板栗
- 氨基酸
- LC-MS.
- 农林复合经营
- 代谢途径