摘要
背景
叶色是叶菜育种中的一个重要性状。Y-05,一种小白菜(芸苔属植物拉伯ssp.对)栽培品种,在冷适应后显示黄色内(yin)和绿色外叶(GOU)。然而,这种特殊表型的机制仍然难以捉摸。
结果
我们假设Y-05的黄叶表型可能由低叶绿素含量引起。颜料测量和透射电子显微镜(TEM)分析表明,黄色表型与叶绿素中叶绿素含量和未发育的氯蛋白含量下降密切相关。接下来对阴和沟进行转录om和代谢物测序。转录om数据表明,阴和沟叶之间的4887个差异表达基因(DEG)主要富含叶绿素和叶绿素相关类别,表明叶绿素生物合成在冷驯化过程中主要受影响。与代谢物数据一起,抑制叶绿素生物合成的抑制因黄色内叶中的封闭的5-氨基乙酰丙烯酸(ALA)合成而导致,其通过ALA的互补和抑制实验进一步验证。此外,我们发现阻断的ALA与增加密切相关brflu.表情,因冷适应而间接改变。在brflu沉默的小白菜Y-05中,与对照相比,冷驯化的小白菜叶片仍表现出绿色表型,叶绿素含量较高,这意味着沉默brflu.能挽救因冷驯化引起的叶片变黄。
结论
我们的研究结果表明,冷适应可以间接促进表达brflu.在Y-05内叶中抑制ALA的合成,导致叶绿素含量降低,叶片变黄。本研究揭示了冷驯化Y-05叶片颜色变化的潜在机制。
背景
叶片颜色由色素决定,色素主要包括叶绿素、类胡萝卜素和花青素[1,2].植物叶片颜色的变化通常是由多种因素引起的,可以通过多种方式实现[3.],例如叶绿素生物合成及分解[4]叶绿体组装[5和植物抗病的信号转导[6].许多植物的叶子颜色是绿色的,这是由叶绿素提供的。叶绿素,光合作用的基本辅助因子[2,已研究多年[7,8].叶绿素使植物能够通过光合作用使用阳光。保持叶绿素正常状态和水平对于光合效率和碳固定至关重要[9],然后直接影响植物的生长和发育[10,11].
许多chl缺乏的物种,也称为叶色突变,它们在叶绿素合成或降解机制上表现出显著的变化,在不同的物种中表现出不同的表型,被认为是探索叶绿素生物合成机制的合适材料[12,13,14,15].例如,在水稻中,ChlD和ChlI的保守氨基酸发生了一些错义突变chl1和chl9分别突变体。chl1和chl9突变体表现出堆叠不良的甘蓝且欠发达叶绿体[16].另一种颜色突变F03-06在拟南芥,由隐性单核基因控制AT5G54810,基因沉默的植株表现出类似的表型F03-06,叶片呈黄色,叶脉斑驳,生长缓慢[17]. 稳定遗传的芸苔属植物植物黄化突变(pem)启动子的DNA序列变异Bra024218,显示出延迟叶绿体发育,降低叶绿素含量和降低光合作用容量[18].叶绿素(Chl)缺陷突变体pylm小白菜叶片呈黄色,总Chl含量降低,基粒片层结构松散,类囊体堆积少,光合活性和光化学转换效率降低,这是由于Chl的阻断所致一个Chl生物合成相关基因的产生和下调[19].与四三肽重复序列(TPR)蛋白同源的REC蛋白功能缺失突变体的叶绿素含量较野生型低,叶绿体间隔面积较小拟南芥[20.].Pentatricopeptide repeat (PPR)蛋白,其基序被认为是从TPR蛋白进化而来,与包括温度敏感的褪绿病在内的多种功能有关[21,22].在这些叶片颜色突变中,在室温下表现为正常或接近正常的叶片颜色,但在低温下表现为显著的叶片颜色变化,被鉴定为低温敏感型[23].选择基于多组学数据库的多种分析方法,全面探索低温敏感型包括茶叶(茶树l .) [24)、大米(栽培稻l.) [21),五彩瓷(芸苔属植物定l .) [9在分子或蛋白质水平上。然而,叶片颜色变化对低温的响应机制尚不完全清楚。
叶绿素在叶绿体中合成,并分布在叶绿体的类囊体膜上[25].叶绿素生物合成的一般过程由三个主要步骤组成:(1)由谷氨酸生成5-氨基乙酰丙酸(ALA),(2)由ALA生成原卟啉IX,(3)由原卟啉IX生成叶绿素[26].ALA作为参与叶绿素生物合成和植物绿化的关键前体而受到人们的关注[27,28].已显示ALA的外源性应用来增加植物的叶绿素含量[29,30.,31].以往的报道表明,ALA是由C5由两个步骤组成的途径[32].首先,在谷氨酰- trna还原酶(GluTR)的作用下,Glu-tRNA转化为glu -1-半醛(GSA)。第二,GSA通过GSA-2,1-氨基变异酶(GSA- am)的作用转化为ALA [33].GluTR和GSA-AM是由细胞核编码的丙烯酸-和格萨基因分别。ALA合成的酶中,Glutr被认为是主要限速步骤[34]. 蓝光荧光蛋白(FLU)是一种四三肽重复序列(TPR)蛋白,是ALA合成的负调控因子。以前的研究表明,流感病毒蛋白可以与GluTR的C末端片段相互作用,使ALA合成失活,导致叶绿素含量降低和幼苗黄化[35,36].在FLU-overexpression (FLUOE)拟南芥, flue株系在中光下叶片呈淡色,在弱光下叶片呈黄绿色,这是因为叶绿素含量降低[37].此外,另一个调节GluTR的因子是GluTR结合蛋白(GBP)。GBP已被证明与GluTR的n端区域相互作用,保护GluTR免受降解,维持足够的ALA合成[34].
Pakchoi(芸苔属植物拉伯ssp.对)是大白菜的亚种,是亚洲广泛消耗的蔬菜,特别是在中国。由于Pakchoi的主要食用器官是叶子,叶子颜色是繁殖中的重要性状。Y-05是一种特殊的Pakchoi品种,展示在正常情况下生长的绿叶,但在冷置于冷置时显示黄内(yin)和绿色外部(GOU)。由于其特殊的表型,Y-05被认为是冷适应叶子颜色变化研究的有趣和有价值的材料。迄今为止,对y-05对冷适应的响应的叶子颜色变化几乎没有研究,其颜色转换机制仍然难以捉摸。在这里,我们的目的是在生理,细胞和分子水平上表征Pakchoi Y-05的变化的叶子颜色。我们的研究结果有助于了解冷适配的Y-05,显示黄色内部和绿色外叶。这些发现还丰富了我们对叶子颜色变化机制的理解。
结果
冷置y-05的内叶片表现出降低的叶绿素含量和未发育的囊体
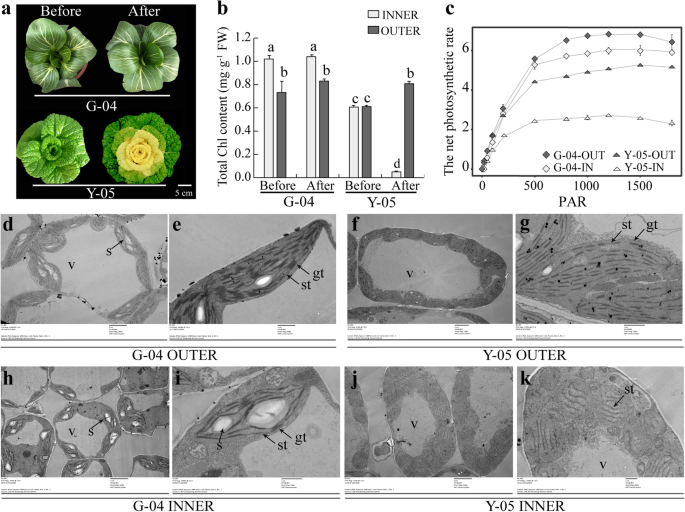
与小白菜品种G-04的绿叶相比,Y-05冷驯化后的内叶呈黄色,外叶呈绿色。1a).因此,我们对G-04和Y-05在不同生长条件和时期的色素进行了测定。有趣的是,与G-04的叶片和Y-05的叶片相比,黄色的内叶和绿色的外叶的含量都有所下降(图4)。1b,无花果。S1).一般情况下,类胡萝卜素、叶黄素和花青素的含量增加而不是减少,这可能导致黄叶表型[1,2].因此,我们认为Y-05的黄叶表型可能与叶绿素含量低有关。
冷驯化Y-05的内叶叶绿素含量降低,类囊体不发达。一个G-04和Y-05在冷驯化前后的表型。冷驯化时,2月龄的Y-05植株在4°C下生长3周,然后再回到23°C继续生长。以前,以前冷的适应。经过,经过寒冷的适应。条= 5厘米。by-05和G-04在冷置适应之前和之后的外叶片的总叶绿素含量。c净光合速率(Pn(Y-05和G-04的内外叶片)。PAR,光合有效辐射。测定了各品种3株单株的叶绿素含量和磷含量n测量三次。误差条代表SE(±SE,n= 3)。不同的字母表示在统计学上的显著差异p < 0.05.d-kG-04和Y-05冷驯化后叶片内外叶绿体超微结构的研究。V =液泡,s =淀粉粒,gt =颗粒类囊体,st =基质类囊体。在无花果。1d, f, h, j, Bar = 4 μm。在无花果。1e, g, i, k, Bar = 1 μm
叶绿素是植物进行光合作用的主要色素,位于叶绿体的类囊体膜中[38].为了验证我们的假设,我们检查了光合能力(Pn)冷适配的Y-05和G-04之间的外叶和内叶。与我们的预期相比,与冷适配的G-04的外叶和内叶相比,冷适配的Y-05的外叶和内叶具有显着降低的净光合速率(图。1c)。
接下来,我们进一步利用透射电镜(TEM)研究了冷驯化G-04和Y-05叶片内外叶绿体的超微结构。低温驯化的G-04外叶中有大量成熟的叶绿体和粗粒类囊体(图2)。1d, e),发育中的叶绿体和薄粒类囊体(图。1h, i)。在冷驯化的Y-05中,与G-04的外叶相比,绿色的外叶表现出成熟的叶绿体,但基粒堆积更薄(图4)。1而Y-05内叶呈黄色,叶绿体发育不全,类粒类囊体几乎消失(图2)。1结果表明,Y-05内叶呈黄色,可能是由于低温驯化导致叶绿素含量降低和类囊体发育不全所致。
冷适应Y-05的转录组和代谢组
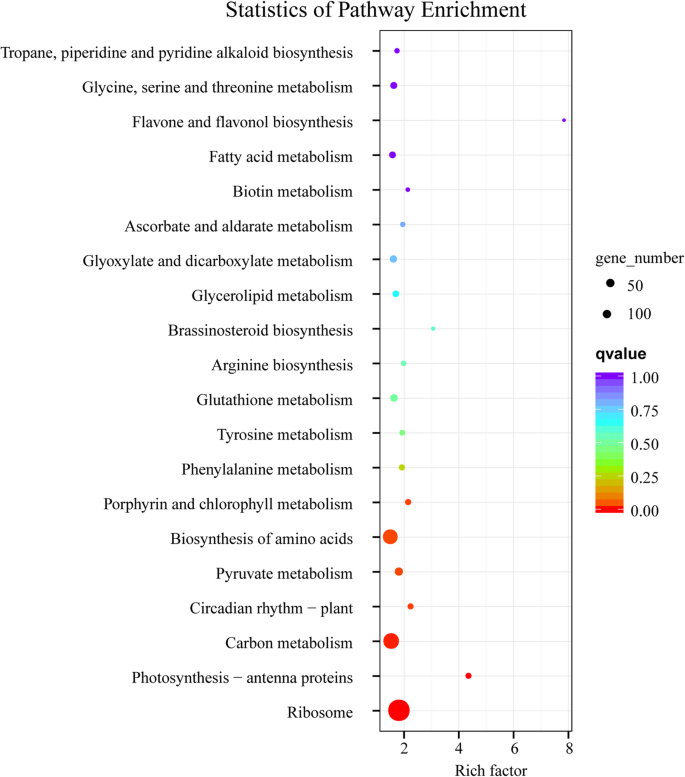
为了探讨冷驯化诱导Y-05叶片颜色变化的分子机制,我们对绿色外叶(TOU)和黄色内叶(TIN)的转录组进行了研究(表S1-4)。对于Tou和锡样品,建立了三种独立的生物重复。高相关系数表示生物重复之间的强烈线性关系(图S2a) 。总共,在阴阳和勾股之间鉴定出4887个差异表达基因(DEG),与勾股相比,阴阳中有2239个基因下调,2648个基因上调(图2b,表2).基因本体论(GO)分析显示,细胞膜和叶绿体相关类别的整体成分在细胞成分中占了过多的比例(图。2,表3.).京都基因和基因组百科全书(KEGG)通路分析显示,“光合作用-天线蛋白”(ko00196)、“生物节律-植物”(ko04712)和“卟啉和叶绿素代谢”(ko00860)通路具有丰富的因子> 2(图2)。3.,表4).
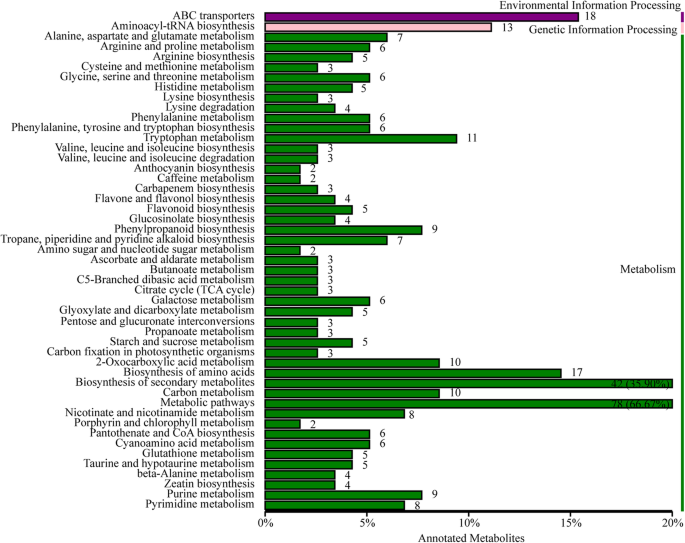
为探讨Y-05内黄叶(MIN)和外绿叶(MOU)代谢产物组成的差异,采用非靶向代谢组分析。评估了MOU和MIN之间的重复性和相关性分析,以证明数据的可靠性(图S)3.a).共鉴定出372个差异表达代谢物(dem)。在MIN中有162个代谢物向上积累,210个代谢物向下积累(图S3.b,表5).然后,我们分析了MIN和MOU之间的dem。KEGG途径分析显示,大多数代谢物主要富集在“代谢途径”和“次生代谢物生物合成”途径(图)。4).有趣的是,“卟啉和叶绿素代谢”途径也被发现(图。4),这与我们以前的结果一致,即叶绿素含量在Y-05变化。从代谢物数据中,我们发现两种参与叶绿素生物合成的代谢物,分别与MOU分别下调和上调5-氨基纤维素(ALA,Meta_22)和L-谷氨酸(Meta_277)(表S.6),说明l -谷氨酸向ALA的转化在内叶受阻。因此,我们认为Y-05内叶叶绿素含量的降低与ALA合成的抑制有关。
ALA内容对于Pakchoi Y-05的叶子颜色转换至关重要
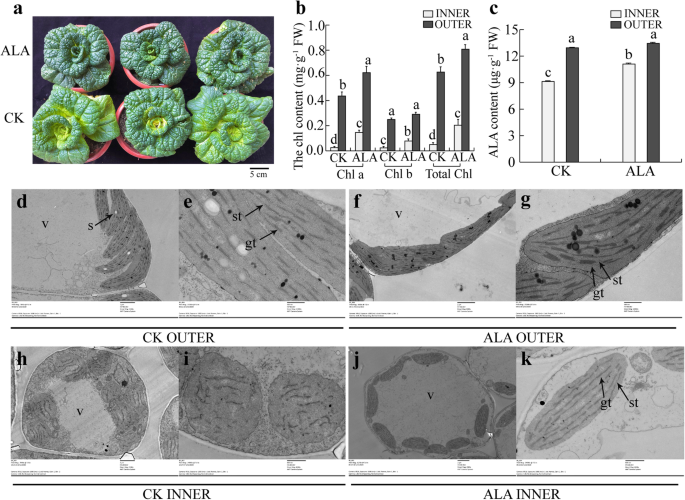
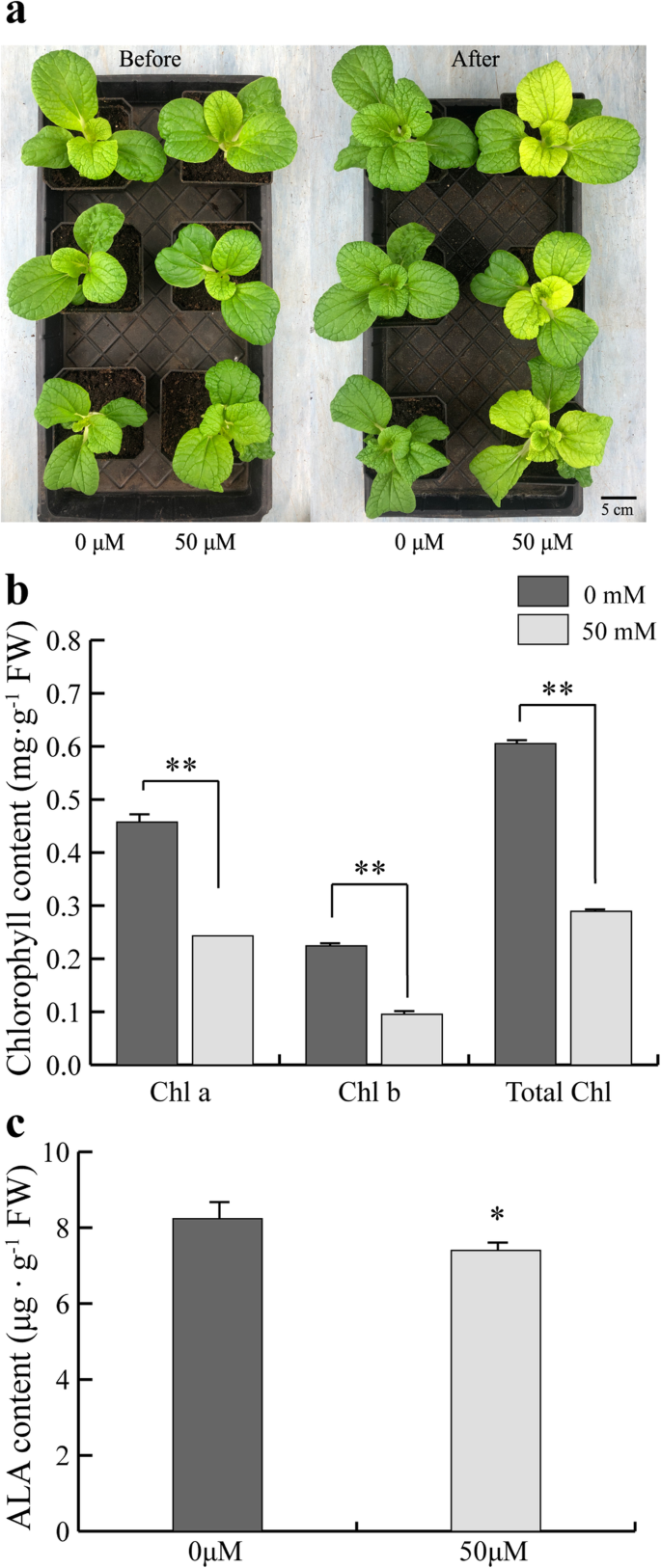
根据代谢组数据(表S5和s6),冷驯化Y-05叶片内ALA合成的抑制可能导致叶绿素含量降低和叶片变黄。为了验证我们的假设,1 冷驯化后,当Y-05的内外叶均为绿色时,立即在其叶片上喷洒mM-ALA。以喷水处理的Y-05冷驯化植株为对照。正如我们所预期的,经ALA处理的内叶的叶片变黄受到抑制,而对照植物的内叶呈黄色(图。5a).与表型一致,ALA处理Y-05的叶绿素和ALA含量均显著升高(图2)。5b, c)。进一步,我们观察了ala处理和对照叶片叶绿体的超微结构。与对照相比,ala处理植株外叶叶绿体具有更厚的粒类囊体(图2)。5d)。同时,与对照的未发育叶绿体相比,ala处理植株的内叶具有成熟的叶绿体和颗粒类囊体(图。5h-k)。综上所述,外源施用ALA可以挽救Y-05冷驯化诱导的黄色表型。
外源施用ALA可以挽救冷驯化Y-05植株的黄叶表型。一个ala处理植株的叶片表型与对照比较。ALA,冷适应Y-05喷1mm ALA。CK,冷驯化Y-05水喷作对照。条= 5厘米。bALA处理植物的叶绿素含量高于CK植物。叶绿素a,叶绿素b和总叶绿素缩写为Chl a, Chl b, total Chl。cALA处理植株的ALA含量高于CK。对每个品种的3株单株进行定量,并对叶绿素和ALA含量进行3次测定。误差柱代表SE(±SE, n = 3)。不同的字母表示在统计学上的显著差异p < 0.05.d-k叶绿体超微结构观察表明,ala处理后的植株具有成熟的叶绿体和粒类囊体。V =液泡,gt =颗粒类囊体,st =基质类囊体。在无花果。4D, f, h, j, bar = 2 μm;在无花果。4e、 g,酒吧 = 500 纳米;在无花果。4I, k, bar = 800 nm
下一步,进一步研究ALA在Y-05叶片颜色转换中的作用,gabaculine(3-氨基2,3-二氢苯甲酸)是一种通过灭活GSA-AT活性来抑制ALA生物合成的抑制剂[39,40],用来灌溉一个月大的Y-05幼苗。以水分浇灌的Y-05幼苗为对照。在处理后,Gabaculine治疗的Y-05幼苗的内叶显示黄色表型而无需冷适应,而控制厂仍然显示绿色内叶(图。6a).与表型一致,gabaculine处理植株内叶叶绿素和ALA含量较对照降低(图2)。6b, c).这些结果进一步证实了ALA生物合成的抑制是Y-05叶片黄变的关键。综合以上结果,我们认为ALA的含量是Y-05叶片颜色转换的关键。
的upregulationbrflu.对于寒冷适应的Y-05中的ALA抑制至关重要
以上数据表明Ala生物合成在冷置于y-05的黄色内叶中被阻断。在叶绿素合成过程中,L-谷氨酸对ALA的转化是由三个阳性调节剂控制的速率限制步骤,英镑,丙烯酸-和格萨和一个消极的调节器流感[34,41].为了深入研究冷驯化Y-05对YIN抑制ALA的分子机制,我们首先研究了其同源基因的表达英镑,丙烯酸-和格萨阴沟叶之间。转录数据显示,该基因的表达BrHEMA1和BrGSA1与GOU叶相比,YIN叶显著增加(图S4,表7).自丙烯酸-和格萨是ALA生物合成的正调控因子,YIN叶片中ALA的抑制不应与增加BrHEMA1和BrGSA1表达式。至于BrGBP,在YIN和GOU之间的表达水平没有显著变化,也不应该是ALA被阻断的原因(图S4,表7).以前的研究表明,流感是Ala生物合成的负调节剂,与Glutr的C末端相互作用,使ALA合成[37,42].有趣的是,BraA05003715 (brflu.),拟南芥的同源基因流感在Pakchoi,与GOU相比,在尹中显示了7.4倍高的表达(图。4,表7),与ALA含量下降一致。因此,brflu.作为黄内叶ALA抑制的候选基因进行下一步研究。
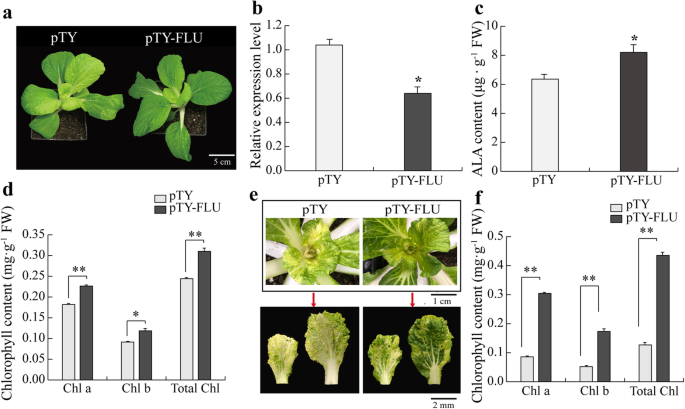
研究的作用brflu.在Y-05的叶色转换中,对Y-05的brflu沉默系(pTY-FLU)进行检测(图5)。7a,b)。注射有PTY空载体的Y-05植物用作对照(PTY)。与对照植物相比,沉默的植物显示出更多的叶绿素和ALA含量(图。7C, d)表示低brflu.水平对ALA和叶绿素生物合成的阳性贡献在Y-05中。此外,如果brflu.冷驯化诱导Y-05叶片中ALA的表达上调与ALA的抑制、叶绿素含量的降低、叶绿素的沉默等密切相关brflu.在冷驯化条件下,Y-05可以提高叶绿素含量,至少在一定程度上挽救黄叶表型。为了验证我们的假设,我们用0°C处理pTY和pTY- flu细胞株3周。令人兴奋的是,pTY-FLU植株表现出绿色表型,叶绿素含量高于对照植株(图2)。7e,f),建议brflu.上调与Y-05的叶片颜色转换密切相关。这些数据在一起表明上调了brflu.冷驯化对ALA的抑制起关键作用,最终导致Y-05叶绿素含量降低,内部叶片呈黄色。
沉默的brflu.Y-05是ALA生物合成的关键。一个pTY植物(CK)和pTY- flu (brflu沉默)植物的表型。条= 5厘米。b的相对表达水平brflu.在pTY-FLU植物中显著减少。内叶的选择是为了确认brflu.表达式。cpTY- flu植株的ALA含量高于pTY植株。dpTY- flu植株的叶绿素含量高于pTY植株。epTY和pTY- flu植物冷驯化后的表型。条= 1厘米或2毫米。f冷驯化后,pTY- flu植株的叶绿素含量高于pTY植株。叶绿素a,叶绿素b和总叶绿素缩写为Chl a, Chl b, total Chl。对每个品种的3株单株进行了定量,并对叶绿素含量进行了3次测定。误差柱代表SE(±SE, n = 3)。*代表p< 0.05, **表示p < 0.01
此外,探究原因brflu.是在冷适应Y-05中特别上调的,我们首先比较brflu.Y-05与其他常青小白菜品种(G-04、WTC、2Q、LY、MET、SZQ)之间的开放阅读框(ORF)序列。虽然有许多单核苷酸多态性brflu.与其他小白菜品种(图S5), BrFLU氨基酸序列在Y-05与其他品种间无显著差异(图S6).启动子中motif的出现或缺失会影响基因的表达水平,因此我们对启动子进行了分析brflu.在Y-05和其他小白菜品种中。不幸的是,我们并没有发现任何特定的基序出现或缺失的启动子brflu.来自Y-05(图S7).综上所述,我们提出了具体的上调brflu.在Y-05中是由其上游对冷驯化反应的调节剂诱导的。
讨论
叶色是蔬菜育种和市场营销中的一个重要性状。然而,以往对叶色转化机制的研究主要集中在树木和观赏植物上[43,44].虽然在稻米,玉米和小麦等作物中进行了一些关于叶子颜色转化的研究[21,24,关于蔬菜的研究很少。本文研究了小白菜叶片颜色转化的机理。探讨Y-05特殊表型的颜色转换机制(图5)。1首先,我们测量了黄叶和绿叶之间的色素含量,包括叶绿素、类胡萝卜素、叶黄素和花青素。结果表明,Y-05的黄色内叶中所有色素均降低(图S1).此前,许多研究发现,叶子颜色转化通常伴随着衰老[45].在叶片衰老过程中,叶绿素持续降解,类胡萝卜素部分保留,这被认为是叶片颜色变化的原因银杏叶[46].然而,小白菜Y-05的叶片颜色转换只发生在幼嫩的内叶中(图5)。1A),这意味着这种转化与叶片衰老无关,而是对冷驯化的响应。同样,研究人员认为,叶色突变通常伴随着生长受阻,然后导致植物的经济损失[47]. 在我们的研究中,叶绿素含量和PnY-05叶片中的值低于G-04叶片中的值(图。1B,C),表明通过冷适应抑制Y-05的黄色内叶中叶绿体的发育。然而,Y-05显示出显良的表型(图。1a) 。因此,我们认为Y-05的外部绿叶可能为植物的生长提供足够的光合产物。上述结果表明,内叶颜色的变化是由冷驯化引起的,不会影响植物的发育。然而,为什么黄色表型只发生在幼嫩的内叶上还需要进一步研究。一种可能是冷驯化只在Y-05类囊体发育的早期阶段起作用。具有成熟叶绿体和发育类囊体的外叶对冷驯化没有反应。
一般叶绿素含量低是由于叶绿素合成或降解受到抑制[4]. 叶绿素合成包括从GluTR到Chl的19个步骤b,在该过程中,共有超过26个基因编码的总共16种酶[48,49].例如,“白鸽子”是羽衣甘蓝的叶子颜色突变体(芸苔属植物oleracea).低温诱导叶绿素生物合成基因的低表达运动,导致叶绿素含量在“白色鸽子”中显着减少[50.].PORA在叶绿素生物合成中起重要作用。拟南芥porA-1幼苗遭受叶绿素含量急剧下降和矮化表型[51.].奥斯佩1主要控制CHL的合成b,其突变会导致CHL降低b含量,使叶片呈黄绿色[52.].同时,植物体内叶绿素的生物合成与分解代谢之间存在着动态平衡。的高表达CHL2和RCCR基因加速叶绿素降解,导致叶片变黄兰花sinense[53.].叶绿素降解途径中的突变常常导致植物叶片中的绿色滞留现象[54.,55.].此外,许多植物的叶绿素降解通常伴随着衰老或损伤[47].例如,许多植物在秋天会呈现出五颜六色的叶子,这与叶绿素降解有关[56.].此外,一些胁迫包括生物和非生物胁迫会触发细胞死亡和叶绿素降解[57.].在我们的研究中,Y-05内叶呈黄色是由于叶绿素含量降低和类囊体未发育造成的(图。1B,J,K)。更重要的是,黄色叶片表型只发生在Y-05的内叶中但不在外叶中。如果黄色叶片表型是由叶绿素降解引起的,外叶和内叶也应在冷驯化后显示黄色表型。因此,我们建议Y-05的黄色内叶中的低叶绿素含量是由叶绿素合成的抑制引起的,但不是叶绿素降解引起的。损伤的类囊膜膜也支持该想法(图。1j,k),因为囊体膜是叶绿素合成的部位[58.].
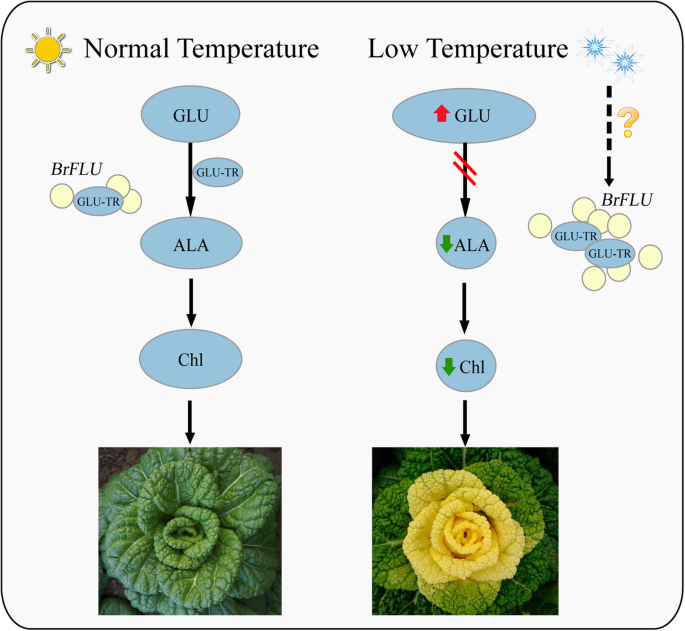
为了进一步研究小白菜Y-05叶片颜色转换的机制,我们对外叶绿色和内叶黄色的转录组进行了研究。2,3.和4,表1-5)。GO和Kegg分析进一步确认低叶绿素含量(图。1b)、弱光合能力(图。1c)和叶绿体结构受损(图。1j, k)在Y-05的内叶。代谢物是基因型和表现型之间的桥梁。因为代谢物最接近表现型,它们的变化更直接地揭示基因功能[59.].根据代谢组数据,我们发现黄色内叶叶绿素含量低与ALA合成受阻密切相关(表S6).ALA的互补和抑制实验(图。5和6)进一步支持发现。此外,转录om数据显示高表达brflu.在ALA合成的阻断中起关键作用(图S4和表S.7).FLU蛋白在其c端保留了TPR基序,可以与GluTR相互作用[35,60.],从而影响ALA的合成速度[41].在之前的研究中拟南芥,过表达系在光照下表现出ALA合成降低和叶绿素含量降低[60.].在我们的学习中,沉默brflu.在Y-05的小菜进一步证实了brflu.对ALA合成和叶绿素含量的影响(图3)。7).我们的结果表明,ALA合成受损与增强型密切相关brflu.叶绿素含量降低,叶片黄变。然而,我们没有发现ORF和启动子序列有显著差异brflu.与其他品种比较(图S5 - 6).因此,具体上调的原因brflu.Y-05在冷适应环境中的作用尚不清楚。换句话说,就是brflu.在Y-05中是由一种未知的调节因子调控的,该因子对冷驯化反应有响应(图)。8).对于未知的监管机构,我们提出了三种可能性。一个是brflu.阳性转录因子可以通过冷驯化,激活诱导brflu.表达式。第二个是一个brflu.负转录因子,可被冷驯化抑制,减少抑制brflu.表达式。最后一种可能是表观遗传调节,如冷适应可能减少brflu.甲基化水平,导致增强brflu.表达式。
结论
Y-05是一种特殊的小白菜品种,常温下叶片呈绿色,冷驯化后内叶呈黄色,外叶呈绿色。在冷驯化的Y-05小白菜中,与绿色的外叶相比,黄色的内叶叶绿素含量低,光合能力弱,叶绿体和类囊体未发育。通过转录组和代谢组测序的综合分析和功能验证,我们发现冷驯化可以触发一种未知的调控因子,诱导brflu.抑制ALA合成的上调,导致叶绿素含量降低和叶片变黄(图。8).然而,未知的监管机构需要进一步探索。最后,我们的研究结果为了解叶片颜色变化对冷驯化的响应机制提供了依据。
方法
植物材料和生长条件
所有小白菜自交系(Y-05、G-04、WTC、2Q、LY、MET、SZQ)均在23℃、70%湿度、250 μmol·m的长日照(16 h光照/ 8 h黑暗)人工气候室中培养−2·S.−1光。对于冷驯化,在4°C下养育3周的植物3周,然后恢复到23°C以继续生长。在23°C生长2周后,冷适应的Y-05将呈绿色外叶(GOU)和黄内叶(YIN)。苟和尹叶用于下一步研究。在相同的生长条件下,在冷适应之前和之后显示温度绿色表型的G-04用作颜料测定和形态学观察实验的对照组。重建中使用的所有植物材料都来自南京农业大学作物遗传学和种质增强的国家重点实验室。
测量颜料和ALA含量
植物色素,包括叶绿素和类胡萝卜素的含量在以前的研究中被测量[9,61.,62.]有简单的修改。简而言之,在15mL提取溶液中浸泡0.1g新鲜的叶子,然后在暗状态下用50rpm / min摇晃24小时。通过665,649,642,485和470nm的波长的UV - 可见分光光度计(Cytation3,Biotek,USA)测量吸光度。
通过Huo的方法测量花青素[63.].简而言之,将0.1g新鲜的叶片浸泡在1ml酸化乙醇(80%盐酸)中浸泡在1ml酸化的乙醇中,并在4°C的黑暗条件下持续24小时。在536nm的波长下测量吸光度。将所有浓度的颜料计算为(mg∙g−1).ALA浓度(μg∙g−1)使用酶联免疫吸附试验(ELISA)试剂盒(CAT NO:KT7958-B,江苏克莱特生物技术有限公司)进行测量。
透射电镜(TEM)分析
超薄片的制作方法参考前川的方法[64.].简单地说,用双面刀片从小白菜植株上切下2 × 2毫米的叶子,用1% (w/v)戊二醛固定,用磷酸盐缓冲液洗涤几次后,再用0.5% (w/v)四氧化锇固定。用树脂浸渍后,用超微切片机(EM UC6, Leica Microsystems)切割,得到超薄切片。对于透射电子显微镜,使用日立(东京,日本)H-7650透射电镜对超薄薄片进行检查和拍照,如前所述[65.].
转录组分析
从中央的黄色部分和绿色部分完全扩张的叶子在冷适应后2周被取样,三个独立植物的一部分作为生物重复。清洁和切割后,将叶子组织立即在液氮中冷冻,然后储存在-80℃以进一步研究。使用Trizaol试剂(Thermo Fisher Scientific Inc.)从Y-05的YIN和GOU中提取总RNA。图书馆建设和RNA-SEQ由Biomarker Technology Co.(北京,中国)进行。Illumina Hiseq 2500平台(NEB,USA)用于图书馆准备测序。过滤(低Q值<= 20%)后,然后组装清洁的读取并映射到芸苔属植物拉伯基因组(v2.5)(http://brassicadb.org/brad/index.php)使用软件HISAT2(版本2.1.0)[66.].每个差异表达基因(DEG)的功能被注释到以下公共数据库中:Nr (NCBI非冗余蛋白序列);KOG/COG(同源组蛋白簇);Pfam(蛋白家族),SwissProt, KEGG(京都基因和基因组百科全书)[67.[Go(基因本体论)。使用DESEQ2进行差异表达分析[68.基于基因在不同样本中的表达水平。log2 (fold change)的绝对值≥2,P-value < 0.05 [69.,作为鉴别显著差异表达的标准。
诸多代谢组分析
用于非靶向代谢组分析的样本与转录组分析相同。但为了在数据分析中与转录组区分,将黄内叶和绿外叶的代谢物分别命名为MIN和MOU。代谢物鉴定和定量由Biomarker Technology Co. (Beijing, China)进行。简而言之,代谢物鉴定是基于以下公共数据库:HMDB (http://www.hmdb.ca/), KEGG(京都基因和基因组百科全书),遵循标准的代谢操作程序。代谢产物定量采用多反应监测(MRM)。靶向UPLC-ESI-QTOF/MS分析和多变量数据分析(PCA和Opls-da) [70,以获得更可靠的代谢物信息。对于所有有三个生物学重复的差异代谢物,log2 (fold change)的绝对值≥1和变量重要性投影(VIP)≥1,P-value < 0.05 [69.是鉴别明显差异代谢物的标准。
ALA和gabaculine的治疗
ALA处理时,将经冷驯化的Y-05植株转移到23°C室后,立即在叶片上喷1 mM ALA(5-氨基乙酰丙酸;中科院:5451-09-2;J&K SCIENTIFIC LTD.)溶液每3天1次,连续2周。以Y-05水喷作对照。
对于加巴乙胺治疗,使用50μmGabaculine水溶液(3-氨基-2,3-二氢苯甲酸; CAS:59556-17-1,中国j&k Scientific Ltd。) 解决方案 [71.每三天一次,连续两周。以水分浇灌的Y-05幼苗为对照。
病毒诱导的基因沉默(Vigs)分析
VIGS被用来产生无声小白菜,如我们之前描述的[72.].一个特异性的40 bp片段(5 ' -ctgaggaatcaagagccagagaaggcttttgaagagttca.TGAACTCTTCAA AAGCCTTCTCTGGCTCTTGATTCCTCAG-3”)brflu.合成编码区(下划线)及其反义序列并插入PTY载体[72.].然后,使用基因枪(生物理PDS-1000 / HE,Bio-rad,USA)将构建体引入一个月大的Y-05幼苗的细胞中。用空皮载体引入的幼苗用作对照。在正常情况下成长1周后,将Blfflu沉默和对照植物均在4°C室中移动3周冷适应,然后返回到23℃以继续生长。
RNA分离和基因表达分析
使用TRIzaol试剂(Thermo Fisher Scientific Inc.)从叶子中提取总RNA [73.],用HiScript II Q RT SuperMix合成cDNA进行qPCR (Cat No. Cat .)。中国,南京,Vazyme r223-01)然后采用SYBR Green Premix Pro Taq HS qPCR Kit II (Rox Plus)进行qPCR分析。精准生物科技(湖南)有限公司,China) on StepOnePlus system (Applied Biosystems, USA). The relative expression of genes was analyzed by the 2−ΔΔCT方法 [74.],归一化为内控基因BrPP2A小白菜。每个反应进行3个技术重复和3个独立的生物重复(生物重复:3个独立植物的相同部分的叶子;技术重复:重复检测和分析同一样品)。用于qPCR分析的引物采用Primer Software Version 5.0 (Premier Biosoft International, CA, USA)设计,见表S8.
数据分析
所有样本的PCA和火山图由BMK云平台生成(www.biocloud.net).热图和独联体在Tbtools V1.05上进行启动子的分析[75.].的全长开放阅读框(ORF)brflu.使用从NCBI数据库使用BLASTN和从品种中扩增的序列获得,包括Y-05,G-04,WTC,2Q,LY,MET和SZQ。多序列对齐在线软件Multalin [76.].使用氨基酸序列对准软件DNAMAN。1.2 kB启动子序列brflu.使用BLASTN查询b·拉伯基因组。引物见表S8.使用植物护理数据库进行分析的启动子序列(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).我们手稿中的所有方法和材料都符合相关机构、国家和国际指南和立法。
数据和材料的可用性
在当前的研究中使用和/或分析的数据集可从通信作者在合理的要求。
缩写
- 阴:
-
黄色内叶
- 郭台铭:
-
绿色的叶子
- 透射电镜:
-
透射电子显微镜法
- 度:
-
差异表达基因
- 阿拉巴马州:
-
5-aminolevulinic酸
- pem:
-
植物黄化突变(pem)
- REC:
-
降低叶绿体覆盖蛋白
- TPR:
-
Tetratricopeptide重复蛋白
- PPR:
-
Pentatricopeptide重复蛋白
- Pn:
-
净光合速率
- 时间单位:
-
绿色外叶中的转录本
- 锡:
-
黄色内叶的转录本
- PCC:
-
皮尔逊相关系数的
- 走:
-
基因本体论
- KEGG:
-
京都基因和基因组百科全书
- 分钟:
-
黄色内叶中的代谢物
- 备忘录:
-
绿色外层叶中的代谢物
- 民主党:
-
差异表达代谢物
- Gabaculine:
-
3-amino 2, 3-dihydrobenzoic酸
- ELISA:
-
酶联免疫吸附测定
- KOG /齿轮:
-
同源组的蛋白质簇
- 包含了:
-
蛋白家族
- 中收取:
-
病毒诱导的基因沉默
- 主成分分析:
-
主要成分分析
- GluTR:
-
Glutamyl-tRNA还原酶
- GSA:
-
Glu-1-semialdehyd
- GSA-AM:
-
GSA-2, 1-aminomutase
- 流感:
-
蓝光荧光
- 博洛:
-
流感过度表达
- 英镑:
-
GluTR-binding蛋白质
参考
- 1.
田中华,王志强,王志强,等。植物色素的生物合成及其应用。植物j . 2008; 54(4): 733 - 49。https://doi.org/10.1111/j.1365-313x.2008.03447.x.
- 2.
罗飞,程长生,蔡建华,魏斌斌,周旭,周强,等。叶绿素降解和类胡萝卜素生物合成途径:花椰菜变黄过程中的基因表达和色素含量。食品化学。2019;297:124964。https://doi.org/10.1016/j.foodchem.2019.124964.
- 3.
Clark ST, Verwoerd WS。一种鉴定植物色素丧失相关基因靶点的系统方法。BMC生物信息学。2011;12(1):343。https://doi.org/10.1186/1471-2105-12-343.
- 4.
冯·维茨坦D,高夫S,坎南加拉CG。叶绿素生物合成。植物细胞。1995;7(7):1039 - 57。https://doi.org/10.2307/3870056.
- 5。
桑德博格E。ALBIN03是拟南芥叶绿体分化所必需的核基因,编码一种叶绿体蛋白,该蛋白与存在于细菌膜和酵母线粒体中的蛋白质具有同源性。植物细胞。1997;9(5):717 - 30。https://doi.org/10.1105/tpc.9.5.717.
- 6。
coproporphyrinogen III氧化酶的缺乏导致拟南芥病变的形成。植物j . 2001; 27(2): 89 - 99。https://doi.org/10.1046/j.1365-313x.2001.01058.x..
- 7。
Lohscheider JN, rojasstutz MC, Rothbart M, Andersson U, Funck D, Mendgen K, et al.;中LIL3亚型水平的改变拟南芥导致色素-蛋白组装和叶绿素合成紊乱,褪绿表型和光合性能受损。植物学报。2015;38(10):2115-27。https://doi.org/10.1111/pce.12540.
- 8。
谢军,姚树华,明建,邓磊,曾昆。柑橘果实中叶绿素和类胡萝卜素含量的变化及色素代谢相关基因的表达。食品化学。2019;272:49-57。https://doi.org/10.1016/j.foodchem.2018.08.020.
- 9.
关键词:叶绿素代谢,叶片颜色变化,蛋白质组学,蛋白质组学芸苔属植物定l)对冷驯化的反应。蛋白质组学杂志2019;18(6):2478-92。https://doi.org/10.1021/acs.jproteome.9b00016.
- 10.
Reinbothe C,El Bakkouri M,Buhr F,Muraki N,Nomata J,Kurisu G,等。叶绿素生物合成:聚光灯降低了蛋白氯化物。趋势植物SCI。2010; 15(11):614-24。https://doi.org/10.1016/j.tplants.2010.07.002.
- 11.
王P,Grimm B.叶绿素生物合成和将叶绿素插入叶绿素结合蛋白中的叶绿素结合蛋白。Photosynth Res。2015; 126(2-3):189-202。https://doi.org/10.1007/s11120-015-0154-5.
- 12.
朱林,曾旭,陈勇,杨志,齐林,濮阳,等。一个叶绿素缺乏突变体的遗传特征和精细定位(BnaC.ygl)芸苔属植物显著.摩尔品种。2014;34(2):603 - 14所示。https://doi.org/10.1007/s11032-014-0060-0.
- 13.
张L,刘C,X,Wu H,Feng Y,Wang H,等。一种新型不完全显性黄叶颜色基因的鉴定和遗传映射,Y1718在小麦的2BS染色体上。Euphytica。2017;213(7):141。https://doi.org/10.1007/S10681-017-1894-4.
- 14.
关键词:大麦,突变,基因工程,基因工程abstractfch2编码氯化物一个加氧酶。植物生理学杂志。2012;53(7):1232-46。https://doi.org/10.1093/pcp/pcs062.
- 15.
Kim D-Y,Bovet L,Kushnir S,Noh Ew,Martinoia E,Lee Y.AtATM3参与重金属耐受性拟南芥.植物理性。2006; 140(3):922-32。https://doi.org/10.1104/pp.105.074146.
- 16。
张浩,李军,刘建辉,刘世昌,赵世辉,高宏杰,等。大米Chlorina-1和Chlorina-9mg螯合酶是叶绿素合成和叶绿体发育的关键酶,它编码ChlD和ChlI亚基。植物学报。2006;62(3):325-37。https://doi.org/10.1007/s11103-006-9024-z.
- 17。
彭步云,张军,安立军。叶色突变体的遗传筛选与分离F03-06在拟南芥.枢纽农业。2016; 55(21):5664-7。
- 18。
李旭,黄胜,刘志,侯磊,冯华EMB1923基因启动子与大白菜叶绿素缺乏相关(芸苔属植物定ssp。学报).physiol植物。2019; 166(4):909-20。https://doi.org/10.1111/ppl.12979.
- 19。
张凯,刘志,单旭,李超,唐旭,迟敏,等。白菜的生理特性和叶绿素生物合成(芸苔属植物拉伯L. SSP。对)黄叶突变体,pylm.植物生理学报,2017;39(1):22。
- 20。
Larkin RM, Stefano G, Ruckle ME, Stavoe AK, Sinkler CA, Brandizzi F,等。减少了叶绿体的报道基因拟南芥帮助建立叶绿体隔间的大小。pnas。2016; 113(8):E1116-25。https://doi.org/10.1073/pnas.1515741113..
- 21。
兰涛,王斌,凌强,徐超,童志,梁锴,等。细的映射cisc(t)水稻冷诱导幼苗褪绿的基因及其候选基因的鉴定。科学通报。2010;55(27):3149-53。https://doi.org/10.1007/S11434-010-4041-3.
- 22。
植物五萜肽重复蛋白。植物学报。2014;65(1):415-42。https://doi.org/10.1146/annurev-arplant-050213-040159.
- 23。
水稻叶绿体遗传系统的建立及其在叶片早期发育和低温条件下的应用。植物科学学报。2014;5:386。
- 24。
杜洋洋,陈辉,钟伟林,吴丽丽,叶建华。温度对低温诱导茶树叶片叶绿素积累和超微结构的影响。生物技术学报。2008;7(12):1881 - 1883。https://doi.org/10.5897/AJB2008.000-5036.
- 25
Park S,Fischer Al,Steen CJ,Iwai M,Morris Jm,Walla PJ等。通过快照瞬态吸收光谱研究的高曝光囊体膜中叶绿素 - 类胡萝卜素激发能量转移。J am Chem Soc。2018; 140(38):11965-73。https://doi.org/10.1021/jacs.8b04844.
- 26
Brzezowski P, Ksas B, Havaux M, Grimm B, Chazaux M, Peltier G, et al.;原卟啉原IX氧化酶在叶绿素生物合成中的功能需要氧化的叶绿体醌Chlamydomonas Reinhardtii..Commun杂志。2019;2(1):159。https://doi.org/10.1038/s42003-019-0395-5.
- 27
5-氨基乙酰丙酸(ALA)通过促进叶绿素合成途径缓解黄瓜幼苗的盐胁迫。植物科学。2018;9:635。https://doi.org/10.3389/fpls.2018.00635.
- 28
Rassadina VV, Averina NG, Koval SF。5-氨基乙酰丙酸水平对春小麦等基因系叶绿素形成和镁卟啉合成的干扰(Triticum aestivum.以基因标记的CN-A1和cn-D1.生物科学学报2005;405:472-3。
- 29.
刘丹,孔丹丹,付晓坤,阿里博,徐丽,周文军。外源5-氨基乙酰丙酸对水分亏缺胁迫下油菜去黄化子叶叶绿素合成及相关基因表达的影响acta Photosynth Res. 2016;54(3): 468-74。
- 30.
郭学Q,李燕,于旭。在次优低温和次优光子通量密度胁迫下,5-氨基乙酰丙酸对番茄幼苗光合作用和叶绿素荧光的促进作用-短通讯。霍尔茨脊髓损伤。2012;39(2):97–9.
- 31.
李冬梅,张娟,孙文军,李强,戴阿,白建国。5-氨基乙酰丙酸预处理通过改变黄瓜叶片抗氧化酶活性来缓解干旱胁迫。Sci Hortic。2011;130(4):820 - 8。https://doi.org/10.1016/j.scienta.2011.09.010.
- 32.
5-氨基乙酰丙酸(5-氨基乙酰丙酸)对植物光合作用和叶绿素含量的影响。生物技术与生物化学。1997;61(12):2025-8。https://doi.org/10.1271/bbb.61.2025.
- 33.
反义HEMA1RNA表达抑制血红素和叶绿素的合成拟南芥.植物杂志。2000;122(1):49-56。https://doi.org/10.1104/pp.122.1.49.
- 34.
王志强,王志强,王志强,等。ALA合成的翻译后控制包括Clp蛋白酶降解GluTR和GluTR结合蛋白稳定。植物杂志。2016;170(4):2040 - 51。https://doi.org/10.1104/pp.15.01945.
- 35.
Goslings D, Meskauskiene R, Kim C, Lee KP, Nater M, Apel K.血红素和流感病毒与Glu tRNA还原酶的并发相互作用(HEMA1)在黑暗和光照条件下,代谢反馈抑制四吡咯生物合成的目标拟南芥植物。工厂J. 2004; 40(6):957-67。https://doi.org/10.1111/j.1365-313X.2004.02262.x.
- 36.
方勇,赵胜,张飞,赵安,张伟,张敏,等。的拟南芥谷氨酸-TRNA还原酶(GLUTR)与流感和谷氨酸结合蛋白形成三元复合物。SCI批准。2016; 6(1):19756。https://doi.org/10.1038/srep19756.
- 37.
荧光在蓝光(FLUORESCENCE IN BLUE LIGHT, FLU)中参与谷氨酰基trna还原酶的失活和定位。工厂2018年J。97(3): 517 - 29。https://doi.org/10.1111/tpj.14138.
- 38.
刘军,王军,姚欣,张勇,李军,王旭,等。水稻温敏叶绿素亏缺突变体1的特性及精细定位(栽培稻l .)。Sci繁殖。2015;65(2):161 - 9。https://doi.org/10.1270/jsbbs.65.161.
- 39。
安德森·厘米,灰色jc。Gabaculine对血红素和细胞色素合成的影响f在硫酸盐小麦幼苗中。植物理性。1991; 96(2):584-7。https://doi.org/10.1104/pp.96.2.584.
- 40.
德拉齐克G,博格达诺维奇M。加巴喹啉不抑制细胞分裂素刺激的大鼠叶绿素生物合成松属黑质幼苗在黑暗中生长。植物科学。2000;154(1):23-9。https://doi.org/10.1016/s0168 - 9452 (99) 00236 - 8.
- 41.
Hou Z. Fluorescence in blue light (FLU): its structure domains for light and dark-dependent control of ALA synthesis;2020.
- 42.
von Gromoff ED、Alawady A、Meinecke L、Grimm B、Beck CF.Heme,一种来自质体的核基因表达调节因子,在人类基因组中衣原体.植物细胞。2008; 20(3):552-67。https://doi.org/10.1105/tpc.107.054650.
- 43.
Primka EJ,史密斯WK。秋季叶片下降的同步:三种温带落叶树种中的叶绿素降解,颜色变化和脱落层。我是J机器人。2019; 106(3):377-88。https://doi.org/10.1002/ajb2.1247.
- 44。
沉J,Zou Z,张X,周L,王Y,Fang W等人。代谢分析显示两个紫色叶茶厂的叶子颜色变化的不同机制(茶树L.)品种。Hortic Res。2018; 5:7。
- 45。
Teppabut Y、Oyama KI、Kondo T、吉田K。早熟禾花衰老过程中花瓣颜色和化学成分的变化。分子。2018;23(7):1698.https://doi.org/10.3390/molecules23071698.
- 46。
印度夏季的生物化学性能:秋季叶着色的生理学。Exp Gerontol。2000; 35(2):145-58。https://doi.org/10.1016/s0531 - 5565 (00) 00081 - 4.
- 47。
张赵MH,李X,张XX, H,赵XY。植物叶色突变机制研究进展。森林。2020;11(8):851。https://doi.org/10.3390/f11080851.
- 48。
比尔斯。绿色的基因中。植物科学进展。2005;10(7):309-12。https://doi.org/10.1016/j.tplants.2005.05.005.
- 49
王志强,王志强,王志强,等。植物叶绿素合成与降解的研究进展。植物学报。2004;56(1):1 - 14。https://doi.org/10.1007/S11103-004-2331-3.
- 50。
周S,胡Z,朱M,张B,邓L,潘Y,等。羽衣甘蓝温度敏感白化突变体“白鸽”的生化和分子分析。植物生长调节。2013;71(3):281–94.https://doi.org/10.1007/s10725-013-9829-0.
- 51。
拟南芥光依赖的NADPH:原叶绿素氧化还原酶a (PORA)是正常植物生长和发育所必需的:一种补充。植物学报。2012;80(2):237-40。https://doi.org/10.1007/s11103-012-9944-8.
- 52。
李y,pu x,li c,zhong p,sun c,li x等。黄绿叶突变体的遗传鉴定与候选基因分析507 y在大米。作物学报。2014;47:221-9。
- 53.
朱光华,杨芳,史树华,李丹,王志伟兰花sinense454焦磷酸测序法在叶片颜色变异相关基因鉴定中的应用PloS one。2015; 10 (6): e0128592。
- 54.
胡志立,邓力,严B,潘毅,罗米,陈学Q,等。沉默的声音LeSGR1番茄基因抑制叶绿素降解,表现出保持绿色的表型。医学杂志。2011;(1):55 27-34。https://doi.org/10.1007/S10535-011-0004-Z..
- 55.
Sakuraba Y,Park Sy,Paek NC。蒸汽(SGR)同源物在叶绿素降解中的发散作用。mol细胞。2015; 38(5):390-5。https://doi.org/10.14348/molcells.2015.0039.
- 56.
姜安,刘杰,姜杰。黄叶衰老叶片颜色与色素及营养元素的关系檫树. 2016年决议;29(03):362–8.
- 57.
Piao W,Han Sh,Sakuraba Y,Paek NC。水稻7-羟甲基叶绿素涉及叶绿素降解的促进并调节细胞死亡信号传导。mol细胞。2017; 40(10):773-86。https://doi.org/10.14348/molcells.2017.0127.
- 58.
张茂民,张建军,于光华,姜永忠,Strasser RJ,袁志勇,等。超高产杂交稻及其亲本生殖期旗叶叶绿体超微结构、类囊体膜脂肪酸组分和叶绿素荧光瞬变的研究植物生理学报。2010;167(4):277-85。https://doi.org/10.1016/j.jplph.2009.09.017.
- 59.
Xu G, Cao J, Wang X, Chen Q, Tian F. Evolutionary metabolomics analysis of maize and its wild ancestor。大刍草植物细胞。2019;31(9):1990-09。https://doi.org/10.1105/tpc.19.00111.
- 60.
张敏,张芳,方勇,陈旭,陈勇,张伟,等。荧光蛋白(FLU)的非典型四三肽重复结构域介导谷氨酰基trna还原酶复合物的形成。中国生物化学杂志。2015;290(28):17559-65。https://doi.org/10.1074/jbc.M115.662981.
- 61.
Nouairi I, Jalali K, Zribi F, Barhoumi F, Zribi K, Mhadhbi H.种子激发氯化钙提高镉胁迫下蚕豆植株的光合性能。57 Photosynthetica。2019;(2):438 - 45。https://doi.org/10.32615/ps.2019.055.
- 62.
徐云英,曾建勇。三种普通植物叶片类胡萝卜素含量的比较分析。广西民族师范大学学报。2013;30(3):18-9。
- 63.
Huo L-L,SU P,LV Y-H。UV可见光光谱法测量桑树中的总花青素。酒制。2005;4.
- 64.
前川,高林,华兰卡,山本,田中,佐藤,等。淡绿的表型atl31 atl6双突变体叶片是由5-氨基乙酰丙酸生物合成中断引起的拟南芥.《公共科学图书馆•综合》。2015;10 (2):e0117662。https://doi.org/10.1371/journal.pone.0117662.
- 65.
Labate Mt,Ko K,Ko Zw,Pinto Ls,Real MJ,Romano Mr,等。豌豆的组成型表达奇迹1 - 2在烟草影响植物发育,形态和光合能力。植物mol biol。2004; 55(5):701-14。https://doi.org/10.1007/s11103-004-1963-7.
- 66.
HISAT:低内存要求的快速拼接对准器。Nat方法。2015;12(4):357 - 60。https://doi.org/10.1038/nmeth.3317.
- 67.
Kanehisa M, Furumichi M, Sato Y, Ishiguro-Watanabe M, Tanabe M. KEGG:整合病毒和细胞有机体。核酸序列2021;49(D1): D545-D51。https://doi.org/10.1093/nar/gkaa970.
- 68.
王磊,冯志强,王昕,张晓霞。基于RNA-seq数据的差异表达基因鉴定。生物信息学,2010,26(1):136 - 8。https://doi.org/10.1093/bioinformatics/btp612.
- 69。
Benjamini Y,Yekutieli D.在依赖性下进行多种测试中的虚假发现率的控制。安统计。2001; 29(4):1165-88。
- 70.
Barri T, Dragsted LO。血浆和血清代谢组学UPLC-ESI-QTOF/MS和多变量数据分析:实验人工制品和抗凝剂的影响。Acta physica sinica; 2013; 768:118-28。https://doi.org/10.1016/j.aca.2013.01.015.
- 71.
Tchuinmogne SJ,沃劳斯,Aoues A,Balange AP。GabaciLine对萝卜幼苗5-氨基硫酸盐脱水酶活性的抑制作用。植物理性。1989; 90(4):1293-7。https://doi.org/10.1104/pp.90.4.1293.
- 72.
于军,杨晓东,王强,高丽伟,杨勇,肖东,等。有效的病毒诱导基因沉默芸苔属植物拉伯使用萝卜黄色马赛克病毒矢量。BIOL植物。2018; 62(4):826-34。https://doi.org/10.1007/s10535-018-0803-6.
- 73。
钱伟,佘洪,刘震,王旭东,吴建军,等。霜霉病抗性基因的精细定位和候选基因筛选RPF1在菠菜。中国科学(d辑:地球科学)2018;https://doi.org/10.1007/s00122-018-3169-4.
- 74。
Schmittgen TD,Livak KJ。用比较CT法分析实时PCR数据。NAT PROTOC。2008; 3(6):1101-8。https://doi.org/10.1038/nprot2008.73.
- 75。
陈超,陈洪,张勇,何勇,等。TBtools:一个用于大生物数据交互分析的综合工具。摩尔。2020;13(8):1194 - 202。https://doi.org/10.1016/j.molp.2020.06.009.
- 76。
基于层次聚类的多序列比对。核酸学报1988;16(22):10881-90。https://doi.org/10.1093/nar/16.22.10881.
致谢
作者感谢所有支持我们的实验室伙伴。
资金
江苏省农业科技自主创新基金资助项目(no . CX(19)3122);安徽省博士后科学基金资助项目(no . 2020B439);安徽省重点研发基金资助项目(no . 202004a06020062)。
作者信息
隶属关系
贡献
TL设计了这项研究。TL,HW,Ly和Hz进行了实验,分析了数据并写了稿件。TL和HW修改了稿件。ZL和XH帮助制备了样品。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:表S1。
TIN和TOU的读数据、质量控制和GC含量说明。表S2。TIN与TOU间DEGs差异表达分析及功能注释表S3。基于基因本体论(GO)的TIN和TOU间基因差异的功能分类。表S4 KEGG途径富集的TIN和TOU DEGs的功能分类表S5。MIN与MOU的dem差异表达分析及功能注释。表S6。dem参与卟啉和叶绿素代谢(ko00860)。表S7。的表达水平BrHEMA1,BrGSA1,BrGBP,brflu.锡和托之间。表S8。实验中使用的引物。
附加文件2:图S1。
G-04、Y-05叶片色素含量。图S2。锡与田田底段复制与火山地图的相关性。图S3。MIN和MOU的dem重复次数与火山图的相关性。图。S4。的表达式概况BrHEMA1,BrGSA1,BrGBP和brflu.锡和托之间。图S5。对齐的brflu.七个小白菜品种的核苷酸序列。图。S6。7个小白菜品种BrFLU氨基酸序列的比对。图S7。启动子基序分析brflu.在不同的pakchoi品种。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
王华,李志刚,袁磊。et al。低温驯化能特异性抑制小白菜幼叶叶绿素合成。BMC植物BIOL.21,172(2021)。https://doi.org/10.1186/s12870-021-02954-2
收到了:
接受:
发表:
关键字
- 5-aminolevulinic酸(ALA)
- brflu.
- 叶绿素生物合成
- 冷适应
- 叶子颜色转换
- 小白菜