- 研究文章
- 开放访问
- 发表:
Ds标记分枝Flortless 1.(BFL1)介导从小穗到稻米的Floret Meristem的过渡(奥雅萨苜蓿L)
BMC植物生物学体积3., 文章编号:6.(2003)
抽象的
背景
穗状花套形成的遗传学,米和玉米等草本特征,尚未得到全面理解,尽管已经分离并研究了许多分类和器官身份突变体拟南芥和玉米。使用两个元素AC / DS.经算子标记系统我们已经隔离了米突变体,指定支链floretless 1(bfl1),其是在从分生组织小穗过渡到分生组织小花缺陷。
结果
这bfl1突变体显示了导致初始脊柱分支的正常分化,导致初始尖峰分子(相当于基本贫血的苞片状结构)形成,但不能开发空绒毛和小花。相反,苞片状结构中的腋生分泌物产生连续的交替支化,从而导致显影穗中的树枝的珊瑚形形态。这bfl1突变港口单一Ds插入在上游区域BFL1染色体7对应于PAC克隆P0625E02(GenBank ACC编号消息URL http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=retrieve&db=ncerotide &list_uids=34395191&dopt=genbank& hertm=ap004570ap004570)。RT-PCR分析显示BFL1转录物水平的急剧降低bfl1突变体与野生型相比。在每种正常的胰穗子里植物中,从偶尔的植物繁殖的突变植物的恢复植物,Ds被证明可以从中切除bfl1轨迹。BFL1含有eREBP / AP2结构域,很可能是玉米转录因子基因的正交结果支化SILKLESS1(BD1.).
结论
bfl1是A.Ds标记的水稻突变体,在小穗分生组织(SM)向小花分生组织(FM)的转变过程中有缺陷。BFL1最重要的是玉米ERF(eREBP / AP2)转录因子基因的稻米矫形器BD1..基于在突变表型的相似性bfl1可能是先前报道的等位基因吗毛茸茸的穗轨迹。
背景
分生组织的有序产生和特定的命运对植物结构的正常发展至关重要。茎顶分生组织(SAM)是植物所有空中结构的最终来源,包括花序和花。一个给定的分生组织的身份是由它产生的结构类型来定义的[21.].SAM在其植物发育阶段产生叶子,但在切换到生殖发展阶段之后开始产生花序分生效[23.].
在该复杂过程中涉及的大量基因可以分为三类,即开花时间基因,分生形式基因和器官身份基因[18.].开花时间基因是参与从植物营养公司转变为生殖分泌的人。已经描述了影响开花时间的许多突变拟南芥[3.那6.那18.那27.]和一些水稻[12.那38.].一旦这种转变完成,花序分生组织(IM)产生中间分生组织,中间分生组织产生小花分生组织(FMs),产生花器官[21.].
许多分生组织和器官同源基因已被研究拟南芥和Antirrhinum.[28.].虽然预期单焦点将具有与Dicots那些类似的开花的分子和遗传机制,但对小穗形成的遗传知之甚少 - 一种对稻米和玉米等草独有的特征。影响开发突变体的许多发育突变体已被分离在玉米中[21.但是,到目前为止,只有少数相应的基因被克隆。玉米Knotted1.(KN1.)是一个这样的小穗分生组织(SM)标识基因,它编码一个含有同源结构域的蛋白质,作为转录因子[33.].这KN1.突变体由于开花单次维护中的缺陷而发育较少的分支和小穗对[14.].另一个玉米基因Ligulless2.(LG2.)已被证明编码碱性亮氨酸拉链(BZIP)蛋白,以及LG2.突变植物减少了长长的流苏分支[34.].其中一个表征玉米SM同一性基因是INDETERMINATE SPIKELET1(IDS1)编码的AP2样转录因子,和突变基因IDS1.通过抑制小穗分生组织内不确定的生长而确定的命运[8.].最近,另一种玉米SM同一性基因支化SILKLESS1(BD1.),编码含有ERF(EREBP / AP2)结构域的转录因子并表征[9.].由SM的横向域内抑制不确定分支命运BD1指定SM同一性[9.]在玉米耳朵发展中调解从小穗到Floret Meristem的转变起着至关重要的作用[10.].这BD1.突变体显示高度分枝耳[9.那10.].
尽管在水稻中已有超过20种控制穗型形态的基因报道[17.,很少有人被详细分析[15.那22.迄今为止没有人克隆。但是,一些小稻草的Floret Meristem身份基因拟南芥和Antirrhinum.已经克隆了,并调查了表达模式。例如,在拟南芥和Antirrhinum.,IM的不确定状态维持终端花朵(TFL1) 和CENTRORADIALIS(c),分别。这些基因的突变导致IM转化为终端花[7.那25.].表达的RCN1.和RCN2.,两个米饭tfl1 / cen.原子然关然的导致由于从分支拍摄到FM的延迟切换而导致生殖阶段和更多分支圆锥的延迟过渡[23.].表达模式RFL.,水稻同源物antirrhinum floricaula(flo)和拟南芥叶子(LFY.)的基因,表明它从起着明显,不同的角色LFY.在拟南芥和漂浮在Antirrhinum.[16.].最近,一个BD1-类似基因也已经从水稻中克隆出来,但功能尚未确定[9.].
在这里,我们报告了一个孤立Ds- 指定的稻米突变体支链floretless 1(bfl1)和识别分枝Flortless 1.(BFL1)基因。这bfl1突变体的初生轴支分化正常,形成初期的SM(相当于退化颖片的苞片状结构),但没有发育出空颖片和小花。相反,退化颖片中的腋生分生组织产生连续的交替分枝,从而产生高分枝的圆锥花序。BFL1编码含有eREBP / AP2结构域的转录因子,与米相同BD1-比如最近克隆的基因[9.].基因型和表型分析bfl1突变体和BFL1回复突变表明BFL1是从SM到FM水稻过渡至关重要。
结果
bfl1在从SM到FM的转变中是一种突变体缺陷
20个诱变植物B2-8A-2-18(F.2世代)由杂交而来IAC.和DsG转基因级[31.[我们发现突变植物(B2-8A-2-18-16),胰穗特征类似于先前报告的EMS诱导的毛茸茸的穗突变体FZP.[20.]和γ射线诱导的毛茸茸的穗突变体FZP2.[15.].我们指定了这个突变体支链floretless 1(bfl1).
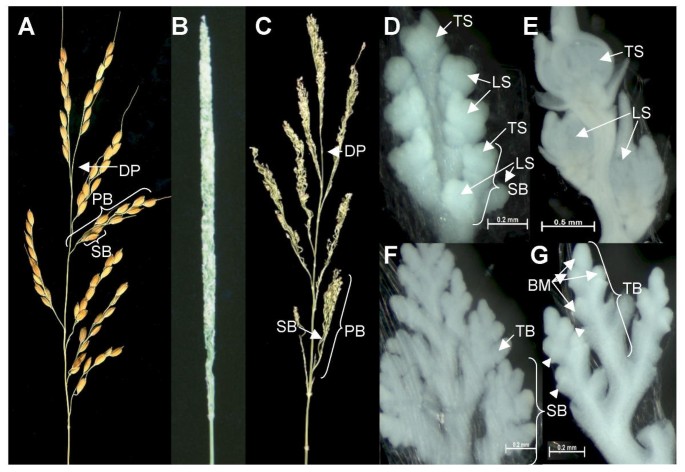
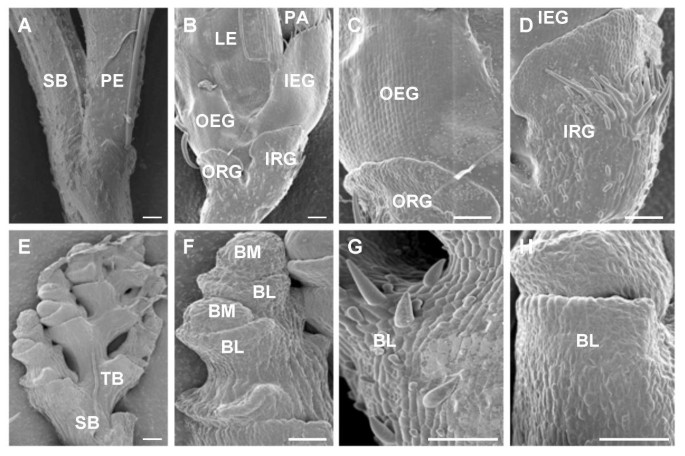
穗的圆锥bfl1突变看起来像一根棍子和脊柱支行从未因为纠缠(图舒展。1B.).主要rachis-分支的发展似乎是正常的(图。1C).野生型的穗长和穗长bfl1突变体分别为15.5cm和14.9cm,分别为野生型和突变体的主要脊柱分支的数量分别为6.1和6.4。然而,初级和次级顺序rachis-分支的横向和末端尖峰未能产生小花。相反,它们继续在交替轴上生产下一个rachis分支(图。1G那2e),最可能发生在苞片状结构发生后(图。1f,1g那2 e, f).如在扫描电子mirgrographs商(SEM)观察到的,苞片状的突变体(图结构。2 f, g, 2 h)对应于野生型的基本浮华(图。2 b 2 c 2 d),因为它们的位置和表面相当。该突变体在营养生长和从营养期到生殖期的过渡时间方面与野生型植株没有差异。
野生型的花序形态bfl1突变体。一个,野生型成熟穗。B,成熟穗bfl1突变体。C,手动拉伸成熟穗bfl1突变体。D,野生型野生型野生型在穗状花序和小穗器官分化之间的阶段,其由二次rachis-分支(Sb),横向小穗(Ls)和末端小穗(Ts)组成。E,微孢子发育阶段的野生型继发性rachis-分支,由横向小穗和末端小穗组成。F,主要rachis分支bfl1D等发育阶段的突变体,连续发育交替较高水平的轴-枝而不是小穗。G,次生轴支bfl1突变体在相当于发育阶段到E.缩写:DP:简并点;PB:一次枝梗分支;SB:次级穗轴分支;LS:横向小穗;TS:终端小穗;TB:第三节rachis分支;BM:分支分生组织;RG:初步的颖片(以三角形表示)。
扫描电子型野生型穗结构的电子mircromums(SEM)bfl1突变体植物。野生型穗分支(Sb)和Peedel(PE)的二次rachis-分支(Sb)和Pedicel(PE)的连接。B,穗状花转果的基底部分的特写镜头显示野生型穗器官。C,外基泡沫(ORG)表面的特写镜头和野生型小穗的外空灌注(OEG)。空绒毛的细胞有序排列并具有平滑的平坦表面,而基本薄膜的细胞具有不规则的形状和剥脱表面轴承毛状结构。D,内部基本的夹竹(IRG)的野生型,具有短毛或长发。e,次级rachis分支bfl1然后形成三级和更高阶的轴-分枝,在交替的轴上连续发展。F,苞片状结构(BL)和轴-分支分生组织(BM)bfl1.在差异化BL之后,BM要么逮捕其生长或继续产生新的BL。由于表面结构的相似,最可能的BL相当于基本糊状物。g和h,bl的表面的特写视图bfl1.所有图中的条形为100μm。缩写:SB:次级Rachis-Branch;TB:第三节rachis分支;PE:小穗的花梗;org:外基泡沫;IRG:内径的灌注;OEG:外空灌注;IEG:内部空灌注;PA:PALEA; LE: lemma; BL: bract-like structure; BM: branch meristem.
bfl1是A.D.标签突变体
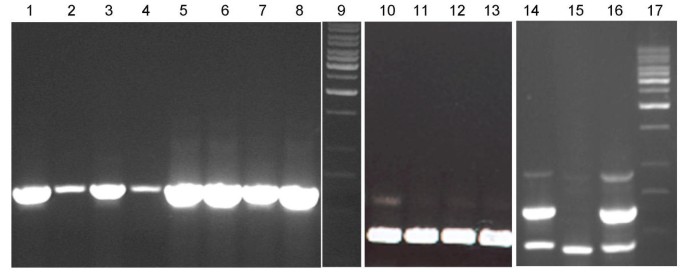
PCR分析表明,原始bfl1突变既包含IAC.和Ds(表2)对于GFP(T-DNA或Ds发射台选择标记),表示转置Ds和IAC.没有隔离,但原来Ds发射台被隔开了。作为IAC.有目前,切除Ds并且可能恢复到野生型的表型是可以预期的。因此,突变植株进行营养繁殖以恢复逆转事件后产生的种子。
在这样的营养繁殖植株中,在一个分蘖内或不同分蘖内发现了几个反向区(图。3、3 b).共15个正常成熟种子(图2)。3E),11种无菌和异常的种子(图。3 f, g)和6个不完全小穗(图。3 h)获得了。这些15个推定的回复突变的种子,发芽10(PR1至PR10),并生长至成熟。PR2,PR5和PR7显示正常穗发育和部分不育(图3C;桌子2),而其他7种植物(PR1、PR3、PR4、PR6、PR8、PR9和PR10)仍然显示bfl1表型(图。3d;桌子2).Ds-specific PCR结果显示PR2 - PR10阳性,PR1阴性(见表)2).后者归功于可能的DS3'随后的Southern杂交杂交分析中所示的结束截断(见下文)。
DS3'(LW1125;基因库Acc。不。信息URL http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=nucleotide&list_uids=33771666&dopt=GenBank&term=bfl1AY343496)和DS5'(LW1455; Genbank登录号NP_001556号消息URL http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=nucleotide&list_uids=33771665&dopt=GenBank&term=bfl1AY343495)侧翼序列从被救bfl1突变体和PR1使用尾PCR [19.]和质粒救援系统。初始搜索(2002年2月)未能识别来自Genbank(NCBI)数据库的任何同源序列,而是中国水稻基因组数据库http://btn.genomics.org.cn/rice/含有一个表现出同源性的一个条目(Contig 239)bfl1侧翼序列。PCR表征bfl1因此,基因座和基因预测是基于contig239。随后,Ds在插入bfl1突变体被映射到对应于PAC克隆P0625E02的水稻染色体7(GenBank ACC号消息URL http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=retrieve&db=ncerotide&list_uids=34395191&dopt=genbank& hertm=ap004570ap004570).
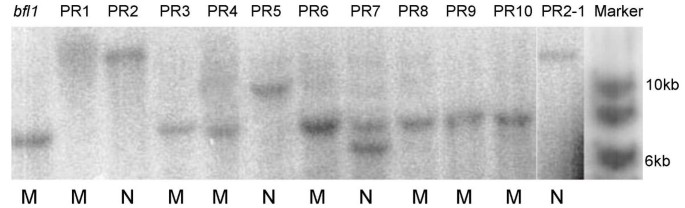
南方印迹杂交分析格斯探针(用3'末端杂交Ds插入)表明bfl1变种人只有一个副本Ds显示一个7.2 kB正杂交带(图。4.).Pr3,Pr4,Pr6,Pr8,Pr9和Pr10也具有相同的7.2kb带和显示突变圆锥,表明它们是纯合的Ds从配子的与自花授粉产生的插入植物Ds在里面bfl1轨迹。然而,PR1产生突变圆锥但没有显示任何积极杂交的带,表明删除了3'区域Ds包括格斯基因序列。Pr2和Pr5没有相同的7.2 kB频段,但有一个不同的尺寸,表明它们是纯合的回归者Ds从中切开bfl1并重新插入到水稻基因组的其他位置。PR7除了7.2 kb外,还有一个额外的正杂交带,表明它是一个杂合子,由与Ds在里面bfl1由一个被重新转置的配子的轨迹Ds.因此,正常的碱显影似乎是由切除的Ds来自bfl1轨迹。基于CONTIG 239和PAC克隆P0625E02的序列,南部印迹分析中的正杂交带的预期尺寸hDIII消化bfl1突变植物DNA与格斯探针为9.3 kb。然而,观测到的波段大小约为7.2 kb。对已公布的该片段序列的仔细观察表明,单个核苷酸替换可能导致额外的核苷酸hDIII限制性位点,以及较短的积极杂交带。我们尝试在包括新扩增的DNA的基因组DNA的各种来源中定位可能的核苷酸取代,但未能看到任何NT过渡。最有可能这种特殊的转变在Nipponbare的不同样本之间变化。的位置h由于可能的转变而形成的dIII RE识别位点如图所示。6..然而,我们的基因组序列都侧翼Ds3(Genbank登录号NP_001556号消息URL http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=nucleotide&list_uids=33771666&dopt=GenBank&term=bfl1AY343496)和Ds5(GeneBank中加号消息URL http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=nucleotide&list_uids=33771665&dopt=GenBank&term=bfl1AY343495)端unambigously映射的位置Ds插入。
Southern杂交分析Ds在插入bfl1突变体和Ds在回复突变体切除。从推测的还原物中提取基因组DNA (~10 μg),用酶切酶解后III,在0.7%琼脂糖凝胶上分离,并涂抹到Hybond-N上+膜。该膜与a格斯探针(见图6.).pr1至pr10是原始的还原剂bfl1突变体和PR2-1是PR2的后代之一。缩写:n,野生型表型;m,突变表型。
进行三套PCR的确认一个的存在或不存在Ds在插入bfl1位点:PCR1扩增Ds插入;PCR2和PCR3扩增5'和3'末端的一部分Ds元素及其侧翼基因组区域1;无花果。6.).PR2和PR5的PCR1阳性,PCR2和PCR3阴性,证实它们是纯合子逆转录。PR7的PCR1、PCR2和PCR3呈阳性,证实它是一个杂合子逆转体(见表)2).通过后续分析后代植物来证实PR2,PR5和PR7的基因型。PR1的PCR结果证实它有一个Ds3“截断(表2).所有其他植物都对PCR1和PCR2和PCR3阳性的阴性是阴性的,这表明没有切除的Ds元素来自bfl1轨迹。
以上分析强烈地建议插入Ds是原因bfl1突变和切除的Ds来自bfl1基因与基因突变的逆转有关。
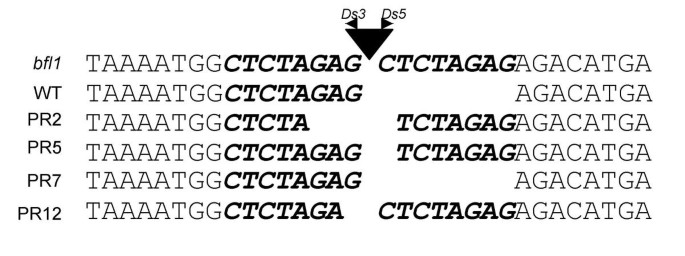
这是一个众所周知的事实Ds插入它会创建8个BP主机序列复制。但是,当Ds重新切除它通常会留下这种直接重复序列的占地面积。DsPR2,PR5,PR7和PR12的切除占地面积显示,分别保持4,7,0和7bp的保留宿主序列(图。5.).虽然可以通过切除恢复正确的阅读框架Ds在PR7,读取框不会恢复PR2,PR5和PR12,表明Ds插入不在编码区域BFL1基因,但在其非编码或监管区域。
基因组位置BFL1和Ds插入bfl1突变体.的位置示意图BFL1基因和Ds插入bfl1水稻基因组PAC克隆P0625E02(Genbank Acc。WO.AP004570)中的突变体。的方向BFL1基因(P0625E02.25)由箭头表示。引物的结合位点DS5-112-(P1),DS3-6587+(P2),LW1125_REV(P3),LW1125_FOR(P4)用于RT-PCR中使用的PCR1,PCR2和PCR3和OSBFL1_REV2(P5)和OSBFL1_FOR(P6)(参见表2详情)。实线代表格斯用于Southern印迹杂交分析的探针。hdIII限制性位点指示(H)。
随后,我们获得了额外的回复,包括一个完整的正常穗34个种子。当26粒种子萌发成熟时,表现出纯合子未切除的分离Ds(DS / DS.),杂合Ds切除(DS / +)和纯合子Ds切除(+ / +)的比例为1:2:1(6:13:7)。全部Ds切除植物具有与PR12相同的切除占用脚印(表2和无花果。5.),表明曾有过生发切除Ds在从营养阶段到生殖阶段的转变过程中。
BFL1是一种转录因子基因与EREBP / AP2结构域
中国水稻基因组数据库中~ 30kb contig 239的10-kb序列分析BFL1轨迹由基因预测程序FGENESHhttp://www.softberry.com/berry.phtml/和GENSCANhttp://genes.mit.edu/GENSCAN.html鉴定了能够使用植物转录因子的eREBP / AP2系列DNA结合结构域进行编码蛋白质的单外显子基因[26.那36.],位于海平面下游1515 bp处Ds插入。随后,在水稻PAC克隆P0625EO 2序列中预测相同的基因(图。6.).预测的信息URL http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=nucleotide&list_uids=34899319&dopt=GenBank&term=P0625E02.25P0625E02.25蛋白与我们预测的318个氨基酸蛋白相对应。鉴于EREBP/AP2结构域基因的功能,并将其切除Ds来自bfl1轨迹导致伴随着正常开发的胰腺的遗迹,我们得出结论,这种eREBP / AP2-域基因可能是BFL1基因。此外,损失或减少的突变体植物中的表达BFL1的用基因特异性RT-PCR使用从叶分离的总RNA和显影圆锥花序(图证实。7.).BFL1以野生型叶片和开发圆锥形表示,但大大减少了bfl1突变体。在RT-PCR分析中,在RT-PCR分析中显而易见的BFL1在RTα圆锥上的表达(图。7.).然而,由于表达水平非常低,我们无法通过Northern印迹分析备用RT-PCR结果。
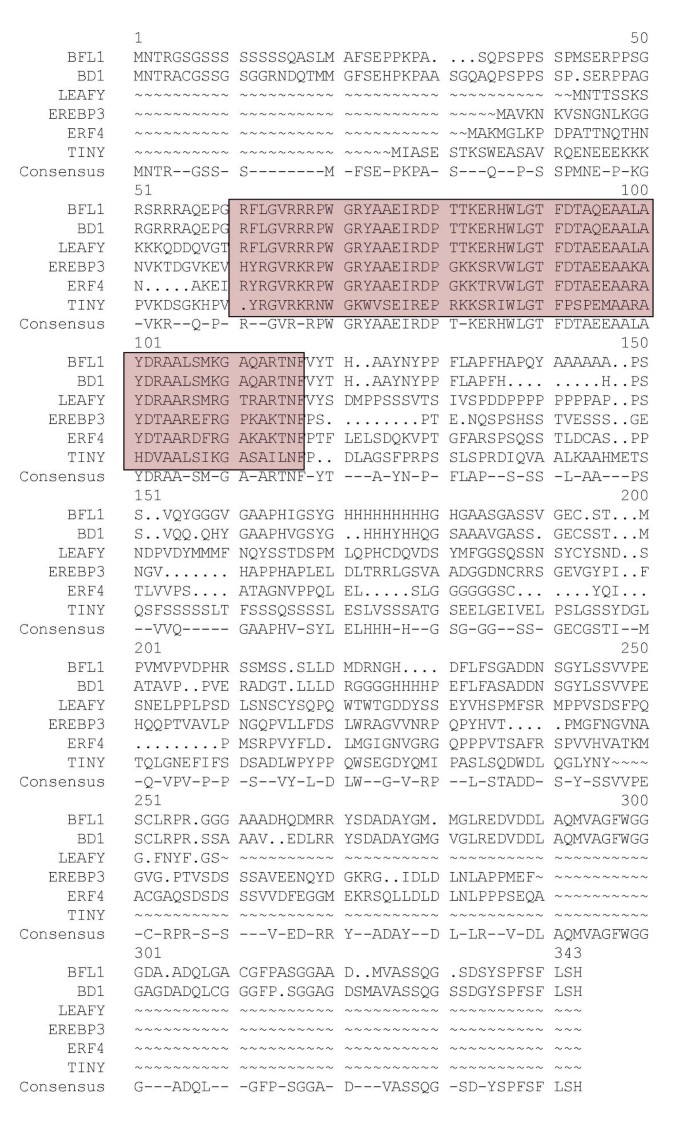
erebp / ap2域BFL1被发现与最近孤立的玉米的ERF领域相同BD1.基因和水稻的基因BD1.-like基因[9.].BFL1的EREBP/AP2结构域也与II类erf的结构域(如叶状叶柄和微小)具有高度的相似性拟南芥[32.那37.而在叶柄中,BFL1的EREBP/AP2结构域位于蛋白质的n端附近(图2)。8.).
与其它ERF转录因子BFL1的EREBP / AP2结构域的比较。BFL1、玉米BD1、烟草EREBP3和拟南芥使用GCG的堆积计划的叶茂叶柄,微小和ERF4蛋白[11.],间隙重量为8,间隙长度重量为2。用GCG的PRETTY程序导出一致性序列,其最小复数为2。EREBP/AP2 (ERF)域被装箱。注意,BFL1和BD1在预测的氨基酸序列和相同的EREBP/AP2结构域上有80%的同源性。
讨论
BFL1在水稻穗部发育过程中,调节SM向FM的转变
在米饭中,在过渡到生殖阶段之后,SAM切换到IM中,从中旋流分支分子(PBMS)在螺旋螺旋状中引发。已经启动了给定数量的PBM后的IM退化。同时,主Rachis分支分化为次级rachis-分支分子(SBMS)或横向小穗分泌分析(LSM),并且由终端Spikelet商品(TSMS)终止。短信产生两对釉,基本和空绒布,以及由引理,宫,鹦鹉,雄蕊和卡片组成的单个小花香[29.].因此,水稻花序或尖锐菌表示由轴承伯和次级脊柱支线,横向和末端尖峰的主要尖峰组成的分支结构(图。1A).每种米穗均含有单个小花香,一对空卷发和一对鲜艳的困难与玉米中存在的一对卷发和两只小花,但仍然可以解决空虚的困难或基本贫血是否类似于玉米浮华[5.那13.那29.].
在里面bfl1突变体,尽管SAM的发育是正常的,直到产生初级脊柱分支(PBS),横向和末端尖峰被次级脊柱分支(SBS)取代,然后在脱节的植物中连续发起高阶分枝,导致不确定的phylloxy分枝穗。基于我们的观察,尖峰的基本贫瘠似乎通常是通常作为苞片状结构启动bfl1突变体(无花果。1G那2f.)但随后的短信停止了开发,未能产生空泡沫和FM,相反,它们的身份转换为分支商品(BM)的身份,表明获取SM标识,但未能从SM转换为FM。因此,我们提出BFL1的功能是压制小穗内的BM身份,或者积极调节FM的启动。同样,在玉米中BD1.突变体,穗SMs不能转运到FMs,并继续产生颖片和小穗状结构[10.].正如我们认为Spikelet启动所发生的bfl1假设苞片状结构(基本浸泡)实际上是实际困难的逻辑,如前所述[29.].
BFL1是玉米的米饭BD1.基因
接近完整的水稻基因组序列的公开可用性(http://www.ncbi.nlm.nih.gov/;http://rgp.dna.affrc.go.jp/;http://btn.genomics.org.cn/rice.;http://portal.tmri.org/rice/)允许我们找到单身Ds在插入bfl1水稻染色体7上对应于PAC克隆P0625E02的突变体,表明最有可能受此影响的基因Ds插入是一个其编码EREBP / AP2结构域样蛋白(消息URL http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=nucleotide&list_uids=34899319&dopt=GenBank&term=P0625E02.25P0625E02。25)。由于该领域是相同的最近报道的玉米的ERF域BD1.基因和米饭BD1.- 比如基因[9.我们得出结论BFL1是玉米的米饭BD1..
尽管ERF蛋白被认为是参与乙烯反应的植物特异性转录因子[24.,它们也与植物发育有关[4.那32.那37.].ERF蛋白在子组织中的作用的直接证据来自玉米的表征BD1。这BD1.基因介导玉米穗发育过程中小穗向小花分生组织的转变[9.那10.]其表达在穗状花套和小花序期间在时间上和空间上调节[9.].玉米之间的强大表型相似BD1.突变体和我们的水稻bfl1突变体进一步支持我们的声明BFL1是大米ortholog的BD1..
Northern blot检测不到BFL1的转录本很可能是由于其低表达。这种低表达水平的转录因子基因并不罕见,例如BFL1.然而,在最佳条件下使用RT-PCR的表达研究表明BFL1转录水平的大幅降低bfl1与野生型相比的突变体并在回复剂中恢复(图。7.).需要进一步研究BFL1在野生型,突变和复发植物中的空间和发育表达模式,以确定BFL1表达的调节。
这Ds插入bfl1块转录的形成起始复合物的BFL1
根据我们的预测,转录BFL1从翻译开始站点(TSS)的上游的121 nt开始。一个塔塔盒子和Ds插入位点分别位于TSS上游157和1515 nt,提示Ds插入不在核心启动子区BFL1基因。观察到的突变表型和RT-PCR数据表明了Ds插入严重影响了表达式BFL1基因,因此表明有效转录起始所需的核心启动子上游的区域BFL1基因。这Ds插入bfl1最可能阻断转录起始复合物的组装,该复合物不仅包括核心启动子,还包括近端和远端增强子元件。需要对这些调控元件进行进一步的研究,以揭示其转录控制BFL1.很明显,在这一复杂的调控途径中还涉及其他几个基因,对这些基因的识别对于理解草类特有的三步转变(从枝到小穗到小花)至关重要。
方法
植物材料和生长条件
本研究中使用的所有水稻系都来自日本栽培品种Nipponbare。这bfl1本文中描述的突变体最初在f中得到认可3.世代植物由杂交而来IAC.(pSK300 TT3-24-1-1)Ds基因陷阱(DsG, pSK200, TT2-10-1-1)转基因株系,此前由Upadhyaya等人(2002)所描述。这IAC.和DsG二元载体构建、组织培养和农杆菌属先前描述了使用的转换程序[30.那31.].植物在受控玻璃室条件下生长,25±3℃,21°C夜间温度,16小时长。
DNA提取和Ds侧翼序列救援
使用PureGene核酸分离试剂盒(Gentra Systems Inc.)从植物中提取基因组DNA。明尼阿波利斯,MN,美国)根据制造商的说明。DS5'和DS3'使用内置质粒救援系统拯救侧翼序列[31.]及TAIL-PCR [19.], 分别。对于质粒救援,用〜2μg基因组DNA消化囊I,用苯酚/氯仿萃取,在含有5个Weiss单位T4 DNA连接酶的500 μl连接混合物中沉淀,16℃过夜自连接。将连接的DNA经乙醇沉淀后电穿孔。质粒克隆经适当的限制性内切酶分析后,选择进行测序。采用嵌套式引物Ds3_1、Ds3_3、Ds3_6587进行尾pcr+和任意的简并引物AD2(表1)刘和其他人说19.]微小修改。使用DS3_6587重新扩增纯化的PCR产物+和AD2确保测序反应的成功。根据制造商的说明,用Abi Prism的Abi Prism的试剂(Applied Biosystems,Foster City,CA)的试剂进行测序。
序列分析
使用BLAST程序进行DNA序列比较[1那2]对NCBI GenBank中搜索http://www.ncbi.nlm.nih.gov/和中国的籼稻序列数据库http://btn.genomics.org.cn/rice..该ORF被认定使用FGENESHhttp://www.softberry.com/berry.phtml/和GENSCANhttp://genes.mit.edu/GENSCAN.html.erebp / ap2域的对准是使用遗传学计算机组威斯康星软件套装的程序进行的[11.].
南方印迹杂交
对于Southern印迹杂交分析,消化基因组DNA(〜10μg)hDIII,在0.7%琼脂糖凝胶上分离,并呈上搭扣物+膜(Amersham Life Science, England),根据制造商的说明。这格斯基因的DsG用Megaprime使用构造用于准备放射性标记的探针TMDNA标记系统根据制造商的说明(Amersham公司生命科学,英格兰)。将膜在42℃杂交6小时,在60℃下用0.1×SSC和0.1%SDS洗涤,并利用磷光体成像仪(分子动力学,桑尼维尔,CA,USA)通过放射自显影显示。
PCR条件
PCR引物(表1)使用“遗传学计算机集团(GCG)威斯康星州软件套装”的“Prime”计划设计了[11.].Ds插入植物通过分析AC.(引物Ac_1931+和AC_2382.-) 和Ds(引物GUS_313-和GPAInt)特异性PCR扩增。PCR程序如下:94°C 2分钟、58°C 30秒、72°C 1分钟30个循环,最后72°C 5分钟。确认存在或不存在Ds在插入bfl1基因座,一组引物退火到侧翼区域Ds基于已发表的水稻基因组序列设计(中国基因组数据库的Contig 239http://btn.genomics.org.cn/rice..用引物LW1125_For和LW1125_Rev扩增了侧边区Ds插入。PCR2带引物LW1125_REV和DS5_112-和PCR3带LW1125_FOR和DS3_6587+5'和3'末端的扩增部分Ds元素及其侧翼基因组区域1;无花果。6.).PCR条件为94°C 2分钟,60°C 30秒,70°C 1分钟,最后70°C 5分钟,共30个循环。
通过RT-PCR与突变体和野生型RNA样品中的BFL1转录水平进行可视化BFL1特定引物(表1)根据制造说明,使用Onestep RT-PCR套件(Qiagen Inc,California,USA)试剂。特异于水稻蔗糖合成酶基因的引物RSS1.[35.使用]作为内部对照进行RNA完整性和DNA污染。
在审稿时添加的注释
这毛燥穗肥基因也被证明是玉米的同源基因BD1.最近发表的文章“Komatsu M, Chujo A, Nagato Y, Shimamoto K, Kyozuka J(2003)”毛燥穗肥需要防止腋分生组织的形成和水稻小穗建立花分生组织的身份。发展,130(16):3841-50" ,因此bfl1是一个等位基因毛茸茸的穗.
参考
- 1。
Altschul SF,Gish W,Miller W,Myers EW,Lipman DJ:基本的本地对齐搜索工具。J Mol Biol。1990年,215:403-410。10.1006 / jmbi.1990.9999。
- 2。
Altschul SF, Madden TL, Schaffer AA, Zhang J, Zhang Z, Miller W, Lipman DJ: gap BLAST和psp -BLAST:新一代蛋白质数据库搜索程序。核酸学报1997,25:3389-3402。10.1093 / nar / 25.17.3389。
- 3.
Araaki T:从植物转变为生殖阶段。CurrOp植物BIOL。2001,4:63-68。10.1016 / s1369-5266(00)00137-0。
- 4.
Banno H,Ikeda Y,Niu QW,Chua NH:过度表达拟南芥ESR1诱导射击再生的启动。植物细胞。2001,13:2609-2618。10.1105 / TPC.13.12.2609。
- 5.
贝尔广告:植物形式:开花植物形态的插图指南。纽约:牛津大学出版社1991年出版社。
- 6.
Blasquez M:花开发途径。J Cell SCI。2000,113:3547-3548。
- 7。
Bradley D,Courpenter R,Copsey L,Vincent C,Rothstein S,Coen E:花序架构控制Antirrhinum..自然。1996年,379:791-797。10.1038 / 379791a0。
- 8。
玉米小穗分生组织命运与apetala2基因的关系不定spikelet1.基因开发。1998年,12:1145至1154年。
- 9。
陈志强,陈志强,陈志强,等。小穗分生组织同源性的研究进展[j]支SILKLESS 1玉米基因。科学。2002,298:1238-1241。10.1126 / Science1076920。
- 10。
Colombo L,Marziani G,Masiero S,Wittich Pe,Schmidt RJ,Gorla Ms,EnricoPèm:分支纯粹期间从小穗到花分生组织的过渡Zea Mays.耳朵的发展。植物学报,1998,16:355-363。10.1046 / j.1365 - 313 x.1998.00300.x。
- 11.
VAX序列分析的一套综合程序。核酸学报1984,12:387-396。
- 12.
Hayama R,Yokoi S,Tamaki S,Yano M,Shimamoto K:对皮肤过敏的适应在水稻中产生短日开花。自然。2003,422:719-722。10.1038 / Nature01549。
- 13。
星川K:生长中的水稻植物。东京:Nobunkyo 1989。
- 14。
Kerstetter Ra,Laudencia-Chingcuanco D,Smith Lg,Hake S:玉米Homeobox基因中的功能丧失突变,Knotted1.,在拍摄分生组织维修有缺陷的。发展。1997年,124:3045-3054。
- 15.
Komatsu M,Maekawa M,Shimamoto K,Kyozuka J:TheLAX1和毛茸茸的穗2基因通过控制轴-枝和小穗的发育来决定水稻的花序结构。作者简介:王志强,男,博士生导师。10.1006 / dbio.2000.9988。
- 16.
Kyozuka J,Konishi S,Nemoto K,Izawa T,Shimamoto K:RFL的下调,水稻的FLO / LFY同源物,伴随着胰穗分支机。Proc Natl Acad Sci U S A. 1998,95:1979-1982。10.1073 / pnas.95.5.1979。
- 17。
Kyozuka J:米的花开发。在水稻的分子生物学中。编辑:Shimamoto K. 1999,东京:Springer-Verlag,101-118。
- 18。
Levy YY,Dean C:过渡到开花。植物细胞。1998年,10:1973-1990。10.1105 / TPC.10.12.1973。
- 19。
刘yg,mitsukawa n,oosumi t,whittier rf:有效的隔离和映射拟南芥蒂利亚纳T-DNA通过热不对称隔离PCR插入结。工厂J. 1995,8:457-463。10.1046 / J.1365-313x.1995.08030457.x。
- 20。
Mackill DJ,Pinson SRM,Rutger JN:卷曲的圆锥花序,为ems诱变粳稻M-201的突变体。水稻学报,1992,9:100-102。
- 21。
McSteen P,Laudencia-Chingcuanco D,Colasanti J:任何其他名称的小花:控制玉米的营销标识。趋势植物SCI。2000,5:61-66。10.1016 / S1360-1385(99)01541-1。
- 22。
王志刚,王志刚:水稻穗部形态调控的主要基因。品种。中国科学(d辑):地球科学(英文版)。
- 23。
Nakagawa M,Shimamoto K,Kyozuka J:过度表达RCN1.和RCN2.、大米终端花1 / Centroradialis同源物,赋予水稻中相转变和改变穗形态的延迟。工厂J. 2002,29:743-750。10.1046 / J.1365-313x.2002.01255.x。
- 24。
奥默-高木男,新稀H:乙烯 - 诱导的DNA结合蛋白,其与乙烯 - 反应元件相互作用。植物细胞。1995年,7:173-182。10.1105 / tpc.7.2.173。
- 25。
大岛S,村田男,坂本W,小仓Y,本吉F:克隆和分子分析拟南芥基因终端Flower1.Mol Gen Genet。1997年,254:186-194。10.1007 / S004380050407。
- 26。
RIECHMANN JL,MEYEROWITZ EM:AP2 / EREBP植物转录因子系列。Biol Chem。1998年,379:633-646。
- 27.
SIMPSON GG,Gendall AR,Dean C:何时切换到开花。Annu Rev Cell Dev Biol。1999,15:519-550。10.1146 / annurev.cellbio.15.1.519。
- 28.
Soltis De,Soltis PS,Albert VA,Oppenheimer DG,Depamphilis CW,Ma H,Frohlich MW,Theissen G:缺失链接:花卉和花卉多样化的遗传建筑。趋势植物SCI。2002,7:22-31。10.1016 / s1360-1385(01)02098-2。
- 29。
takoka Y, Shimizu M, Wada T:圆锥花序。水稻植物科学。编辑:星川TM。1993,东京:信汶京,I: 295-338。
- 30.
Upadhyaya NM,Surin B,RAMM K,Gaudron J,SchünmannPHD,Taylor W,Waterhouse PM,Wang M-B:农杆菌属用改性启动子和可选标记相关的澳大利亚水稻品种Jarrah和Amaroo的转化。AUST J植物理体。2000,27:201-210。10.1071 / pp99078。
- 31。
乌帕德亚雅NM,周X-R,诸Q-H,拉姆K,吴L,Eamens A,西瓦库玛R,加藤T,芸d-W,Santhoshkumar C,纳拉亚南KK,孔雀JW,丹尼斯ES:一个IAC / DS.基因和增强捕捉系统,为水稻插入突变。Funcl植物生物学。2002年,29:547-559。
- 32。
范德格拉夫E, Dulk-Ras AD, Hooykaas PJ, Keller B:激活标签绿叶叶柄基因影响叶柄发育拟南芥蒂利亚纳.发展。2000,127:4971-4980。
- 33。
VOLLBRECHT E,VEIT B,SINHA N,HAKE S:发育基因作响1是玉米Homeobox基因家族的成员。自然。1991,350:241-243。10.1038 / 350241A0。
- 34。
沃尔斯j,freeling m:theLigulless2.玉米营养茎尖向生殖茎尖过渡过程中基因的功能。植物学报,1999,19:489-495。10.1046 / j.1365 - 313 x.1999.00541.x。
- 35。
Wang M-B, Boulter D, GatehouseRSS1.)基因。植物生态学报,1998,19(4):491 - 498。
- 36。
Weigel D:Apetala2结构域与一种新型DNA结合结构域有关。植物细胞。1995年,7:388-389。10.1105 / tpc.7.4.388。
- 37。
威尔逊k,long d,swinburne j,unixand g:a解离插入导致半组体突变增加了微小的表达拟南芥与Apetala2相关的基因。植物细胞。1996,8:659-671。10.1105 / TPC.8.4.659。
- 38。
林海峰,林海峰,田志刚:水稻开花时间的遗传控制。植物营养与肥料学报。2001,27(4):431 - 434。10.1104 / pp.127.4.1425。
确认
作者感谢Kerrie Ramm、Ramani Shivakkumar、Celia Miller、Shu-Ting Pan和Kathryn Smith提供的宝贵技术援助。我们也感谢John Watson博士、Ming-Bo Wang和Andrew Eamens的批判性阅读和讨论。这项工作得到了GrainGene、农村工业研究与发展公司(RIRDC)和新南威尔士农业基因组学中心的支持。我们还要感谢Junko Kyozuka博士提供的有关信息毛茸茸的穗突变体。
作者信息
隶属关系
通讯作者
额外的信息
作者的贡献
在筛查人群中分离突变体,这是植物工业水稻功能基因组学组的综合努力http://www.pi.csiro.au/fgrttpub/members.htm..大部分植物分析采用QHZ,部分采用MSH。序列分析采用MNU和QHZ进行。QHZ、MNU和ESD参与了研究的设计、构思和协调。所有作者阅读并批准了最终的手稿。
作者为图像提交的原始文件
以下是与作者的原始提交的图像的链接。
权利和权限
关于这篇文章
引用这篇文章
朱,Qh。,荷马,M.S.,Dennis,E.S.et al。Ds标记分枝Flortless 1.(BFL1)介导从小穗到稻米的Floret Meristem的过渡(奥雅萨苜蓿l)。BMC植物杂志3,6(2003)。https://doi.org/10.1186/1471-2229-3-6
已收到:
公认:
发表:
关键字
- 拍摄顶端公司
- 花序分生组织
- 水稻同源基因
- 南方印迹杂交分析
- 终端小穗