抽象的
背景
Canavalia Rosea(SW。)DC。(海湾豆)是一种极端嗜盐植物,广泛分布在热带和亚热带沿海地区。水通道蛋白(aquaporins, AQPs)是一种通过细胞膜运输水和小分子的通道蛋白,从而在面对非生物胁迫时维持细胞水分稳态。在c . rosea, AQP的多样性、蛋白特征及其生物学功能仍在很大程度上是未知的。
结果
我们描述了AQPs在c . rosea利用进化分析结合启动子和表达分析。共鉴定出37个AQPsc . rosea基因组并分为五个亚组:11个血浆膜内在蛋白质,10个蛋白酶蛋白质内在蛋白质,11个Nod26状的内在蛋白,4个小和基本内在蛋白质和1个X内蛋白。RNA-SEQ数据分析和靶向QPCR揭示了Aquaporin基因的器官特异性表达以及一些AQP成员在适应方面的参与c . rosea到极端的珊瑚礁环境。我们也分析了c . rosea系统发生重建,蛋白质建模,细胞局部化和启动子分析序列。此外,pip1基因之一,CRPIP1; 5.,使用酵母表达系统和转基因过度表达鉴定为功能性。拟南芥.
结论
我们的研究结果表明AQPs在c . rosea盐碱土壤和干旱胁迫的响应。这些发现不仅增加了我们对AQPs在调节作用中的理解c . rosea适应极端环境,也提高了我们对植物水通道蛋白进化的普遍认识。
背景
Canavalia Rosea(SW。)DC。(也叫bay bean)是一种极端嗜盐和固氮的豆科植物,广泛分布于热带和亚热带的沿海地区,高度适应海水和干旱条件[1].的种子c . rosea具有营养和药用价值,该物种构成重要的野生植物资源。尤其,c . rosea较大多数本地物种具有更好的生长潜力,在热带和亚热带珊瑚岛及沿海地带的绿化、固沙、生态恢复等方面发挥基础性和开拓性的作用[2].沙质土壤、盐碱化和季节性干旱是限制沿海地区或珊瑚礁中许多植物生长的因素。Canavalia Rosea属于“红树林助理”组,其中一些精致的机制适应高盐水和碱性土壤和干旱胁迫在形态学和生理分子水平上发展。了解分子和进化机制c . rosea对特殊栖息地的适应将有助于阐明极端微生物对不利条件的适应。盐碱土壤和干旱胁迫都会导致植物细胞缺水[3.]从根水吸收到叶蒸腾的水分损伤,从根水吸收中导致4].鉴定响应水缺陷压力的基因c . rosea通过基因工程,对盐水 - 碱性和干旱相关性状的分子育种改善可能是有价值的。
水是任何生物系统的重要组成部分,植物表现出精细适应,在存在水分胁迫下保持存活。Aquaporins(AQPS)是通过形成水道控制跨膜水输送和植物细胞的跨膜水运输而起到关键作用的跨膜蛋白[5].除了水转运外,AQPs还促进尿素、H等小分子的转运2O2, NO,以及硼和硅等元素穿过细胞膜[6].水通道蛋白存在于多种物种中,包括微生物、动物和植物,是最古老的主要内在蛋白质(MIPs)家族。水通道蛋白传统上被分为四大类:质膜内在蛋白(PIPs)、液泡膜内在蛋白(TIPs)、nod26样内在蛋白(NIPs)和小的基本内在蛋白(SIPs) [7].此外,在一些植物基因组中,少量的AQPs被鉴定为第五个亚家族,称为X-intrinsic proteins (XIPs),这在单子叶植物和十字花科植物中是不存在的[8].此外,从苔藓中分离出的glpf样内在蛋白(GIPs) (Physcomitrella patens.)和在蕨类植物中发现的杂交内在蛋白质(HIPs) (卷柏moellendorffii)和苔藓(P. Paten.)在大多数植物中很少罕见,均分为AQP家族[9,10].
在结构上,几乎所有aqps都是由六个跨膜结构域(α-螺旋,H1至H6)组成,含有n和c termini面向细胞溶胶[11].六个跨膜结构域通过五个晶状体环(A-E)连接。保守的环(B和E)显示出极其疏水的特性,通常含有天冬酰胺 - 脯氨酸 - 丙氨酸残基(NPA基序)的内部重复。这些保守的疏水循环似乎是通过形成短螺旋来维持AQP功能的最重要特征[12,13].在大多数AQPs中,芳香/精氨酸区域(ar/R)和Froger的位置也保持不变[14].通常,将AQP插入到包含由AQP单体产生的四个独立孔的四聚体结构中的膜中插入膜中[15].除了水道蛋白外,一些AQP还参与促进CO的运输2[16], 不 [17],甘油[18], H2O2[19],一些三价元素[20.,以及一系列小型不带电溶质[21].很明显,AQPS在植物开发中展示了水吸收,营养平衡,长距离信号转移,营养/重金属采集的多功能功能,以及应力响应[22].
不像AQP酵母的成员(只有两个基因,AQY1和AQY2.)[23或动物(只有13AQPS在哺乳动物中)[24], 植物AQPS包含了巨大的、高度多样化的基因家族,这些基因家族可能与植物对当地条件的更强适应性有关,因为它们具有固着性[11,25].许多AQP在各种植物物种中使用cDNA和全基因组分析已经确定了基因系列,包括拟南芥(35名成员)[26],玉米(31名成员)[27[米(34名成员)[28].给予全基因组测序的进展,AQP- 最近在植物适应研究中获得了牵引力的研究,特别是对于烟道和耐旱植物的研究。靠近拟南芥,Eutrema salsugineum.已被认为是用于识别耐盐机制的exprobophier。AQP家族大肠salsugineum已经表征评估差异基因表达模式,研究主要集中在评估对盐,冷和干旱胁迫的反应[29,30.].鹰嘴豆(Cicer Arietinum.)具有比大多数豆类物种及其更好的耐水性AQP基因家族的特点是进一步调查其对水资源赤字的适应性[31,32].此外,AQPCassava的基因家族(木薯耐)是在许多非洲国家的重要粮食资源中的耐旱托管块,已经表现出其演变,结构和表达模式[33].Canavalia Rosea比大多数豆科植物更耐旱、高盐、热、低氮、低磷。因此,确定一套完整的AQP年代内c . rosea(CRAQPS.),并进行比较分析,以了解它们的进化关系,特别是它们对沿海和珊瑚礁生境的适应能力。
在我们的研究中,全基因组序列数据的可用性c . rosea促进全基因组分析,以确定进化关系之间c . roseaaqps和相关豆科物种的AQP。我们表征了结构CRAQP.S及其染色体位置.我们还调查了表达概况CRAQP.各种组织中的基因,响应于不同的非生物胁迫源,以及不同栖息地以及启动子分析。另外,单个血浆膜内在蛋白基因,CRPIP1; 5.,使用异质转基因测定功能鉴定。
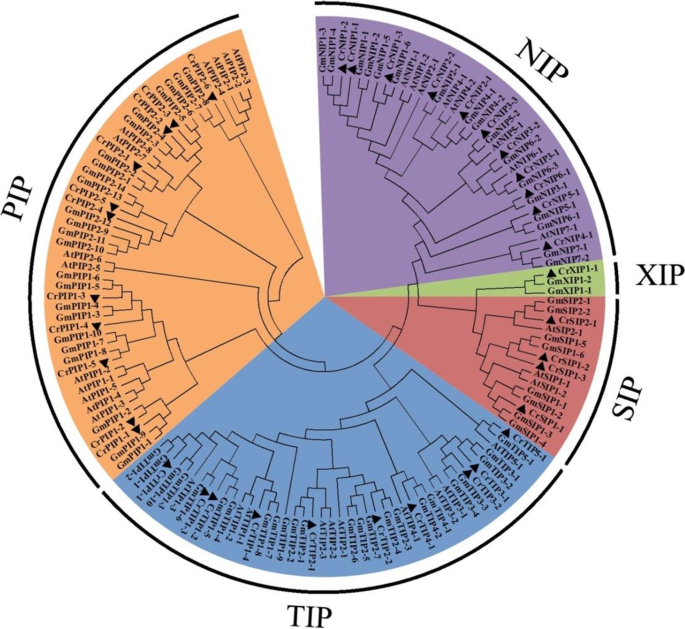
结果
鉴定c . roseaAQP家庭
基于BLAST蛋白研究和Hidden Markov模型剖面(Pfam ID: PF00230)搜索,共鉴定并注释了37个CrAQP成员c . rosea基因组数据库。一组CrAQPs包括11个nip、11个pip、10个TIPs、4个sip和1个XIP(表1),根据其与ATAQP和GMAQP蛋白的系统发育和序列同一性关系命名(表1).通过多序列比对,构建了水通道蛋白(AQPs)的邻域连接系统发育树c . rosea,拟南芥和大豆(图。1).聚类结果清楚地表明,只有一个序列编码了XIP蛋白c . rosea.此外,SIP子族中c . rosea(CRSIP)具有比其他三个亚属植物更小但更保守的聚类c . rosea(CRNIP,CRPIP和CRTIP)。我们还比较了AQP基因的数量c . rosea与其他植物基因组(表2),包括四种豆科植物(豆类[菜豆,41个基因],鹰嘴豆[Cicer Arietinum., 40],野生花生arachis duranensis.[答案]B[解析]arachis ipaensis.,36]),两种芸苔属(拟南芥[拟南芥, 35]和盐芥[Eutrema salsugineum., 35])和3种禾本科植物(水稻[奥雅萨苜蓿,33],玉米[玉米, 31]和谷子[Setaria italica39])。所有这些典型的二倍体物种中AQP基因的数量都是相似的。大豆(g·马克斯)基因组含有72个AQP基因,这可能是由于遥远过去的全基因组重复事件[34].
CRAQP蛋白的长度范围为155 AA(CRSIP1; 3)至709 AA(CRNIP4; 1),而大多数在230和320 AA之间。CRAQP的预测分子量和等电点分别从17.13kda到78.97kda和4.8至9.92(表1和3.).37个CrAQPs中有34个包含6个跨膜结构域,其余3个成员(CrNIP4、1、CrSIP1、3、CrXIP1、1)分别拥有7个、3个和5个跨膜结构域(Table .)3.).CrAQPs跨膜区域的鉴定如图S所示1.
AQP蛋白的特征
AQP蛋白的磷酸化状态是调节水等小分子运输或影响蛋白亚细胞定位的关键因素[14,22].在这项研究中,我们预测了CRAQP的可能磷酸化位点。简而言之,除Crxip1之外的所有CrAQP; 1含有所有三个磷酸化位点(Ser,Thr和Tyr;表1).我们还预测了CRAQP的亚细胞定位。使用的两个程序(Wolf_PSORT和Plant-MPLOC)具有类似的结果,并且大多数CRAQP位于血浆膜中,但有些则位于液压渣,塑性和内质网中(表1).CrAQPs的亚细胞定位表现出多种多样和广泛的模式,这表明CrAQPs在体内的划分是高度可变的,每个成员都可以调节水和/或溶质通过质膜和胞内膜系统的运输,从而行使独特的生物学功能。
NPA主题,AR / R过滤器和Froger的AQP的位置对于它们的基板选择性至关重要。在表格中表现了CRAQP和其他植物AQP之间的多次对准,并且在AR / R过滤器和Froger位置中的保守NPA基序和氨基酸的特征在于表格3.和图1.除CrPIP2;1外,其余36个CrAQPs均包含2个NPA motif,一个在B环,一个在E环,且大部分为保守型。然而,一些crqps,如CrTIP4;1和4个CrSIPs,在LB NPA基序中显示了一个可变的第三位残基,其中a残基被S/T/L取代。此外,CrXIP1;1蛋白在LB NPA基序(SPV)中有可变的第一和第三残基。在环E中,该NPA基序较为保守,只有CrNIP1;3, CrNIP3;1, CrNIP3;2, CrNIP3;3显示A被v取代3.).两个保守的NPA基序之间的间距在79 ~ 127 aa之间,大多数在108 ~ 119 aa之间(表1)3.).在AR / R选择性过滤器和Froger的位置,CRAQPS显示出比NPA图案更差异(表3.).这些变异决定了CrAQPs的底物特异性。
染色体位置和进化表征CRAQP.年代
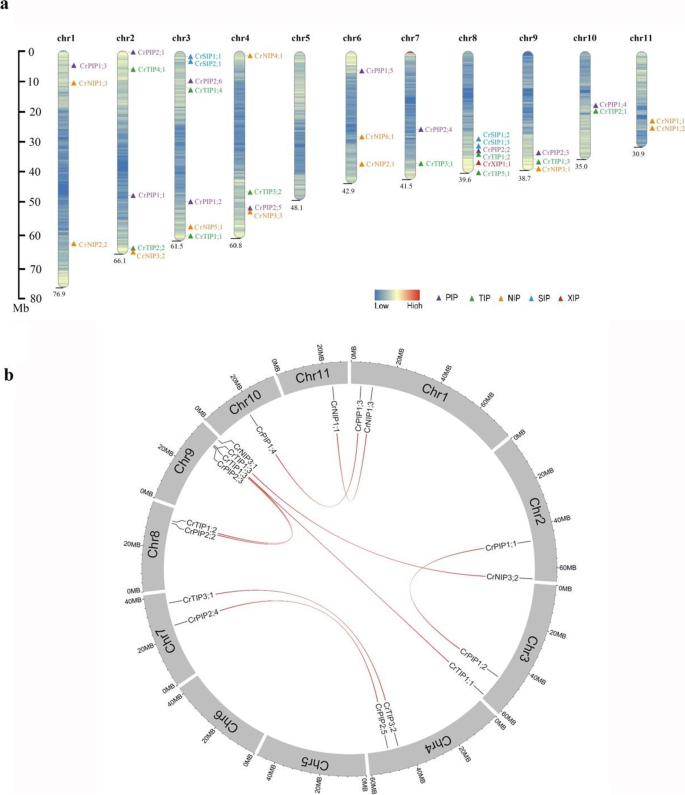
调查进化关系CRAQP.构建基因,染色体图(图。2一种)。有十一染色体c . rosea基因组和CRAQP.除5号染色体外,其余染色体上均有基因。在其他10条染色体上CRAQP.S分布不均匀。其中,3号染色体有7条染色体CRAQP.基因,染色体8具有六个,染色体2具有五个,染色体4具有四个,染色体1,6和9具有三个,染色体7,10和11具有两个。
基因复制事件CRAQP.S也调查了。总共十八和四CRAQP.发现基因分别和串联重复(表4).分段复制的分布CRAQP.in.c . rosea简单地显示了染色体。2选择压力作用于CRAQP.从非同义(Ka)替代值与同义(Ks)替代值的比值推断基因。我们的数据表明CRAQP.基因在进化压力下,平均Ka / ks比为0.1523。所有KA / KS比率远低于1(范围:0.0989-0.2738)(表4).这些结果表明CRAQP.S在复制后经历了较强的净化选择压力,功能分化有限。
基因结构和蛋白质基序组成
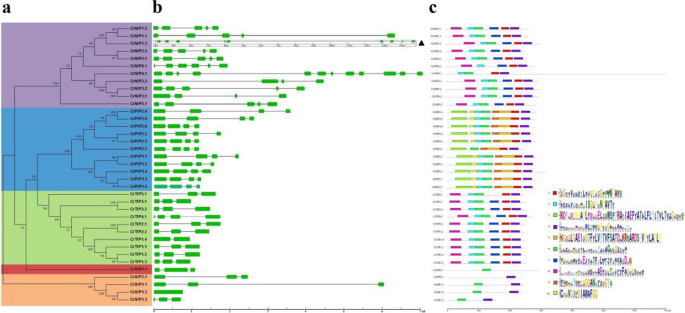
使用GSDS工具进行的基因结构分析显示,内含子/外显子的数量和长度存在较大差异CRAQP.S长度变异范围为720 ~ 14,816 bpCRAQP.亚属(图)3.内含子数量从0 (CrSIP1;2)到11 (CrNIP4;1)。大多数CrNIP年代和CrPIPS拥有三到四个内含子,最多CrTIPs有两个内含子,CrTIP4;1有三个内含子。三个四CRSIP.s中有两个内含子,除了CrSIP1;2为无内含子。唯一的CrXIP1; 1也有两个内含子。
系统发育关系,基因结构和基序组成AQP基因c . rosea.一个左侧的系统发育树是使用Mega 6.0构建的。五个主要群体标有不同的颜色背景。b外显子-内含子的组织CRAQP.s是使用GSDS 2.0(中间部分)构建的。c右侧各组的保守主题由MEME web服务器识别。不同的母题用不同的彩盒表示,母题序列见表S4
进一步调查AQP的功能c . rosea,利用MEME鉴定CrAQP蛋白的保守结构域。在已鉴定的10个基序中,基序1、2、4、6、7和8广泛分布于CrNIP和CrTIP亚家族中。大多数CrPIP成员共享保守主题1、2、3、4、5、6、9和10。4个crsipps中有3个共享保守主题4和6,CrSIP2除外;CrXIP1;1蛋白只有基序6。总体而言,每个CrAQP蛋白亚家族的基序组成相似(图1)。3.C)。
CIS.- 处理监管要素
的规定CRAQP.表达仍然是关键的中介CRAQP.功能,尤其是响应压力和植物生长和发展。这CIS.- 用于调节元件是一系列核苷酸基序,其与特定的转录因子结合,从而调节植物中的转录。在这项研究中,我们发现了推定CIS.- 所有人的启动子地区的元素CRAQP.s通过扫描在线PlantCare计划。
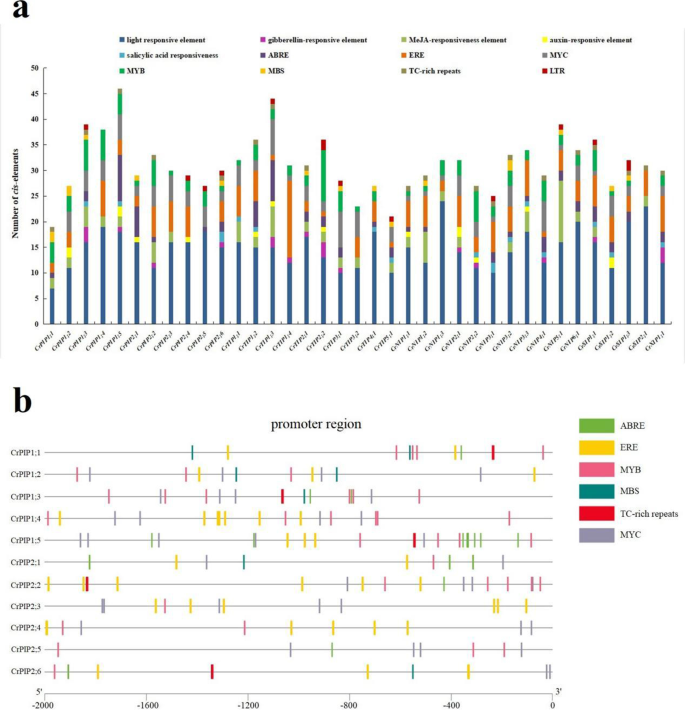
所有37的启动子分析CRAQP.S确定了68个推定CIS.-作用元件,包括25个光响应元件、4个ABA响应元件、3个赤霉素响应元件、2个meja响应元件、2个生长素响应元件、1个乙烯响应元件、22个非生物或生物胁迫相关响应元件和18个发育相关响应元件(表S3.).我们将这些元素分为12类:光响应元件、赤霉素响应元件、meja响应元件、生长素响应元件、水杨酸响应元件、ABRE-、ERE-、MYC-、MYB-、MBS-、TC-rich repeats和LTRCRAQP.启动子区域总结在图1中。4a.此外,由于pip在维持植物细胞水分平衡中起着重要的作用,本文对非生物胁迫相关的PIPs进行了综述CIS.11后的元素(包括ABRE,ERE,MYB,MBS,TC富有重复和MYC)CrPIP启动子区域(图4b)。这些元素的类别和数量表明机制调节CrPIP表达参与压力反应。然而,进一步的功能研究仍然需要确认这些功能CIS.-Acting.CRAQP.元素。
表达概况CRAQP.在不同的组织和植物生活在不同的生境
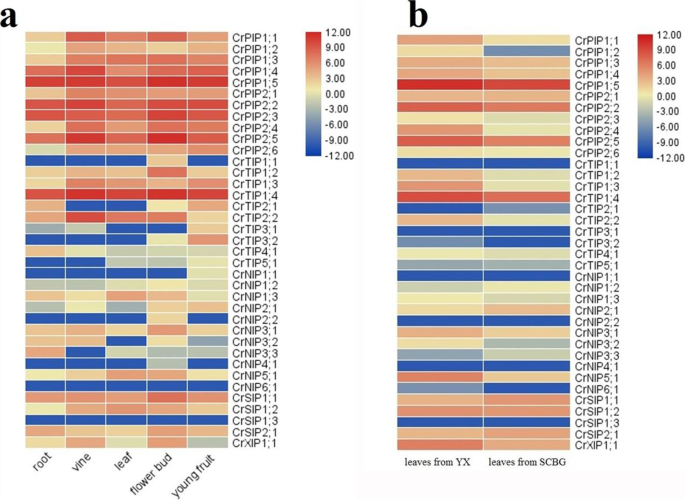
组织和栖息地表达概况CRAQP.他们的Illumina RNA-Seq数据代表7种组织类型:根、藤、幼叶、花蕾和幼果实,以及分别来自SCBG和YX岛的2个成熟叶片样本。所有的表达CRAQP.在至少一个检查的组织中检测到S,尽管转录物水平多样化。总的来说,这CrPIP成员在所有组织中表达了相对较高的表达。亚属CrPIP和CrTIP在大多数检查的组织中也产生了丰富的转录本(图。5).Young开花的芽和年轻的水果往往具有高水平CRAQP.整个家庭的表达(图。5a).我们也关注于比较CRAQP.S在成人中的表达水平c . rosea不同生境(YX Island和SCBG)的叶片均有明显的差异CRAQP.在YX样本中表达比SCBG样品更高,特别是CrPIP成员(无花果。5这些结果表明CRAQP.S可能在增长和发展中发挥不同的角色c . rosea以及这种嗜极生物的盐生植物对珊瑚礁栖息地的适应。
表达概况CrPIP对不同的应激源和ABA处理的反应
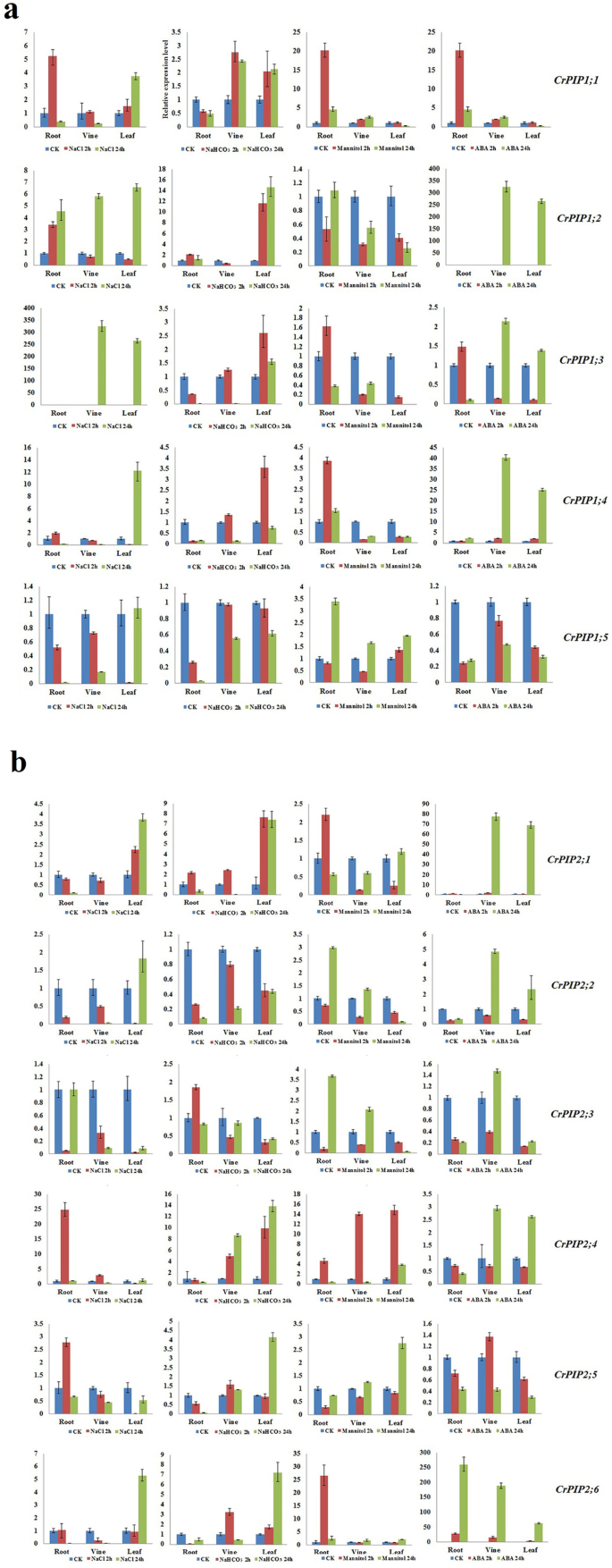
我们对不同进行了基因表达分析c . rosea用于检测表达模式的组织CrPIP各种非生物胁迫条件下的基因和ABA激素治疗。这些治疗的目的是模仿珊瑚礁和海岸尽可能多的逆境。我们进行了QRT-PCR以检测这些亚家族基因的转录水平。如图1所示。6,一切的表达CrPIPS受到压力源和激素应用的影响。我们也发现了几个CrPIP表现出相对稳定的表达模式的成员,即使在各种压力下。这些基因包括CRPIP1; 5.,CRPIP2; 2,CRPIP2; 3,CRPIP2; 5(无花果。6).将这些结果与RNA-SEQ数据相结合(图。5),显然这些基因的表达水平高于其他基因CRAQP.不同组织和栖息地的基因,表明它们可能参与维持基础和原发性稳态c . rosea增长和发展。在高盐胁迫下,CRPIP1; 2在根,藤蔓和叶子中显示所有诱导的表达模式,而CRPIP1; 1,CRPIP1; 3,CRPIP1; 4,CRPIP2; 1,CRPIP2; 6.在葡萄和叶片中表达升高,而在根中表达下调。总体上,碱性胁迫对表达的影响较小CrPIP年代的基因。CRPIP1; 2,CRPIP1; 3,CRPIP1; 4,CRPIP1; 5.,CRPIP2; 1,CRPIP2; 4,CRPIP2; 5,CRPIP2; 6.在root中下调,而CRPIP1; 1,CRPIP1; 2,CRPIP2; 4,CRPIP2; 5在空中组织中略微上调。高渗透压力增加了表达CRPIP1; 1,CRPIP2; 4,CRPIP2; 6., ABA处理增加了表达量CRPIP1; 2,CRPIP1; 4,CRPIP2; 1,CRPIP2; 6.(无花果。6).这些结果表明这些基因在多种非生物胁迫响应和ABA信号响应中起着重要作用c . rosea.
CRPIP1之间的相互作用; 5和CRPIP2; 3
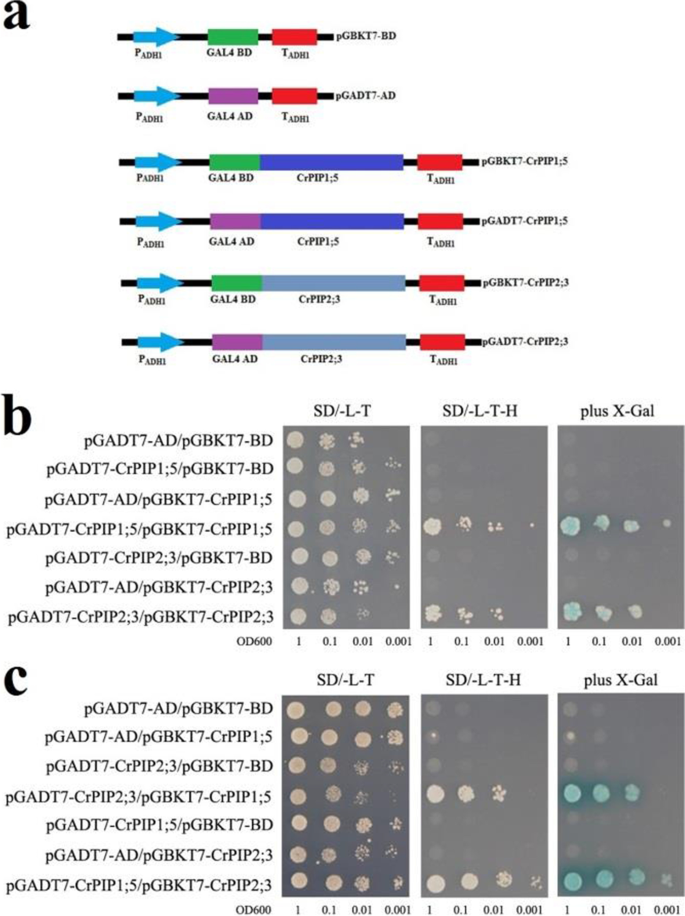
先前的研究表明,植物PIP1和PIP2构件可以在异二聚体和四聚体中缔合[35].在我们之前的研究中,我们已经确认了aC. RoseaPip2.基因,CRPIP2; 3,参与转基因植物的耐旱性[36].CRPIP1; 5.和CRPIP2; 3均最初被隔绝c . roseacDNA文库,这两个成员在不同的组织中表现出更高的表达水平c . rosea比其他CRAQP.(图。5a),这可能表明它们在体内维持水平衡的相对重要性。在这项研究中,我们分析了两个PIP构件,CRPIP1; 5和CRPIP2; 3,以确认CRAQP可以形成同源过二聚体或异二聚体。为了探索CRPIP1; 5-CRPIP2; 3相互作用,为酵母双杂合物测定法制备一系列DNA构建体(图。7a). BD和AD载体共转化酵母AH109。CrPIP1;5和CrPIP2;3都没有自我激活,但都可以通过与自己直接相互作用形成同型二聚体(图5)。7b)。此外,CRPIP1; 5和CRPIP2; 3可以彼此相互作用(图。7C)。这些结果表明,至少在酵母细胞中,这两个CRPIP构件可以与自己和彼此相互作用以形成用于水的活性孔隙和穿过膜的小分子输送。
酵母和拟南芥异常表达的非生物胁迫耐受性CRPIP1; 5.
我们执行了功能识别CRPIP1; 5.利用酵母表达系统,构建了一种CRPIP1; 5.-pyes-dest52重组载体(图。8a).如图。8b, W303用任意一个变换CRPIP1; 5.或pYES2发育正常,生长速率与SDG对照板没有差异。然而,随着PEG8000或山梨醇的加入,W303转化为CRPIP1; 5.与含pYES2的酵母相比有明显的生长滞后性。在SDG培养基中加入NaCl,含W303酵母CRPIP1; 5.与对照相比,生长效果更好。8b).我们也检查了H2O2使用酵母表达系统运输活动。CRPIP1; 5.导致H增加2O2酵母的敏感性和较低的生长速率,而BY4741菌株和H2O2- 敏感突变菌株skn7δ生长性能与SDG控制板相似。8C)。这些结果表明,至少在酵母细胞中,CRPIP1; 5是活性H.2O和H2O2运输车辆。
进一步评估的影响CRPIP1; 5.,我们生成转基因拟南芥根本表达的植物CRPIP1; 5.受35S启动器控制。利用基因组PCR、RT-PCR和qRT-PCR鉴定植株为转基因植株(图S2).来自三条纯合T3线的植物(牛1 #,牛5#,牛10#)经受盐,盐碱,高渗透性和干旱耐受性试验。虽然我们的种子发芽测定表明CRPIP1; 5牛在盐、盐碱性或高渗透胁迫下,与野生型种子相比,种子的发芽率没有显著差异(图S3.),而在幼苗生长测定中,CRPIP1; 5牛与WT对照相比,Line幼苗在盐和盐碱MS板上显示出略微生长延迟(图S4).
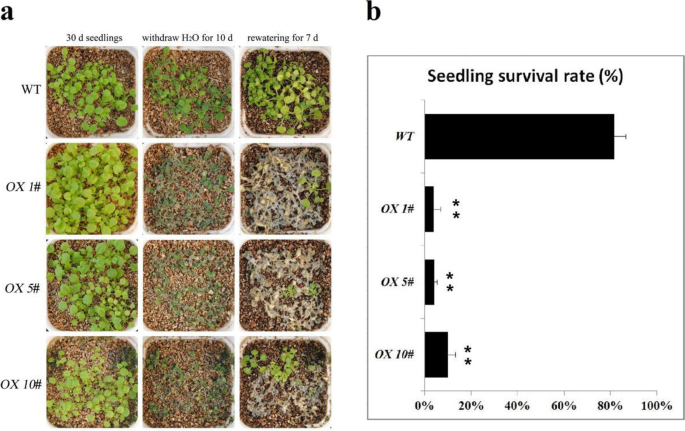
wt和wt的种子CRPIP1; 5牛在浇水条件下生长30天,并在盐,干旱和碱性应激处理之前,成年植物的生长速率(WT和三CRPIP1; 5牛线)是相对一致的。WT与转基因植株的耐受性无差异(牛1 #,牛5#,牛10#)在盐(200mM NaCl)和盐碱(100mm Nahco3.,pH 8.2)压力源(图S5).很显然,CRPIP1; 5.导致对干旱的敏感性较弱(图。9a).抽水10天后,WT和3种植物均有一定程度的枯萎CRPIP1; 5牛线条。重新浇水并在另外7天内生长,大部分CRPIP1; 5牛植物没有恢复,而大多数WT植物确实恢复并恢复了较高的生存率CRPIP1; 5牛植物(图。9b).这个结果表明过表达CRPIP1; 5.植物抗旱能力下降。
我们发现了绿色荧光蛋白- 用CRPIP1; 5.在camv35s的控制下,在转基因拟南芥植物。根尖荧光大约三至四天的转基因拟南芥通过共聚焦显微镜容易辨别幼苗;GFP-CRPIP1;在转基因植物的血浆膜中可见5蛋白,而在对照植物根中,GFP信号在整个细胞质中均匀分布(图S6).这些结果表明CRPIP1的亚细胞定位; 5在PIP1亚家族上一致,主要是局部地定位于质膜,以及部分内部膜系统。在血浆膜中,CRPIP1; 5折叠到特定的跨膜通道中并用作水转运蛋白。
讨论
受干旱,高盐度/碱性/碱性,高温,冷/冷冻条件或其他非生物胁迫源引起的水赤字引起的 - 可以对植物生长和生存产生负面影响。然而,植物已经开发了复杂的机制以应对这种类型的应力,包括通过复杂网络发出信号感知和转导和应激响应基因的差异表达的改变。水蛋白是一类整体膜蛋白,便于水和其他小溶质的扩散。与动物和微生物相比,植物经常维持大型和多样化的AQP系列。据报道,Aquaporins在不利生长条件下,植物水平衡和稳态中起重要作用[5,21]和回应特定的生物挑战[37,38].在这项研究中,我们进行了全基因组识别和表征AQPc . rosea了解这个家族的进化及其分子角色。我们特别感兴趣的是解决这种嗜极生物盐生植物对珊瑚礁栖息地的适应及其对急性盐、碱和干旱胁迫的反应的分子机制。
AQP蛋白家族c . rosea基因组特征和37个推定功能的CrAQP亚型(基于Pfam结构域序列)被鉴定,属于PIP(11个亚型),TIP(10个),NIP(11个),SIP(4个)和XIP(1个)亚家族(表)1).我们进行了全基因组测序c . rosea,我们的结果表明该物种为二倍体,基因组大小为534.94 Mbp(数据未发表)。的数量AQPs类似于其他二倍体植物物种(表2),其蛋白质序列高度相似。这表明数量AQPS和序列特异性可能不直接与适应相关c . rosea到极端的环境。这个角色CRAQP.需要从其他视角进一步研究压力耐受的游戏,例如转录调节,蛋白质修饰和AQP跨膜运输活性的调节。
虽然许多研究已经确定了模型植物物种中的AQP,但对该基因家族的研究越来越关注居住新颖环境的植物。这在很大程度上是因为AQP基因被视为用于遗传修饰作物的候选者,以增加农业生产力[39,40].的saltbushatriplex conescens是高度耐盐碱地,干旱,重金属和寒冷,和AQP基因ACPIP2.和AcNIP5; 1已被证明参与本物种中非生物应激耐受性,以及它们在转基因中的过度表达拟南芥对干旱和盐发生改变的耐受性[41,42].与栽培大豆相比,野生甘氨酸大豆相对耐盐碱性。两个AQP基因野生大豆,GsTIP2; 1和gspip2; 1,对盐和脱水胁迫的耐受性最小拟南芥,表明它们通过调节水势对胁迫耐受性有负面影响[43,44].在转基因植物中进行的大多数功能分析中,过表达AQP基因提高了对盐和干旱的耐受性Malus Zumi.(基因MzPIP2; 1)[45],Sesuvium portulacastrum(SPAQP1.)[46],Stipa purpurea(SpPIP1)[47],Simmondsia对(SCPIP1.)[48],Thellungiella salsuginea(TsPIP1; 1)[49),而凤凰dactylifera(pdpip1; 2)[50].提升了的表达AQP植物中的基因可导致水势细胞变化,导致水吸收和蒸腾的变化,并最终改变对水缺陷应激的耐受性。在这方面,了解分布,扩张,调节,系统发育多样性和进化选择AQP嗜极生物植物的基因c . rosea这是可能提高其他植物物种(包括农业作物)的水分利用能力和干旱适应能力的重要一步。
植物AQPS在对抗非生物胁迫方面发挥多功能生理作用,而不仅仅是通过调节水含量和潜力,而且还通过运输某些信号分子和营养素。通常,AQP由五个环(A-E)和细胞溶质N-和C-Termini连接的六个跨膜螺旋组成。LOOPS B(胞质溶胶)和E(非胞质溶胶)均含有高度保守的NPA(天冬酰胺 - 脯氨酸 - 丙氨酸)基序,其形成这些蛋白质的核心的一部分。芳族/精氨酸(Ar / R)收缩位于孔的非胞质末端。AQP的底物特异性与几种不同的签名序列密切相关,包括NPA图案,AR / R过滤器和Froger位置(FPS)[51].在所有CrAQP NPA基序中,除CrSIP1;3和CrXIP1;1外,前两个残基最为保守,其中环B和环E NPA基序退化为NLG.和年代PV.NPA基序的第三个残基变化更大,A经常被L、S、T或v所取代。然而,与NPA基序相比,所有CrAQPs中ar/R过滤器和Froger 's位置的10个氨基酸残基变化更大(Table .)3.).在一些亚家族中,ar/R选择性过滤序列相似,如CrPIPs (F-H-T-R)、CrTIP1s (H-I-A-V)和CrNIP1s (W-V-A-R)。我们还分析了Froger的位置(P1-P5),这五个保守的氨基酸残基与水导电性AQPs中的甘油转运有关。crpip中P2、P3、P4和P5 Froger的位置相对保守(S-A-F-W), CrTIPs中则相对保守(S-A-Y/F-W)。在CrNIPs和CrSIPs中,P3和P4位置主要停留在A和y,推测植物的TIPs可能运输各种小溶质,包括H2O2,NH.4+和尿素,除了水外[40].与其他植物尖端一样,CRTIP主要位于真空膜中,并且可以参与在细胞器的亚细胞室中的水流调节[52].CrTIPs在ar/R选择性过滤序列中的变化可能导致其具有多种转运功能,其NPA间距为79 ~ 127个氨基酸残基,表明CrTIPs可能还参与了多个小分子的跨膜转运。
基因结构组织、基因扩展和基因多样性是基因家族进化的关键指标。这CrPIP和CrTIP与其他亚壳相比,亚甲酰基因结构表现出相对稳定的基因结构(图。3.).大多数拥有三个(CrPIPs)或两个(CrTIPS)内含子,表明他们可能分享共同的祖传起源。类似于以前的报告显示很少或没有内部AQP其他植物的基因[30.,31,53,只有一个内含子AQP被确定在内c . rosea.intronless基因,CrSIP1; 2,可能是最近通过逆转录转座子过程进化而来的。这CRAQP.家族经历了许多重复事件,这与植物基因组高度重复的性质一致(图。2;表格4).还在其他植物物种中报道了本研究中鉴定的分段和串联重复的复制事件[33,34].在本研究中,一些重复CRAQP.s在不同的组织和环境、不同的应激源和激素暴露下有不同的表达模式(Figs。5和6).这些重复的基因对很可能在不同的生物过程中具有类似的蛋白质功能,可能介导转录调节或后术治疗。
Canavalia Rosea是一种耐盐、耐碱、耐旱的盐生植物,盐碱土壤、季节性干旱、强太阳辐射和高温等非生物胁迫是引起该物种和其他热带海滨植物渗透胁迫和破坏水平衡的主要限制因素。为了有效地调控不同非生物胁迫下的水分运输,植物往往通过一系列复杂的步骤改变水通道蛋白基因的表达来控制水分的吸收或管理。然而,水分管理的有效性和模式往往取决于植物的生长条件或组织类型,以及水分胁迫的不同类型或程度和AQP成员的特异性[54].在工厂,皮普同种型应该在维持植物水稳态和对非生物胁迫的反应中发挥主要作用[11,55].基因转录水平取决于启动子的结构。因此,CIS.- 启动子地区的元素可以提供了解影响信号分子和环境雄性的反应的遗传因素的关键。我们总结了非生物压力相关的CIS.表演的元素CRAQP.发起人(无花果。4),我们的发现表明CRAQP.表达式图案也可以被认为是对应力条件的适应机制的一部分。鹰嘴豆(Cicer Arietinum.L.)是一种重要的食用豆类作物,具有较好的耐旱性和耐盐碱性[31,32].的启动子分析CAAQP.S还确定了许多CIS.- 调节元素,包括防御和应力响应元素。该启动子分析也是通过实验表达分析一些选定的分析CAAQP.S,虽然与表达模式并非绝对一致CAAQP.年代(32].的表达谱CRAQP.通过RNA-Seq显示的不同组织中的s表明一些CrPIP和CrTIP亚甲酰表达水平高于其他亚壳(图。5a),而从叶片中获得的生境特异性RNA-Seq数据进一步表明CrPIP沿海地区的成员有较高的表达水平c . rosea(YX)比在内陆c . rosea(SCBG;图。5b)。在豆科植物,鹰嘴豆中也观察到类似的结果(Cicer Arietinum.l .) [32].在耐旱基因型鹰嘴豆中,两个亚家族(CaPIPs和CaTIPs)在所有组织中均表现出高表达,说明这两个亚家族是水分运输和耐旱的重要载体。qRT-PCR结果还显示,部分PIP成员在耐旱鹰嘴豆基因型中的表达量远高于耐旱鹰嘴豆基因型[32].我们的结果表明差异表达CRPIPS.可能与不同栖息地的不同用水策略相关,以及更高的表达水平CRAQP.年代在沿海c . rosea植物可能是处理细胞内外水分不足信号的一种适应机制。由于材料的限制,我们无法从YX岛采集足够完整的根组织进行RNA-seq分析,所以我们在实验室模拟胁迫,采用qRT-PCR分析基因表达。的表达模式CrPIP进一步研究了盐、碱、干旱胁迫和ABA激素处理下的ABA含量。6).结果表明CrPIP盐碱、高渗透胁迫和ABA处理对表达的影响最大。此外,一些CRPIPS.在根,葡萄藤和叶子中表现出明显不同甚至相反的表达模式。这可能归因于根源中,皮蛋白主要促进外部环境的吸水,而在葡萄藤和叶子中,频率可能在蒸腾中发挥更大的作用。广泛地,我们的结果表明了一个角色皮普s在规范中c . rosea水力学,可能是为了适应热带珊瑚礁和岛屿上的恶劣环境条件。
在我们之前的研究中,我们已经描述了CRPIP2; 3作为盐/干旱胁迫相关基因[36].在这里,我们使用酵母双杂合物测定进行蛋白质 - 蛋白质相互作用研究,发现两个CRPIP构件,由其编码CRPIP1; 5.和CRPIP2; 3在非生物胁迫挑战和ABA处理下,几乎构成性表达(Figs。5A和6).这两个CrPIP成员可以相互结合,形成同型二聚体和异型二聚体。7).这与之前的研究结果一致,即一些PIP1和PIP2成员可以组装成异四聚体和异四聚体,从而触发通道活性,影响底物特异性,调节PIP贩运[56].在这里,我们的结果表达模式CRPIP1; 5.和CRPIP2; 3详细了解其监管模式并帮助亮起CRAQP.功能。这些数据特别有助于表征aqp相互作用的蛋白复合物参与c . rosea对恶劣环境条件的适应,如低水分可利用性和盐碱土壤。
我们来自酵母过度表达系统的结果表明CRPIP1; 5是活跃的跨膜H.2O和H2O2转运体(无花果。8).我们评估了过表达CRPIP1; 5.在转基因中拟南芥,CRPIP1; 5.导致盐水碱性和干旱耐受性略微降低,这表明了与之相反的表型CRPIP2; 3的超表达在拟南芥[36].这也表明CRPIP1; 5.可以在水运中发挥关键作用。我们推测,作为外源AQP基因,CRPIP1; 5.可能参与修改拟南芥内源性点的功能,或者在经转基因中的吸水率流出的水中更多拟南芥从而导致对盐和干旱胁迫的敏感性。我们还发现,高水平的盐,碱性和ABA略有降低表达CRPIP1; 5.在c . rosea这进一步表明该基因对于细胞和组织之间的水运动非常重要,并且确实涉及应力反应途径,该途径保护酵母细胞或植物在高盐度条件下的水分损失,并在高渗透压力或干旱下促进水释放(图。8b和9).过度的CRPIP1; 5.在转基因中拟南芥与大多数以前的研究结果相反[40,54]的研究表明,植物PIPs的过表达导致了植物非生物胁迫耐受或敏感性的特异性,这也可能与外源AQP的蛋白相互作用、翻译后修饰(post-translational修饰,PTM)、蛋白转运有关。而在c . rosea的表达式模式CRPIP1; 5.关于不同的组织或栖息地(图。5),以及对盐/碱胁迫、高渗透胁迫和ABA处理的转录变化(图。6一)表示CRPIP1; 5.在某种程度上,这可以归结为基本的水稳态的“管家基因”。即使是CRPIP1; 5.YX样品的表达量高于SCBG样品(叶片)(图5)。5B),这可能是由于长期适应机制c . roseaYX岛上的植物面临的水分亏缺逆境比SCBG中的植物要严重得多,包括外部环境的水分吸收和体内的水分运输。表达量略有下降CRPIP1; 5.在c . rosea由应力因子或ABA引起的幼苗(图。6A),这可能是一种紧急保护措施,以减轻水干扰造成的损害,因为我们只检查了CRPIP1; 5.表达在不同因素挑战24小时内发生变化。许多研究还证明了植物点的过度表达可以提高对干旱胁迫的敏感性。例如,烟草PIP1构件NTAQP1导致根液压导电性的下降并降低植物阻力降低到水分胁迫[57].转基因烟草(烟草)植物过表达AtPIP1; 4和ATPIP2; 5在脱水应力下显示出快速的水分,并在干旱胁迫下显示出增强的水流[58].这甘氨酸大豆基因gspip2; 1过表达的转基因通过调节水势对盐和干旱胁迫的耐受性产生负面影响拟南芥[44].此外,拟南芥植物过表达ACPIP2.(来自Saltbush的PIP基因答:canescens)表现出干旱敏感表现型[41].这可以通过应力的性质和强度来解释,并结合过表达的外源AQPs和内生AQPs之间的协同作用。外源水通道蛋白的过表达可能会影响内源水通道蛋白的表达模式和分布,从而导致不同植物的胁迫响应效应不同。在我们的研究中,过度表达CRPIP1; 5.在酵母和拟南芥中均表现出一定的敏感性CRPIP1; 5.确实参与了体内水分胁迫反应。结合我们之前的相关研究CRPIP2; 3[36]的研究表明,这两个PIP基因在转基因拟南芥中过表达可以通过维持水分稳态,减少水分亏缺胁迫对植物的伤害,从而促进植物对非生物胁迫的响应。总之,作为一种活跃的水通道蛋白,在c . rosea不同的组织或不同因素的挑战CRPIP1; 5.,以及CRPIP2; 3,可能是水稳态发展的基本支撑物c . rosea植物。
结论
豆科氮固定厂,c . rosea,呈现出极端的盐水和干旱抗性,用作人工植被建设的岛屿和珊瑚礁上的先驱物种。在本研究中,我们进行了基因组的分析和表征AQPin.c . rosea.我们的结果有助于了解该基因家族在适应压力的非生物条件时,特别是通过其对水平衡的影响。我们确定了CRAQP.家庭由37名成员组成,分布在五个亚属中。每个成员对基因和蛋白质结构的微妙变化,转录调节,亚细胞定位,底物特异性和翻译后调节机制。表达剖析CRAQP.结果显示,几乎所有组织中pip相关基因均有较高的表达c . rosea这表明该亚科可能在植物的发育过程和非生物胁迫反应中发挥重要作用。如预测的那样,PIP1和PIP2两个成员CrPIP1;5和CrPIP2;3通过蛋白质相互作用形成同二聚体和异二聚体。我们还功能性地确定了其中一个CRPIP1成员,CRPIP1; 5.,鉴于其在不同组织中的最高表达水平c . rosea.虽然我们的结果表明过表达CRPIP1; 5.可以将酵母和植物中的盐水和干旱状况提高敏感性,结合了高且不稳定的表达CRPIP1; 5.在c . rosea,可以推断CRPIP1; 5.是体内促进水转运的基础和重要功能基因之一,可能参与了c . rosea对热带珊瑚礁的生态适应。本研究中CrAQPs的鉴定将有助于进一步研究其作用AQPS在不同的发育阶段和生理过程中发挥作用c . rosea,阐明了可能的生态适应机制c . rosea对极端环境,并识别潜在的导入转基因作物的候选基因。
方法
植物材料
Canavalia Rosea植物在永兴岛(YX,16˚83'93')和112˚34'00''e)和南中国植物园(SCBG,23˚18'76''n,113˚37'02在这项研究中使用了'e)。这c . rosea自2012年起,在海南省沿海地区逐步引进SCBG,在中国广州稳定生长1 ~ 7年,并定期提供水肥。分析组织特异性转录模式的鉴定CRAQPS.,根,茎,叶,花和水果收集c . rosea在scbg种植的植物。此外,调查该参与CRAQPS.为了适应不同的生境,采集了成年叶片c . rosea植物生长在YX和SCBG。简而言之,c . rosea在户外收集组织并立即在液氮中冷冻,然后将样品储存在-80℃以进行后续RNA-SEQ分析。使用了三种独立的生物重复。
鉴定CRAQP.crqp家族的基因和基因复制分析
识别所有假定的CRAQP.基因,基因组数据库c . rosea(数据未发表)获取DNA和蛋白质序列(表S1).简而言之,钻石[59]和Internoscan(https://www.ebi.ac.uk/InterPro/Search/Sequence/)用来识别所有c . rosea蛋白质与保守域和图案(E <1E−5),所有蛋白用InterPro和Pfam数据库(http://pfam.xfam.org/).利用Pfam ID (MIP, PF00230)搜索CrAQP蛋白家族,确定推定的CrAQP蛋白序列并提交给SMART (http://smart.embl-heidelberg.de/)和NCBI保守的域数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)以确认AQP域的存在。接下来,选择CRAQPS.是根据它们与已知AQPs和c . rosea基因组注释。
使用MCScanX软件(http://chibba.pgml.uga.edu/mcscan2/),并根据基因位点手工检测串联重复。每个同义站点的同义替换数(Ka)、每个非同义站点的非同义替换数(Ks)以及Fisher精确中性检验的p值均使用1000个bootstrap重复的Nei-Gojobori模型计算[60].Ka / Ks比<1表示纯化选择,Ka / ks比率= 1表示中性选择,Ka / ks比例> 1表示正选择。
CRAQP家族蛋白的多序列对准与系统发育分析
通过对所鉴定的AQPs进行多序列比对,构建了bootstrap neighbor joining系统发育树c . rosea使用Mega 6.0具有1,000个引导的rabidopsis和大豆的AQP。GMAQPS的序列(来自大豆;甘氨酸最大)和AtAQPs(来自拟南芥;拟南芥)从植物群落数据库(https://phytozome-next.jgi.doe.gov/).水蛋白是映射的c . rosea根据位置信息的染色体CRAQP.基因的c . rosea基因组数据库并使用MapInspect软件显示(http://mapinspect.apponic.com/).
每个基因的结构CRAQP.使用基因结构显示服务器2.0(http://gsds.cbi.pku.edu.cn/).为了鉴定所有CrAQPs的生化特征,ProtParam (http://web.expasy.org/protparam/用来预测分子量(MW)和等电点(PI)来预测候选人CrAQP蛋白质。跨膜结构域(TMDs)、NPA基序和其他保守氨基酸残基通过CrAQPs与AtAQPs的序列比对得到识别[26]及GmAQPs [34].使用Netphos 3.1预测CRAQP中的磷酸化位点的数量(http://www.cbs.dtu.dk/services/NetPhos/).使用WOLF PSORT服务器预测亚细胞定位(https://wolfpeort.hgc.jp/)和植物-MPLOC(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/).保守的CrAQP基序使用MEME套件(http://meme-suite.org/),最大数量的基色数为10,图案的最佳宽度为11至50。
启动子序列分析CRAQP.年代
推定CRAQP.从中检索启动子序列(ATG上游的2,000bp)c . rosea基因组数据库(表S1).然后将序列上传到PlantCare数据库中(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)CIS-代理调节元素分析。这CIS.-作用元件分为激素特异性元件(赤霉素响应元件、meja响应元件、生长素响应元件、水杨酸响应元件、EREs和ABREs)和非生物胁迫响应元件(光响应元件、MYCs、myb、MBSs、TC-rich repeats和LTREs)。总结了不同的元素,并选择了几种CrPIP使用TBtools对发起人进行可视化[61].
表达分析CRAQP.年代
转录组数据库c . rosea是使用Illumina Hiseq X测序技术构建的。从七种不同的组织中创建的RNA-SEQ数据集的质量(根,藤蔓,幼叶,花和幼种c . rosea在SCBG增长;成熟的叶子从c . rosea在SCBG和YX岛上生长),用FastQC (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/),产生了40gb的干净读取。简而言之,五个不同的组织样本收集自相似的年轻c . rosea然后将这些样本清理干净,用液氮快速冷冻,用于器官特异性RNA-Seq分析。在栖息地特异性RNA-Seq分析中,成熟叶片分别从c . rosea然后将成熟叶片样本用液氮冷冻,以备将来使用。每组设3个独立重复。清除读取被映射到c . rosea参考基因组使用TOPHAT v.2.0.10(http://tophat.cbcb.umd.edu/).根据基因的长度和映射到基因上的读计数,基因表达水平计算为每千碱基转录本的片段每百万reads (FPKM): FPKM =总外显子片段/[映射读数(百万)×外显子长度(kb)]。的表达水平(log2)CRAQPS.使用TBTOOLS可视化为聚类热量。
探讨CRAQP基因在脱落酸(ABA)和各种应激反应中的参与,c . rosea从种子和30天幼苗中萌发出来的压力源。简而言之,对于高渗透胁迫处理,从它们的盆中除去幼苗并用蒸馏水小心地洗涤,从根部中除去土壤,然后转移到300mM甘露醇溶液中。对于高盐胁迫,将幼苗浸泡在600mM NaCl溶液中。对于碱性应激,幼苗浸泡在150mm NaHCO中3.(pH8.2)解决方案。对于ABA治疗,在幼苗的叶片上喷洒100μm外源ABA的新制备的工作溶液。在先前描述的应力处理期间,在0,2和24小时中收集来自幼苗尖端的第二和/或第三成熟叶,用作控制的0-小时点。将所有样品在液氮中冷冻并储存在-80℃下,以进行后续基因表达分析。使用了三种独立的生物重复。几个成绩单的丰富CRAQP.用qRT-PCR检测s的转录本。RNA的提取、分离和第一链cdna的合成如前文报道[36],每组3个重复。总RNA提取c . rosea胁迫/ABA处理下幼苗组织转录反转录为cDNA。采用LightCycler480体系(Roche, Basel, Switzerland)和TransStart Tip Green qPCR SuperMix (TransGen Biotech,北京,中国)进行定量RT-PCR。所有通过qRT-PCR获得的基因表达数据均归一化为CrEF-α的表达(表S2).qRT-PCR所用引物(内参基因的CrEF-αRTF/CrEF-αRTR和其他craqp特异性引物)列于表S2.
检测CRPIP1; 5.和CRPIP2; 3同源二聚体和异二聚体使用酵母双杂交试验
的全长cdnaCRPIP1; 5.(GenBank登录号MT787665)和CRPIP2; 3(GenBank登录号MT787666)c . rosea利用Gateway®技术(Life Technologies)将所有cdna插入酵母表达载体(pYES-DEST52)。重组质粒含有CRPIP1; 5.和CRPIP2; 3CDNA被指定为CRPIP1; 5- PYES-DEST52和CRPIP2; 3-PYES-DEST52,并用作以下PCR测定中的模板DNA。开放阅读框(ORF)区域CRPIP1; 5.和CRPIP2; 3分别用引物PIP1-5BDF/PIP1-5BDR和PIP2-3BDF/PIP2-3BDR进行pcr扩增(表S2),然后使用InFusion®技术(In-Fusion HD®Cloning System, Clontech)插入pGBKT7载体,构建pGBKT7- crpip1;5和pGBKT7- crpip2;3个诱饵质粒。克隆pGADT7-CrPIP1;5、pGADT7-CrPIP2;3CRPIP1; 5.和CRPIP2; 3放大后ORFS进入PGADT7载体(使用引物PIP1-5ADF / PIP1-5ADR,PIP2-3ADF / PIP2-3ADR如上所述;表S2).将构建的包含活化域(AD)和结合域(BD)的载体对ah109感受态酵母细胞进行共转化,并将转化子分别在SD/-Leu-Trp和SD/-Leu-Trp- his培养基上进行蛋白互作测试。在SD/-Leu-Trp-His培养基上添加40µg/mL 5-溴-4-氯-3-吲哚基-α-d-半乳糖苷(X-α-Gal,每点2µL),以进一步确定不同共转化子的相互作用。每个实验独立重复三次。
体内应激耐受性试验CRPIP1; 5.酵母中的过度表达
重组质粒crpip1; 5-pyes-dest52和空向量pyes2(阴性对照)转化为酿酒酵母野生型菌株W303 (MATa;他3-11_15;Leu2-3_112;URA3-1;TRP1Δ2;ADE2-1;CAN1-100),wt(by47471; mata;his3Δ1;leu2Δ0;met15Δ0;ura3Δ0)和h2O2敏感突变体skn7δ(by4741; mata;ura3Δ0;leu2Δ0;his3Δ1;met15Δ0;YHR206w: kanMX4).酵母菌W303由Zhou等提供[62].WT (Y00000)和skn7δ(Y02900)株来源于Euroscarf (http://www.euroscarf.de/index.php?name=news.).质粒引入酵母菌株使用标准聚乙二醇(PEG)-锂醋酸酯基转化协议。NaCl、PEG、山梨醇和H2O2如前所述进行耐受性[63].
功能识别CRPIP1; 5.在转基因拟南芥中
编码序列(CDS)CRPIP1; 5.采用引物PIP1-5OXGF/PIP1-5OXGR对cDNA进行pcr扩增(表S2),插入植物表达载体pEGAD中生成CRPIP1; 5.-Pegad。因此,转基因拟南芥植物(col-0基因型,3个过表达系,牛1 #,牛5#,牛10#)生成。在用基因组PCR和定量RT-PCR确认后,根据其种子萌发率以及幼苗和成人植物生长速率来测试这些T3纯合转基因素的应力耐受性。因此,这些测试意味着评估生物学功能CRPIP1; 5..
简而言之,种子萌发率的CRPIP1; 5.转基因拟南芥(牛1 #,牛5#,牛10#在以下应激处理下测量和wt):NaCl(175mm,200mm和225 mm;盐胁迫);5 mmol / l Nahco3.加上95 mmol / L NaCl(pH8.2),7.5 mmol / L nahco3.加92.5 mmol / l NaCl(pH8.2)和10 mmol / L nahco3.加90 mmol/L NaCl (pH 8.2;碱性压力);甘露醇(200mm、300mm和400mm)应力。这些治疗的目的是检测过表达的影响CRPIP1; 5.影响转基因的盐/碱性/渗透性耐受性拟南芥萌发期间的种子。另外,计算根长度以评估过表达的影响CRPIP1; 5.在转基因上拟南芥非生物胁迫(100mm、150mm和200mm NaCl)对幼苗进行盐胁迫;0.5 L NaHCO更易3.加上99.5 mmol/L NaCl, 0.75 mmol/L NaHCO3.加99.25 mmol / l NaCl,1 mmol / l Nahco3.加99 mmol / L NaCl,pH 8.2用于碱性应力;200毫米,300毫米和400毫米甘露醇用于渗透胁迫。野生型拟南芥以Murashige&Skoog培养基(MS)或MS + 100 mM NaCl (pH 8.2)培养基作为对照。种子萌发和幼苗生长实验均在有或没有胁迫因子的MS板上进行,在相同的温室环境下进行拟南芥植物。对转基因成虫也进行了干旱和盐/碱耐受性试验拟南芥植物。WT和转基因种子(牛1 #,牛5#,牛10#)在MS培养基上培养。将10日龄的幼苗移植到装满营养液浸泡蛭石的方形花盆中,土壤水分相同。对于耐旱试验,每种30 ~ 40株牛如上所述,在生长室中培养线和WT对照再浇水再浇水20天,因为原始蛭石湿度可以确保拟南芥植物的正常生长。在该时间帧上降低了罐中蛭石的水含量,但没有诱导干旱胁迫。然后通过连续取出水对植物进行干旱耐受测定,由此WT和转基因植物(牛1 #,牛5#,牛10#)变成连续干旱10天,然后充分补水,恢复7天。实验结束时,根据活植物数量计算成活率。在耐盐性试验中,转基因拟南芥(牛1 #,牛5#,牛10#)用200mM NaCl溶液(每个罐50mL)灌溉在方形盆中生长,并且在7天后记录表型。对于碱性耐受测定,用100mm NaHCO灌溉相同的幼苗3.每盆50 mL, 4天后记录表型。
CrPIP1的亚细胞定位拟南芥用GFP融合蛋白在幼苗根中检测。这牛CRPIP1; 5-PEGAD和对照(PEGAD)转基因植物被灭菌并在MS板中发现,以产生幼苗。然后,使用装配到共聚焦激光扫描显微镜的摄像机检测三到四天的幼苗,以记录不同组织的GFP荧光。为了确认是荧光的细胞膜,通过使用碘化钛溶液(磷酸盐缓冲溶液中1mg / ml)染色幼苗根。
统计分析
本研究中的所有实验单独重复三次,结果显示为平均值±SD(n≥3)。使用学生分析手段之间的成对差异t- Microsoft Excel 2010中的最低。
可用性数据和材料
本研究期间生成或分析的所有数据都包含在本文中及其补充信息文件中。但是,本研究中的序列数据也可以访问http://doi.org/10.13140/RG.2.2.21213.74727.
缩写
- AQP:
-
水通道蛋白
- RNA-Seq:
-
RNA序列
- PIP:
-
血浆膜内在蛋白质
- 掐:
-
NOD26样内在蛋白质
- 提示:
-
Tonoplast内在蛋白质
- SIP:
-
小和基本的内在蛋白质
- XIP:
-
X-intrinsic蛋白质
- GIP:
-
GlpF-like内在蛋白
- 臀部:
-
杂种内在蛋白质
- MIP:
-
主要内在蛋白质
- NPA:
-
芦笋 - 脯氨酸 - 丙氨酸
- AR / R:
-
芳香族/精氨酸区域
- FPS:
-
弗吉尔的职位
- 德牧:
-
基因结构显示服务器
- 阿坝:
-
脱盐酸
- 西班牙:
-
合成辍学培养基加半乳糖
- QRT-PCR:
-
定量逆转录聚合酶链反应
- 牛:
-
过表达
- WT:
-
野生型
- 肉汁:
-
总平均的亲水性
- 女士:
-
Murashige和Skoog medium
- CK:
-
控制检查
- SCBG:
-
华南植物园
- YX:
-
永兴岛
- MW:
-
分子量
- pI:
-
等电点
- 战区导弹防御系统:
-
跨膜域
- FPKM:
-
每千碱基中的片段每百万次读取
- 广告:
-
激活域
- 双相障碍:
-
绑定域名
- cd:
-
编码序列
参考
- 1.
苏普丽亚。电子束辐照对海岸带沙丘野生豆科植物种子生物活性原理的影响CanavaliaSpp)。2019;10(1): 57-61。
- 2.
黄杰,刘恩,任立,剑SG。生理学和生物化学特征Canavalia Rosea在压力之下。机器人学报。2019;27(02):157-63。
- 3.
对PE, Agarwal M, katiya -Agarwal S, Zhu J, Zhu JK。对影响植物水分状况的抗旱、盐、冻和非生物胁迫进行量化的方法和概念。植物j . 2006; 45:523-39。
- 4.
Munns R,Tester M.盐度耐受机制。Annu Rev植物Biol。2008; 59:651-81。
- 5.
Kaldenhoff R,Ribas-Carbo M,Sans JF,Lovisolo C,Heckwolf M,Uehlein N. Aquaporins和植物水平衡。植物细胞环境。2008; 31(5):658-66。
- 6.
Preston GM, Carroll TP, Guggino WB, Agre P.水道外观非洲爪蟾蜍表达红细胞芯片28蛋白的卵母细胞。科学。1992年; 256(5055):385-7。
- 7.
Johanson U,Gustavsson S.植物中主要内在蛋白质的新亚家族。mol Biol Evol。2002; 19(4):456-61。
- 8.
Lopez D、Bronner G、Brunel N、Auguin D、Bourgerie S、Brignolas F、Carpin S、Tournaire-Roux C、Maurel C、Fumanal B、Martin F、Sakr S、Label P、Julien JL、gouset - dupont A、Venisse JS。杨树XIP水通道蛋白:进化扩展、蛋白质功能和环境调节。实验机器人,2012;63(5):2217-30。
- 9.
安德伯格嗨,kjellbom p,约翰逊U.批注卷柏moellendorffii陆生植物的主要内在蛋白质及其蛋白质家族的进化。植物科学,2012;
- 10.
Gustavsson S ., Lebrun AS ., Kristina N ., Francois C ., Johanson U.Physcomitrella patens.最类似于细菌甘油通道。植物理性。2005; 139(1):287-95。
- 11.
Maurel C,Boursiac Y,Luu Dt,Santoni V,Shahzad Z,Verdoucq L.植物中的水素蛋白。Physiol Rev. 2015; 95(4):1321-58。
- 12.
关键词:水通道蛋白,水通道蛋白,水通道蛋白,水通道蛋白,水通道蛋白自然。2000;407(6804):599 - 605。
- 13.
Chaumont F, Moshelion M, Daniels MJ。植物水通道蛋白活性的调控。细胞杂志。2005;97(10):749 - 64。
- 14.
Fox Ar,Maistriaux LC,Chaumont F.了解大量植物水蛋白同种型和多种调节机制。植物SCI。2017; 264:179-87。
- 15.
水通道蛋白1 (aquaporin-1)和GlpF的机制和动态。科学。2001;294(5550):2353 - 7。
- 16.
Cooper GJ,Occhipinti R,Boron Wf。串扰提案:生理有限公司2交换可以取决于膜通道。j physiol。2015; 593(23):5025-8。
- 17.
王Y,Tajkhorshid E.脑Aquaporin AQP4的一氧化氮传导。蛋白质。2010; 78(3):661-70。
- 18.
摘要/ abstract Siefritz F, Otto B, van der Krol A, Kaldenhoff R. .质膜水通道蛋白NtAQP1是烟草叶片展开机制的重要组成部分。植物j . 2004; 37(2): 147 - 55。
- 19.
植物过氧化氢代谢及其功能研究。新植醇。2019;221(3):1197 - 214。
- 20。
Poschenrieder C,BusomS,BarcelóJ。植物如何处理三价(+ 3)元素。国际分子物理学报,2019;
- 21。
Srivastava AK,Penna S,Nguyen DV,Tran LS。Aquaporins作为植物反应中的分子导管的多方刻录作用。Crit Rev Biotechnol。2016; 36(3):389-98。
- 22。
Verdoucq L, Rodrigues O, Martinière A, Luu DT, Maurel C. C.植物水通道蛋白的可逆磷酸化,横向运动和循环。植物生物学杂志,2014,22:101 - 7。
- 23。
酵母水通道:传统水通道蛋白的概述。细胞杂志。2010;103(1):35至54岁。要高许多
- 24。
水通道蛋白:重要但难以捉摸的药物靶点。药物研究进展。2014;13(4):259-77。
- 25。
Sutka M,Amodeo G,Ozu M.植物和动物Aquaporins Crosstalk:可以从不同的角度揭示什么。Biophys Rev. 2017; 9(5):545-62。
- 26。
Johanson U, Karlsson M, Johansson I, Gustavsson S, Sjövall S, Fraysse L, Weig AR, Kjellbom P.拟南芥中主要内在蛋白的完整编码基因为植物主要内在蛋白的命名提供了一个新的框架。植物杂志。2001;126(4):1358 - 69。
- 27.
Chaumont F,Barrieu F,Wojcik E,Chrispeels MJ,Jung R. Aquaporins在玉米中构成了一个大而高度分歧的蛋白质家庭。植物理性。2001; 125(3):1206-15。
- 28.
Nguyen MX, Moon S, Jung KH。水稻水通道蛋白基因全基因组表达分析及根中水通道蛋白表达介导的功能基因网络的构建。足底。2013;238(4):669 - 81。
- 29.
秦S,刘y,韩y,xu g,wan s,cui f,李g。水蛋白及其在盐胁迫条件下的根水运输中的作用Eutrema salsugineum..植物SCI。2019; 287:110-99。
- 30.
盐芥水通道蛋白的全基因组特性及表达分析(英文)Eutrema salsugineum.).peerj。2019; 7:E7664。
- 31.
鹰嘴豆水通道蛋白基因家族的全基因组分析Cicer Arietinum.L.)。前植物SCI。2016; 7:1802。
- 32.
Hussain A,Tanveer R,Mustafa G,Farooq M,Amin I,Mansoor S.对比水素的对比系统介绍,对植物的基因家族扩张和演变提供了洞察力及其在抗旱和易感鹰嘴豆品种中的作用。基因组学。2020; 112(1):263-75。
- 33.
邹泽,杨杰。基因组宽的比较揭示了近期全基因组重复后的木薯和橡胶水疗法家族的分歧。BMC基因组学。2019; 20(1):380。
- 34.
冯ZJ,刘,张GW,NIU FG,XU SC,龚YM。大豆中AQP家族的调查及启动子活动TIP2; 6在热应激和激素响应中。int j mol sci。2019; 20(2):262。
- 35.
Bienert MD,Diehn Ta,Richet N,Chaumont F,Bienert GP。植物PIP1和PIP2 Aquaporins的异质化是一种进化的古代特征,用于引导PIP1等离子体膜定位和功能。前植物SCI。2018; 9:382。
- 36.
郑杰,林R,PU L,王Z,梅Q,张米,剑氏症的异位表达CRPIP2; 3,一种来自盐生植物的质膜内在蛋白基因Canavalia Rosea,增强拟南芥对干旱和盐碱胁迫的耐受性。中国生物医学工程学报,2014;
- 37.
关键词:水通道蛋白,植物,微生物,相互作用,水通道蛋白细胞。2018;7(12):267。
- 38.
张L,陈L,董H.植物Aquaporins感染和免疫因病原体 - 一个批判性审查。前植物SCI。2019; 10:632。
- 39.
Martinez-Ballesta MDEL C,Carvajal M.植物水素生物技术的新挑战。植物SCI。2014; 217-18:71-7。
- 40。
关键词:水通道蛋白,水通道蛋白,植物abstract: water - pore in, water - pore in植物生理学与生物化学。
- 41。
李军,于刚,孙旭,刘勇,刘军,张旭,贾超,潘浩。ACPIP2.,来自烟道的血浆膜内在蛋白质atriplex conescens,提高植物的生长速度和非生物胁迫耐受性拟南芥.植物细胞代表2015; 34(8):1401-15。
- 42。
yu g,李杰,太阳xh,张xh,liu jl,pan hy。过度表达AcNIP5; 1,来自烟道的新型结核蛋白样内在蛋白质atriplex conescens提高拟南芥对盐的敏感性,提高其耐旱性。Plant Mol Biol Rep. 2015; 33:1864-75。
- 43。
王X,李义,吉,白x,蔡h,朱·,孙XL,陈LJ,朱ym。一本小说甘氨酸大豆拟南芥液泡内生性蛋白基因响应非生物胁迫,抑制盐和脱水耐性。植物生理学杂志。2011;
- 44。
王旭,蔡红,李勇,朱勇,纪伟,白旭,朱东,孙旭。小说异位过表达的研究。北京:科学出版社甘氨酸大豆应激诱导的血浆膜内在蛋白质增加了转基因拟南芥植物中的盐和脱水的敏感性。j植物res。2015; 128(1):103-13。
- 45。
1:一种参与径向水分运动的水通道蛋白(aquaporin),改变了转基因植物的耐干旱和耐盐性拟南芥.《公共科学图书馆•综合》。2015;10 (11):e0142446。
- 46。
关键词:水通道蛋白基因,盐生植物,水通道蛋白Sesuvium portulacastrum,SPAQP1.,增加转基因烟草的耐盐性。植物细胞代表2016;35(2):385-95。
- 47。
关键词:水通道蛋白,质膜,分子克隆,水通道蛋白Stipa purpurea并探索其在干旱胁迫耐受性中的作用。基因。2018; 665:41-8。
- 48。
王旭,高峰,冰晶,孙伟,冯旭,马旭,周勇,张广发。在转基因拟南芥中,过表达荷荷巴水通道蛋白ScPIP1可以增强其抗旱性和耐盐性。国际分子物理学报,2019;
- 49。
李文,强x,汉x,姜l,张某,韩伙,他r,cheng x.异位表达aThellungiella salsuginea水通道蛋白基因,TsPIP1; 1,提高了水稻的耐盐性。国际分子科学杂志。2018;19(8):2229。
- 50.
Patankar HV,Alharrasi I,Alyahyai R,Yaish MW。枣棕榈泡蛋白基因的功能表征pdpip1; 2使酵母和拟南芥具有耐干旱和耐盐碱的能力。基因。2019;10(5):390。
- 51.
关键词:水通道蛋白,门控,门控机制,植物abstract: Törnroth-Horsefield大自然。2006;439:688 - 94。
- 52.
胡w,hou x,黄c,yan y,tie w,ding z,wei y,liu j,miao h,lu z,li m,xu b,金z.Acaporin基因家族的基因组型鉴定和表达分析在香蕉的开发和非生物压力期间。int j mol sci。2015; 16(8):19728-51。
- 53.
Kumar N, Kumawat S, Khatri P, Singla P, Tandon G, Bhatt V, Shinde S, Patil GB, Sonah H, Deshmukh R.理解水通道蛋白运输系统在高抗逆性药用植物中的作用Ziziphus jujuba磨。)。j biotechnol。2020; 324:103-11。
- 54.
Kapilan R, Vaziri M, Zwiazek JJ。胁迫下植物水通道蛋白的调控。生物研究2018;51(1):4。
- 55.
Yaneff A, Vitali V, Amodeo G. PIP1水通道:内在的水通道还是PIP2水通道调节剂?2月。2015;589(23):3508 - 15所示。
- 56.
Roche JV,Törnroth-Horsefield S. Aquaporin蛋白 - 蛋白质相互作用。int j mol sci。2017; 18(11):2255。
- 57.
Aharon R,Shahak Y,Wininger S,Bendov R,Kapulnik Y,Galili G.转基因烟草中的血浆膜Aquaporin的过度表达在良好的生长条件下改善了植物活力,但在干旱或盐胁迫下没有。植物细胞。2003; 15(2):439-47。
- 58.
关键词:水通道蛋白,转基因拟南芥,非生物胁迫,水通道蛋白植物生物学杂志。2007;64(6):621-32。
- 59.
Buchfink B, Xie C, Huson DH。快速和敏感的蛋白质对齐使用金刚石。Nat方法。2015;12(1):59-60。
- 60。
Nei M,Gojobori T.估计同义词和非纯核苷酸取代数的简单方法。mol Biol Evol。1986; 3(5):418-26。
- 61。
Chen C,陈H,张Y,Thomas HR,Frank Mh,He Y,夏R.TBTOOLS:用于大型生物数据的互动分析开发的一体化工具包。莫尔植物。2020; 3(8):1194-202。
- 62。
周y,yin x,duan r,hao g,guo j,jiang x. spaha1和spsos1坐标在转基因酵母中提高耐盐性。Plos一个。2015; 10:E0137447。
- 63。
苏H,Zou T,林R,郑j,jian s,zhang m.从Ipomoea pes-caprae中参与酵母和植物积累的Ipomoea pes-caprae植物素合成酶基因的表征。植物理性生物化学。2020; 155:743-55。
确认
我们真诚地感谢几名提供我们的未知工人Canavalia Rosea植物和种子采自中国海南省。
资金
本研究得到了国家自然科学基金资助项目(No. 613613716)的资助。基金资助:国家自然科学基金资助项目(No. U1701246, No. 31570257);广东省科技计划资助项目(No. 2019B121201005);华南海洋科学与工程广东实验室(广州)重点引进人才专项(No. XDA13020500);GML2019ZD0408)。资助者在研究设计、数据收集和分析、决定出版或手稿准备方面没有任何作用。
作者信息
隶属关系
贡献
S.J.和m.z.构思和设计实验;R.L.和J.Z.进行了大部分实验,收集并分析了数据;L.P.有助于测量生理参数;Z.W.和那个和时间帮助序列分析;R.L.和M.Z. drafted the manuscript; S.J. and M.Z. revised the manuscript. All authors have read and agreed to the published version of the manuscript.
相应的作者
道德声明
伦理批准并同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
附加信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:图S1
.CRAQP的结构特征。一个疯狂。bCrPIPs。cCrTIPs。dCrxips。eCrSIPs。
附加文件2:图S2
.的过表达分析CRPIP1; 5.在三种转基因拟南芥中(牛1 #,牛5#,牛10#).一个RT-PCR和基因组DNA PCR分析CRPIP1; 5.在转基因拟南芥系和WT植物中。b定量RT-PCR分析CRPIP1; 5.在转基因拟南芥系和WT植物中。
附加文件3:图S3
.过度表达分析CRPIP1; 5.在转基因拟南芥中(牛1 #,牛5#,牛10#)和转基因植物对种子萌发率的耐受性分析。一个转基因系和WT种子的照片在MS培养基或MS培养基上发芽,NaCl,NaCl加Nahco3.(pH8.2),或7天的甘露醇。罪犯在NaCl下的WT和转基因系中的种子萌发速率(b), NaCl + NaHCO3.(pH值8.2)(c)和甘露醇(d)7天后的胁迫。
附加文件4:图S4
.转基因植物的盐,盐碱和高渗透应激分析CRPIP1; 5.基于幼苗根长度的过度表达。将四天幼苗移植到含有NaCl,NaCl加Nahco的MS培养基中3.(pH 8.2)或甘露醇,培养7 d后测量根长。一个转基因素的照片(CRPIP1; 5.牛1 #,牛5#,牛10#)和WT幼苗在MS或MS + NaCl、NaCl + NaHCO培养基上3.(pH8.2),或甘露醇;罪犯NaCl处理下WT和转基因株系的幼苗根长(mm)b), NaCl + NaHCO3.(pH值8.2)(c)或甘露醇(d)7天后的胁迫。误差条表示基于三个重复的SD(n≥3)。星号表示与对照的显着差异(学生t-test P值,*p<0.05和**p< 0.01)。
附加文件5:图S5
.对转基因植物进行盐、碱胁迫分析CRPIP1; 5.基于成人拟南芥的生长的过度表达。一个转基因拟南芥的叶片表型牛在200mm NaCl胁迫下培养7 d。b转基因拟南芥的叶片表型牛线条和WT植物100毫米Nahco3.(pH值8.2)胁迫4天。
附加文件6:图S6
.CrPIP1;5蛋白亚细胞定位。在激光共聚焦显微镜下观察了表达35S:GFP- crpip1、5个融合蛋白(上两株)和35S:GFP(下两株)的拟南芥根。
附加文件7:表S1
.获得的CRAQP.S的核苷酸和蛋白序列信息。
附加文件8:表S2
.本研究中使用的引物信息。
附加文件9:表S3
.的类别CIS.类中标识的代理元素CRAQP.S'启动子地区。
附加文件10:表S4
.MEME Web服务器标识的CRAQP的保守主题序列。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
林,R.,郑,J.,PU,L.等等。水素家族的基因组鉴定与表达分析Canavalia Rosea以及它们在盐碱土壤和干旱胁迫适应中的作用。BMC植物杂志21,333(2021)。https://doi.org/10.1186/s12870-021-03034-1
收到了:
接受:
发表:
关键词
- 水通道蛋白
- 干旱
- 盐碱土壤
- 水分亏缺
- Canavalia Rosea(SW。)DC。