摘要
背景
虽然植物是人类饮食中维生素C的主要来源,但我们对植物如何合成仍然知之甚少L.- 血液酸(ASA)和调节其在不同植物组织中的浓度的内容。特别是,来自不同植物的储存器官的维生素C含量的巨大变异仍然是未解释的。植物储存器官中可能的ASA源包括原位通过Phloem在其他组织中合成ASA的合成和长距离传输。在本文中,我们研究了第三种可能性,在韧皮中的合成。
结果
我们利用蚜虫的花柱切断术和组织化学方法为广泛的作物韧皮部液中存在AsA提供了证据。在富含韧皮部的血管渗出液中,几乎检测到初级AsA生物合成途径的所有酶的活性Cucurbita浆果在分离的韧皮部束中证实了AsA的生物合成芹菜graveolens叶柄与一系列前体孵育(D.-葡萄糖,D.- 曼诺斯,L.- 糖糖和L.-galactono-1 4-lactone)。韧皮部吸收D.- [u-14c]甘露糖和L.- [1-14C]半乳糖(AsA生物合成途径的中间产物)以及L.- [1-14C]亚撒和L.- [1-14C] DHA,被观察到烟草benthamiana叶子光盘。
结论
我们提出了新的发现,活性AsA生物合成发生在韧皮部。现在必须在整个植物AsA分布机制的背景下考虑这个过程。这项工作将激发旨在阐明的研究体内韧皮部AsA生物合成底物及其对植物贮藏器官AsA积累的贡献。
背景
在植物中,L.-抗坏血酸(AsA)是在缺乏过氧化氢酶的情况下,通过解毒叶绿体中的超氧化物和过氧化氢来实现光合活动所必需的[1].ASA也关键涉及α-生育酚和玉米蛋白的再生和PS II活性的pH介导的调节[2].抗坏血酸的光合代谢的关键重要性是由它的丰度在叶绿体中,其中它的浓度达到50mM的[强调2].抗坏血酸的光合作用组成作用解释了离开其广泛的分布,一般含量高[3.那4.].草本植物中AsA含量变异系数为59%(211种),木本植物中AsA含量变异系数为67%(41种)。相反,非光合组织,如贮藏器官,AsA含量的变异性通常要高得多。我们根据65种水果和蔬菜的现有数据估计,平均维生素C (AsA +脱氢抗坏血酸[DHA])含量为1.1 mg gFW-1变异系数为334%。例如,在camu camu (Mirciaria dubia),含有高达30毫克的GFW-1维生素C [5.]和Medlar(Mespilus蠊)含有少于3μg的GFW-1[6.].没有明显的分类学解释这种差异,并且在包括培养物种(如草莓和黑醋栗)(如草莓和黑醋栗))内也观察到储存器官ASA含量的大变化[7.那8.].植物储存器官中ASA含量的巨大可变性也没有明确的生理解释,但我们对这些组织中的ASA功能的理解仍然非常有限。除了其一般抗氧化功能外,ASA涉及细胞分裂,细胞壁代谢,细胞膨胀和植物病原体相互作用[9.].
最近,我们对植物中的ASA生物合成的理解的进展已经取得了预期。斯金罗诺夫组提出的生物合成途径普遍共识[10,代表了植物的主要途径。从分析中得到了证实拟南芥抗坏血酸缺失突变体[11那12以及对相关基因的识别和操作[13-15].然而,有报道称,在莴苣过表达的大鼠古龙内酯氧化酶中AsA积累[16]和在答:芥构成草莓的表达草莓的D.-半乳糖醛酸还原酶17表明可能有其他可行的途径。此外,有报道称,AsA在玉米和烟草中积累,构成性地过表达AsA循环基因DHA还原酶[18].因此,尽管这种兴趣重新感兴趣,但控制储存器官中ASA积累的机制仍然很大程度上是难以捉摸的。仍然尚不清楚,例如,储存器官中的ASA累积是否发生原位从光合活性区域的合成或输入。有证据表明,开花后果实中发育调节的高速率AsA积累[8.而在马铃薯块茎中,在块茎诱导后不久就观察到大量积累[19].
AsA合成的能力似乎在植物细胞中普遍存在,在各种培养的细胞和切除的组织或器官与适当的底物孵育(例如[10那15]和[19-23])。然而,有证据表明AsA在储存器官中直接生物合成在足底不见了。最近的报告[24]描述了放射性标记AsA的摄取拟南芥和Medicago叶子及其运动以沉入组织,如射击和根尖,花,单次和水槽叶,导致作者建议ASA的长途运输发生在植物中。在韧皮症中的存在在第一次暂时报道[25],但其具体功能并没有得到适当的调查。本文件的目的是提供抗坏血酸韧皮部内容的附加信息,尤其是它的起源和其在贮藏器官抗坏血酸积累的影响。通过采用宽范围的植物材料和利用最适合的模型系统中可用,我们表明,抗坏血酸是植物韧皮部汁液的普遍组成,而分离的韧皮部链是胜任从遥远的基板抗坏血酸的生物合成。此外,我们证明了抗坏血酸生物合成的中间体D.- 曼诺斯和L.半乳糖可被韧皮部吸收。本文还讨论了这些发现与全植物AsA分布的关系。
结果
检测植物血管组织中的ASA
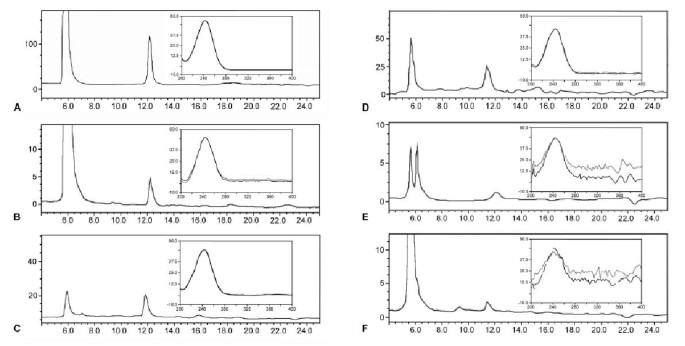
采用蚜虫截柱法从大麦、豌豆、马铃薯、烟草、芜菁等多种作物中分离韧皮部分泌物,不受其他组织的污染。当用高效液相色谱分析渗出液时,所有病例均检测到AsA(图。1).我们无法从渗出材料的水避免蒸发,因此没有试图量化排泄物抗坏血酸浓度。然而,应该指出的是,在所有情况下抗坏血酸表现为在被柱保留245nm处的吸收带的主导化合物。
为了获得更大量的渗出物以定量AsA,我们将注意力集中在葫芦科水果,来自哪个相对较高的血管渗出物(约1ml kg-1水果)可以获得。表格1显示了许多水果血管渗出液中AsA的浓度葫芦科相对于可溶性碳水化合物。值在0.49 ~ 1.44 mg gFW之间-1(2.8 ~ 8.2 mM),碳水化合物总浓度为10.95 ~ 23.28 mg gFW-1。
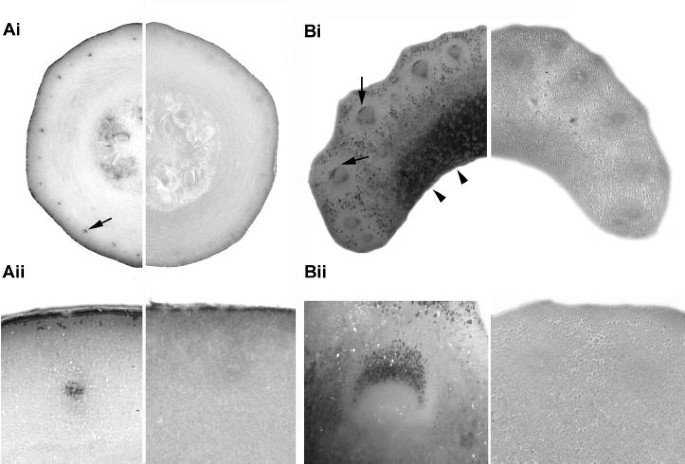
AsA在维管组织中的定位通过使用甲醇AgNO对小胡瓜果实和芹菜叶柄切片(也用于代谢研究,见下文)的组织化学分析得到证实3.解决方案。该方法利用了AsA对Ag的特异性还原能力+在低温下产生金属银沉积物的形成[26].在西葫芦果和芹菜叶柄中,金属银沉积物在血管束中丰富,在该组织中染色明显限于芹菜中的韧皮元素(图。2).此外,在西葫芦果实中种子发育周围的组织和芹菜叶柄的贮藏薄壁组织中染色也很明显。在用CuSO预处理的对照样品中未观察到金属银沉积的形成4.,诱导氧化氧化。Agno的渗透3.通过预孵育25毫米的组织来证实薄壁细胞L.- 导致实质组织强烈染色的糖糖(数据未显示)
在韧皮的asa生物合成
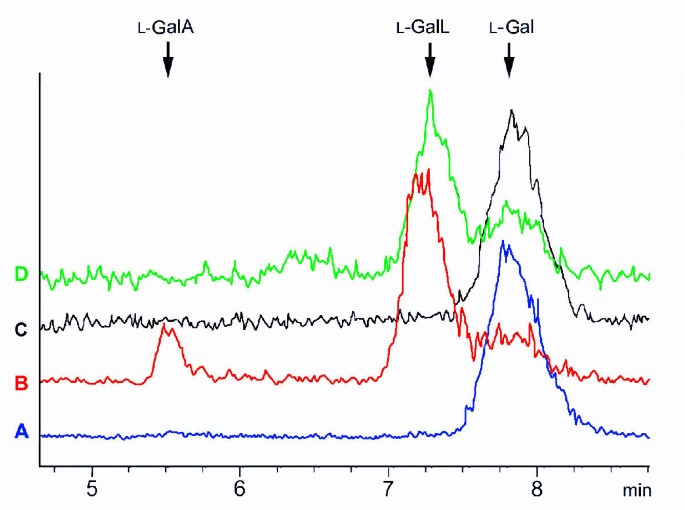
从小胡瓜果实的切除获得的相对大量的维管渗出液使我们能够研究AsA生物合成(Smirnoff-Wheeler)途径的酶的存在(图。3.).我们检测了之前鉴定的AsA生物合成途径的所有酶的活性[10],但终端(线粒体)酶除外L.-galactono -1,4-内酯脱氢酶(表2).同样,没有转换L.在分离的血管渗出物中检测到半乳酰-1,4-内酯到ASA(数据未显示)。血管渗出物和均质的果组织都是GDP的酶水解的态度L.- [1-14C]半乳糖虽然我们无法测试的活动L.- 由于基材的不可用, - 糖糖-1-磷酸磷酸酶。在许多情况下,渗出物中的酶活性高于全果组织。在某些情况下,例如磷酸磷酸异构酶,磷酸胍异构酶和GDP-D.- 甘蔗糖磷酸化酶,仅在血管渗出物中检测到活性。孵化L.- [1-14半乳糖直接在收集的血管渗出液中不加任何添加导致形成L.- - - - - - (14C] galactono-1 4-lactone(无花果。4.).这种转化可通过对渗出液的脱盐来阻止,并可通过在脱盐的渗出液中加入NAD来恢复。
Smirnoff-Wheeler AsA生物合成途径。植物通过磷酸化己糖中间体从葡萄糖合成AsA。1.己糖激酶(E.C. 2.7.1.1), 2。磷酸葡萄糖异构酶(E.C. 5.3.1.9), 3。磷甘聚糖异构酶(e.c 5.3.1.8);磷酸甘糖突变酶(e.c 5.4.2.8);gdp -甘露糖焦磷酸化酶(E.C. 2.7.7.22), 6。甘露糖-3,5-异戊二烯酶(e.c 5.1.3.18), 7。GDP-L.半乳糖焦磷酸酶,8。L.-galactose-1-phosphate磷酸酶9。L.-Galaction脱氢酶,10。L.-半乳糖-1,4-内酯脱氢酶(E.C. 1.3.2.3)。相关,D.-葡萄糖;FRU,D.果糖;男人。D.- 曼诺斯;L.加,L.-Galaction;L.胆,L.-Galactono-1,4-内酯。如果没有e.c,则列出了他们尚未分配的数字。
的合成L.- - - - - - (14C]从半乳糖酸-1,4-内酯L.- [1-14C面食水果中的半乳糖渗出。从渗出物中获得的放射性粗大图L.- [1-14C]半乳糖在30℃下30分钟。该反应通过添加H停止3.阿宝3.在去除沉淀和在线流动闪烁检测的高效液相色谱分析之前。单独的色谱图显示反应包含L.- [1-14C]半乳糖和加热(100°C)渗出液(A)、新鲜渗出液(B)、脱盐渗出液(C)和添加0.5 mM NAD的脱盐渗出液(D)L.- [1-14C)半乳糖(L.加),L.- [1-14C] galactonolactone (L.gall)和L.- [1-14C]加乳糖酸(L.-GALA)显示。
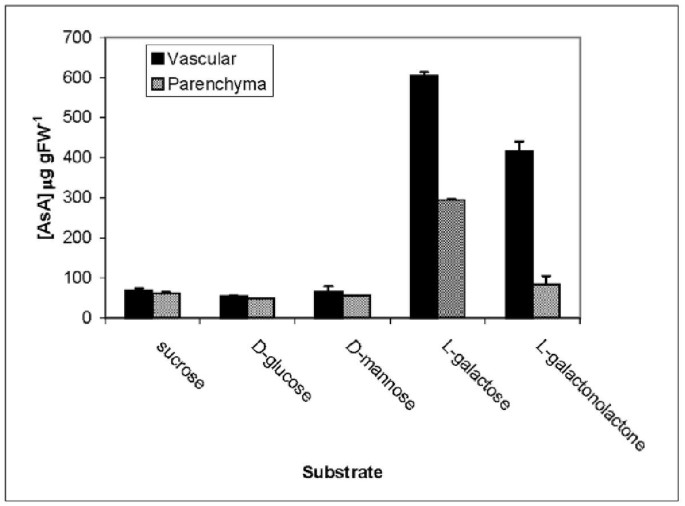
韧皮中ASA生物合成途径的功能性表征体内使用来自芹菜叶柄的分离的韧皮氏链,是韧皮新陈代谢的已建立的模型系统[27].韧皮部束或贮藏薄壁组织盘用不同的AsA前体孵育18 h。AsA在两种组织中均有积累L.半乳糖但韧皮股累积约与实质(图相比抗坏血酸的量的两倍。5.).孵化与L.-半乳糖-1,4-内酯只在韧皮部束中大量积累AsA。当样品与蔗糖一起孵育时,没有观察到AsA积累,D.葡萄糖或D.甘露糖。然而,这两种组织从这些底物合成AsA的能力通过孵育得到了证实D.- [u-14c]葡萄糖或D.- [u-14C]甘露糖。从这些基材以及来自两种基板以及来自两种基材的放射性标记积聚到ASA中L.- [1-14半乳糖(表3.).凭借所有标记的底物,Phloem Strands显示出更高的总摄取和显着更高比例的标签掺入L.- - - - - - (14C]AsA与薄壁组织盘比较。
叶片韧皮部对AsA和其他前体的吸收
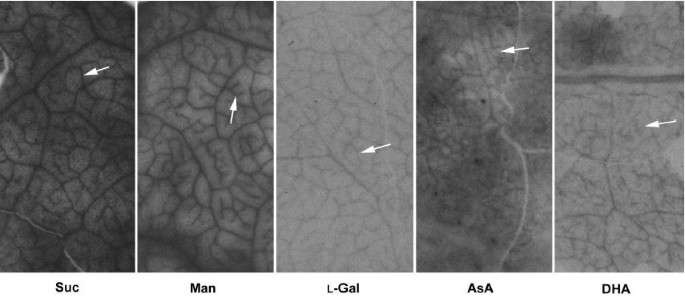
源叶韧皮术占用的能力L.- [1-14C]AsA,或一些与AsA代谢相关的底物([1-14C] DHA,D.- [u-14c]曼诺斯,L.- [1-14(U - C)半乳糖和14(C]蔗糖作为参比)烟草benthamiana,这是研究韧皮部吸收的模型系统,因为它可以很好地分辨主脉和小脉[28].虽然[U -14C]蔗糖和D.- [u-14甘露糖似乎更容易被椎间盘吸收,放射性分布模式与所有使用的前体相似,显示出明显的主静脉和小静脉标记(图)。6.).除了L.- [1-14C]抗坏血酸,在温育期间,观察到应用的基体没有显著代谢。和L.- [1-14抗坏血酸,约80%的放射性存在于[14C]DHA在实验结束时用HPLC与流动闪烁分析测定(数据未显示)。
讨论
检测韧皮中的ASA
我们用花柱切开术对几种作物(大麦、豌豆、土豆、烟草、萝卜)的韧皮部液进行了检测,无一例外检测到AsA。这一发现证实了早先的报道[24那25,表明AsA是植物韧皮部中广泛存在的成分。在本研究或以前的研究中,通过截风术获得的样品中AsA浓度未确定,但值为0.49至1.45 mg gFW-1(2.8 ~ 8.2 mM)从成熟果实的维管渗出物中获得葫芦科物种(表1).这种渗出物已被广泛使用以研究磷脂新陈代谢[29-32],并且具有韧皮部汁液的典型特性,如高pH值和无机离子,氨基酸和有机酸水平与其他物种的韧皮部汁液相似。木质部汁液或水通道大量稀释的可能性也已被排除[32]血管渗出物中检测到的ASA浓度葫芦科与Ziegler报告的数值相似[25为其他植物物种。利用组织化学方法获得了韧皮部组织中存在AsA的额外证据,该方法基于AsA减少冷的、酸化的乙醇AgNO的能力3.并产生金属银沉积[26].在这两种小胡瓜水果和芹菜叶柄,(即用于在生物合成抗坏血酸实验研究的植物器官),其与特异性定位于韧皮组织中芹菜的情况下(图金属沉积血管区域中观察到强染色。2).虽然这项技术不是针对AsA的,但在低温和pH值下,其他还原剂无效时,其选择性显著提高[26那33].另外,用CuSO对植物标本进行预处理4.完全防止金属银沉积物的形成(图2).血管区域相对于周围实质区域的染色较强烈,这可能是由于细胞质中的AsA浓度大大高于液泡[34].以前报道了这种技术的未真空(共源性)细胞的强烈染色[35].
在韧皮中的组合asa
研究了ASA合成酶的存在,从西葫芦成熟果实中研究了血管渗出物,该系统验证了韧皮植物蛋白的分离和鉴定[36].除了推定L.-Galaction 1-磷酸磷酸酶[10] 和L.-Galactono-1,4-内酯脱氢酶,在血管渗出物中检测到所有ASA生物合成酶的活动。这包括负责GDP的水解的酶活性 -L.-半乳糖是植物中AsA生物合成的关键限速步骤(汉考克和堇菜,在制备中)。据我们所知,这是对GDP的第一次直接分析L.- 植物组织提取物中的糖糖水解。通过与整个组织提取物的比较,渗出物中的酶活性显着,并且对于一些酶活性,可仅在渗出物中检测。
然而,这可能再次反映了实质细胞的真空溶解,导致酶活性低于我们的检测水平。除了所需的酶活性外,还表明血管渗出物含有吡啶核苷酸,所需的吡啶核苷酸L.- [1-14C]半乳糖进入L.- - - - - - (14C] galactono-1 4-lactone(无花果。4.).进一步的转换L.-半乳糖-1,4-内酯的合成需要活性L.-半乳糖-1,4-内酯脱氢酶,AsA生物合成途径中唯一的膜结合酶(位于线粒体膜内)[37])。一般认为,韧皮部液中线粒体并不丰富,体内,代谢物如L.- 通过专门的Plasmodesmata可以在筛子元素和伴侣细胞之间交换聚酰胺-1,4-内酯[38].因此体内AsA在韧皮部组织中的生物合成(IE。筛管-伴细胞[SE-CC]复合物)可能涉及筛管和富含线粒体的伴细胞之间的酶合作。
韧皮部组织的适应能力体内转换L.半乳糖或L.- 来自芹菜叶片的分离的Phloem链中对ASA的-Galactono-1,4-内酯(图。5.).另外,韧皮部束的孵化D.- [u-14c]葡萄糖或D.- [u-14C]甘露糖导致ASA明显标记,清楚地证明该组织具有完全运营的ASA生物合成(Smirnoff-Wheeler)途径(图。3.).此外,AsA的合成和从标记的前体(包括L.- [1-14与储存的疗法组织相比,韧皮氏链中的C]半乳糖显着高,但在使用的组织之间观察到前体吸收率的差异。所使用的不同实验方法的总体结论是韧皮柱意外地代表具有高度活跃的ASA生物合成能力的组织。
韧皮部的起源
我们如何将我们发现的韧皮部AsA生物合成与Franceschi和Tarlyn提出的植物中AsA长距离运输假说相一致[24] ?本文报道了该技术的应用14c-asa叶子襟翼紫花苜蓿和答:芥导致其移位到下沉组织。我们还发现L.- [1-14C] AsA ([1 -14C]DHA)来源的叶圆盘烟草benthamiana导致主静脉和小静脉放射性标记的积累。然而,当外源底物通过磨损或损坏的叶片引入植物运输系统时,需要注意解释实验。提供给叶片的外源性物质的韧皮部易位(通过质量流)和在汇中卸载的证据可从二乙酸羧基荧光素和其他韧皮部示踪剂的实验中获得。[39]]。对二乙酸羧基荧光素的研究也表明,在向sink组织易位的过程中,韧皮部渗漏的带电分子(如AsA)是最小的。另一种可能是韧皮部AsA的生物合成可能与AsA的长距离运输直接相关。例如,已知SE-CC含有蔗糖合酶,该酶参与蔗糖裂解以维持能量生产[40].因此,Sucrolytic中间体可用于通过Smirnoff-Whiper路径维持Se-CC复合物内的ASA生物合成。从培养的分离的马铃薯间获得的微块体外以蔗糖作为唯一的碳源,在黑暗中积累AsA,其浓度与从大田植物中获得的块茎中观察到的浓度相似[19].马铃薯块茎是富含韧皮部的器官,在维管环内外由韧皮部束组成的网状结构[39AsA在马铃薯块茎中的分布与韧皮部的分布密切相关(Viola et al.,未发表)。然而,我们的发现D.- [u-14c]甘露糖和L.- [1-14C]半乳糖容易被占用n benthamiana叶盘(导致的主要和次要的标记强度脉类似于[U-的14C]蔗糖在前者的情况下)也提出了该抗坏血酸的生物合成的更直接的中间体可通过在叶肉被提供给韧皮部的可能性。在接下来的文章中,我们表明,L.-半乳糖供应源马铃薯叶片导致AsA在块茎发育中积累(Tedone et al., in preparation)。
结论
我们在这里展示了高等植物的韧皮肽中的ASA存在是普遍的,并且西葫芦和芹菜的SE-CC复合物能够从一系列基材中合成ASA。需要进一步的工作来确定韧皮肌基质的基材的性质体内并建立定量地将Phloem生物合成对储存器官中总ASA含量的贡献。尽管ASA转运仪将ASA转移到涉及痉挛卸载步骤的储存器官中,但Phloem生物合成可以代表那些储存器官(例如马铃薯块茎)的显着直接来源,其中Phloem卸载遵循一个互相控制的路线[39].
方法
植物材料及制备
芹菜 (芹菜graveolensL.)和Gulfette(Curbita浆果L.)都是在当地购买的。其他植物则在没有加热的温室中生长,在自然光的条件下,在标准的泥炭、沙子、石灰石、蛭石和含有辛罗施特和辛罗施特6肥料的celcote混合物中生长。植物每天都手工浇水。芹菜维管束和薄壁组织盘按所述制备[27].从西葫芦和其他植物中收集血管渗出物葫芦科用阳性移液移液管从成熟的切块果实中直接转移到适当的冰冷缓冲液中进行酶活性或AsA测定(见下)。其他植物的韧皮部分泌物直接从茎鞘中提取Myzus persicae喂养源叶叶柄。在HPLC注射之前,用或没有5mM Tris(2-羧乙基)盐酸盐(TCEP)稀释到冰冷的5%偏磷酸中的Phloem渗出物。
化学品和标记的基材
D.- [u-14C]葡萄糖(s.a 11.47 MBq mmol-1),D.- [u-14C]甘露糖(s.a 11.36 MBq mmol .-1), (U -14C]蔗糖(S.A.17.09 MBQ mmol-1) 和L.- [1-14C]AsA 0.52 MBq mmol-1)来自英国的Amersham Pharmacia Biotech,Little Chalfont。L.- [1-14C]半乳糖(S.A.2.04 MBQ mmol-1)是从美国放射性标记的化学品,美国圣路易斯,圣路易斯。[14C] DHA是通过孵育0.037 MBQ而获得的L.- [1-14C]AsA加10 μg抗坏血酸氧化酶(e.c 1.10.3.3;罗氏,刘易斯,英国)在50毫米磷酸钠缓冲液pH 5.6(最终体积100 μl)。L.- [1-14C]通过孵育为0.037 MBQ合成苯乙烯酸L.- [1-14C]半乳糖与1U聚焦脱氢酶(E.C. 1.1.1.122;Sigma, Dorset,英国)和0.5 mM NADP在50 mM甘氨酸koh缓冲液pH 9.5(最终体积100 μl)中。L.- [1-14用0.037 MBq孵育得到半乳糖内酯L.- [1-14C]半乳糖,1U岩藻糖脱氢酶和50mM MOPS缓冲液pH 7.8(100μl)中的0.5mm NADP。GDP-L.- [1-14C]半乳糖是来自英国马洛葛兰素史克制药公司Ken Lawrie博士的礼物,是根据Baisch and Ohrlein的方法合成的[41从L.- [1-14半乳糖[ARC, St. Louis, USA]。最终产物比活性为0.37 MBq mmol-1,通过阴离子交换HPLC和整体纯度估计,放射化学纯度> 95%> 90%估计1H和13C NMR。
除了L.- 从西格玛购买的脱氢酶和磷蛋白酶异构酶,所有酶购自所有酶,从英国东萨塞克斯州罗氏购买。
酸性硝酸银对AsA的原位染色
或者芹菜叶柄或小胡瓜水果的横截面(大约1mm)切成用手和在蒸馏水中简单洗涤,然后染色并固定为通过奇诺伊[描述26].对照反应是在5% CuSO水溶液中首先氧化组织中的AsA4.描述(26].
组织培养,代谢物提取和高效液相色谱分析
将芹菜组织在由20mM MES pH 5.5,300mM甘露醇,5mM MgCl组成的缓冲液中孵育2, 2毫米氯化钾,1毫米氯化钙2和1 mm caso4.[27]在培养皿中旋转摇动100 rpm。对于具有未标记的前体的实验,将合适的化合物加入到终浓度为25mm,培养持续18小时。对于标记实验,将400mg组织在含有111 kBQ的650μL缓冲液中孵育D.- [u-14C]葡萄糖,D.- [u-14C]甘露糖或L.- [1-14C]半乳糖在密封的容器中,100 rpm旋转摇动4小时2然后加入5倍体积的5%(W / V)偏磷酸和进一步均质化。通过离心(16000克,1℃,5分钟)除去细胞碎片。将上清液直接用于减少抗坏血酸的分析或通过HPLC [用5mM TCEP(1个小时,4℃)分析总抗坏血酸(AsA)的测量之前温育22].提取前立即加入组织样本的真实AsA的回收率超过90%。在放射标记实验中,将组织从培养培养基中取出,在5ml缓冲液a中洗涤3次,每次5分钟2并在5体积的5%高氯酸(PCA)中均化含有5mM TCEP的5体积。通过离心(16000g,5分钟,1℃)和pH指示器(BDH 4080指示剂,20μLmL,通过离心(16000g,5分钟,1°C)除去细胞碎片(16000g,5min,1°C)后除去细胞碎片-1)中的溶液加入到上清液中。将样品的pH值范围是由5个M K的溶液的逐滴添加调至6-72CO.3.。不溶性KClO3.通过离心(16000 g, 5 min, 1°C)去除盐分,上清液分成500 μl等份,应用于SAX SPE盒(100 mg,醋酸反离子,Alltech, Carnforth, UK)。用4ml H冲洗柱后2啊,L.- - - - - - (14用4ml 300 mM的甲酸释放AsA。冻干后用200 μl H重悬2啊,L.- - - - - - (14C]AsA经HPLC进一步纯化和定量,如前所述[22],但使用Packard 150TR放射检测器在均质模式(500 μl流动池)中检测和定量放射性,柱后加入3ml min的Ultima Flo M闪烁剂-1。在这些条件下,恢复真实的L.- [1-14C]在提取之前立即添加到组织样品中的ASA超过85%。总碳水化合物测定葫芦科采用苯酚-硫酸法测定果实渗出物[42].
酶活性的提取和测定
己糖激酶(HK)、磷酸葡萄糖异构酶(PGI)、磷酸甘糖异构酶(PMI)、磷酸甘糖突变酶(PMM)、GDP-L.-Galaction焦磷酸酶(GDP-L.加PPPase)和L.- 糖糖脱氢酶活性(L.-GalDH)从小胡瓜果实组织中提取,在50 mM HEPES pH 8.0, 5 mM MgCl的冰水中,用臼和杵研磨2, 5 mM DTT, 1 mM EDTA, 1 mM EGTA, 1 mM苯甲脒盐酸盐和0.5 mM PMSF (1:3 w/v)。通过离心(10000 g, 10分钟,1°C)去除细胞碎片,样品上清液在Sephadex G25 PD10色谱柱上脱盐(Amersham Biosciences, UK),使用前用相同的缓冲液平衡。GDP-D.-甘露糖焦磷酸化酶活性如上述所述提取和脱盐,除了整个使用的缓冲液由100 mM tris pH 7.5、15 mM 2-巯基乙醇和0.5 mM PMSF (Keller所述)组成等等。[13].GDP-D.用100 mM tris pH 7.6、5 mM DTT和1 mM EDTA对-甘露糖-3,5-异戊二烯酶活性进行提取和脱盐[43].
L.-Galactono-1,4-内酯脱氢酶(L.-GalLDH)活性的提取44],但线粒体以30000 g离心收集。在所有病例中,血管渗出液完全作为整个组织处理,只是渗出液直接稀释到提取缓冲液中,没有在研钵和杵中研磨。
在酶提取物、50 mM HEPES pH 8.0、5 mM MgCl组成的反应混合物中测定HK活性22 mM ATP, 0.5 mM NAD和1 U NAD依赖的葡萄糖-6-磷酸脱氢酶(来自明串珠菌属mesnteroides),最终体积为1ml。反应在30℃进行,开始时加入2mmD.葡萄糖。反应动力学随后由日立U-3010分光光度计在340 nm处测量NAD还原。用煮沸的提取物进行对照反应。以果糖为底物,在反应混合物中添加1u PGI,或以甘露糖为底物,在PGI中添加1u PMI,测定HK活性。
在酶提取物、50 mM HEPES pH 8.0、5 mM MgCl组成的反应混合物中测定PGI活性2, 0.5 mM NAD, 5 μM ZnSO4.和1U葡萄糖-6-磷酸在1毫升的最终体积脱氢酶。将反应物在30℃下进行的,并开始通过加入2mM的D.-fructose-6-phopshate。反应动力学测定已糖激酶描述。测量PGI的PMI活性,但反应混合物中添加了1 U PGI,并由添加PGI开始D.- 营养-6-磷酸盐。除了PGI之外,通过包括1u PMI和开始反应,通过包括1μmi来测定PMM活性。D.-mannose-1-phosphate。在所有病例中,对照反应均使用煮沸的酶制剂进行。
GDP-D.- 如上所述测量 - 甘露糖磷酸化酶活性[13],但反应混合物中加入了2 mM NaF,对照反应中没有无机焦磷酸盐。反应与时间呈线性关系,反应时间可达2 hD.如所描述的,测定甘露糖-3,5-差向异构酶活性[43].GDP-L.- 在由酶提取物,50mM Hepes pH 8.0和5mM MgCl组成的反应混合物中测定-GalactiOse焦磷酸酶活性2加入1.11 kBq GDP-,反应开始L.- [1-14半乳糖。在添加500 μl 10% (w/v)活性炭后进行短暂的旋涡反应,终止反应。通过离心去除木炭(16000 g;10分钟;1°C)和通过闪烁计数(Packard tric - carb 2000CA)估算上清液中的放射性。
L.在由酶提取物组成的反应混合物中测量-GALDH活性,50mM HEPES pH 8.0,5mM MgCl2和0.5毫米NAD。通过加入2mm开始反应L.半乳糖。叙述了己糖激酶的反应条件和动力学测定。L.同时还分析了添加-半乳糖脱氢酶的活性L.- [1-14半乳糖。样品在30°C孵育,加入渗出液至5% (w/v) H等体积停止反应3.阿宝3.。
通过离心去除沉淀物质,形成L.- [1-14C]半乳糖酸通过高效液相色谱法监测,色谱柱为Metacarb 87C 300 × 7.8 mm (MetaChem Technologies Inc., Torrance, CA),色谱柱保持在70°C,流动相为1 ml min的超纯水-1。所使用的HPLC设备如Hancock等人所述[22],但使用Packard 150TR放射检测器在均质模式(500 μl流动池)中检测和定量放射性,柱后加入3ml min的Ultima Flo M闪烁剂-1。
L.-GALLDH活性被按照OBA等人所述进行测定。[44除了另外含有0.03%Triton X-100和0.1mm KCn的缓冲液以防止细胞色素C氧化酶的再氧化细胞色素C [37].在另一偏差与已发表的方案中,通过添加开始反应L.-半乳糖-1,4-内酯的摩尔消光系数为25300。
源叶片加载和放射自显影
源叶负载14c -同化物是由Turgeon和Gowan描述的[45].从凝结性植物中除去叶子,用缓冲液B润湿(25mm MES pH 5.5,20mM CaCl2).背面用金刚砂粉轻轻研磨,并用锋利的软木钻切割16毫米圆盘。在光(200 μmol m-2秒-1),在25°C下轻轻旋转摇晃15小时。最后,将光盘转移到10ml含1mm [U-14C]蔗糖,D.- [u-14c]曼诺斯,L.- [1-14C)半乳糖,L.- [1-14C] AsA或[1 -14DHA的最终含量为18.5 kBq mmol-1。孵化持续受到光3 h,随后,叶圆盘被移除,洗五次(20毫升,5分钟)缓冲区b .小样本的孵化缓冲区用来进行高效液相色谱分析,以确保没有新陈代谢发生在潜伏期的开始和结束。圆盘表面干燥并在滤纸之间冻干,滤纸在金属板之间用g形夹子固定。显影前,将干燥的叶片置于柯达Biomax单面x线胶卷-80°C下照射1周。
参考文献
- 1.
Noctor G,Foyer Ch:抗坏血酸和谷胱甘肽:保持在控制下的活性氧气。Annu Rev植物植物植物Mol Biol。1998年,49:249-279。10.1146 / annurev.arplant.49.1.249。
- 2.
Smirnoff N:植物中抗坏血酸的功能和代谢。Ann Bot。1996,78:661-669。10.1006 / anbo.1996.0175。
- 3.
一些被子植物的叶抗坏血酸。植物化学。1983,22:2493-2499。10.1016 / 0031 - 9422(83) 80147 - 2。
- 4.
琼斯E,休斯RE:一些树木和灌木木本的抗坏血酸含量的说明。植物化学。1984年,23:2366至2367年。10.1016 / S0031-9422(00)80554-3。
- 5.
Justi KC,Vesentainer JV,De Souza Ne,Matsushita M:营养成分和储存Camu-Camu(Myrciaria Dubia)纸浆中的维生素C稳定性。Archivos latinoamericanos de Nutricion。2000,50:405-408。
- 6。
Rodriguez MAR, Oderiz MLV, Hernandez JL, Lozano JS:高效液相色谱法测定各种水果中维生素c和有机酸。色谱学报,1992,30:433-437。
- 7。
Sone K, Mochizuki T, Noguchi Y:草莓品种和采收期抗坏血酸含量的变化。中国科学(d辑:地球科学),1999,19(6):514 - 514。
- 8。
Viola R,Brennan RM,Davies HV,Sommerville L:L.-抗坏血酸的积累肋条nigrum.林志强,王志强,王志强,等。
- 9。
植物中的抗坏血酸:生物合成和功能。生物化学学报。2000,35(5):491 - 497。
- 10.
维C在高等植物中的生物合成途径。自然科学。1998,393:365-369。10.1038/30728。
- 11.
Conklin PL,Norris SR,Wheeler GL,Williams EH,Smirnoff N,最后RL:GDP-Mannose在植物抗坏血酸(维生素C)生物合成中的作用的遗传证据。美国国家科学院学报。1999,96:4198-4203。10.1073 / pnas.96.7.4198。
- 12.
Conklin Pl,Saracco SA,Norris SR,最后RL:鉴定抗坏血酸缺陷拟南芥突变体。遗传学。2000,154:847-856。
- 13.
Keller R,施普林格F, Renz A, Kossmann J:反义抑制gdp -甘糖焦磷酸化酶降低转基因植物抗坏血酸含量,导致衰老过程中的发育变化。植物学报,1999,19:131-141。10.1046 / j.1365 - 313 x.1999.00507.x。
- 14.
田端K,大羽K,铃木K,江坂L:生成并表达为反义RNA抗坏血酸缺陷型的转基因烟草细胞的性质L.-galactono-1 4-lactone脱氢酶。植物学报,2001,27:139-148。10.1046 / j.1365 - 313 x.2001.01074.x。
- 15.
反义抑制L.半乳糖脱氢酶在拟南芥提供证据在抗坏血酸合成中的作用,并揭示了浅色调节L.-Galactose合成。工厂J. 2002,30:541-533。10.1046 / J.1365-313x.2002.01315.x。
- 16。
Jain Ak,Nessler Cl:植物中抗坏血酸生物合成障碍的代谢工程。mol繁殖。2000,6:73-78。10.1023 /答:1009680818138。
- 17。
Agius F, Gonzalez-Lamothe R, Caballero JL, Munoz-Blanco J, Botella MA, Valpuesta V:转基因植物通过过度表达维生素C来提高植物体内维生素C水平D.-GalactuRonic酸还原酶。NAT BIOTECHNOL。2003,21:177-181。10.1038 / NBT777。
- 18。
陈志,杨泰,凌杰,常思昌,Gallie DR:通过强化循环利用提高植物维生素C含量。美国国家科学院学报。2003年,100:3525 - 3530。10.1073 / pnas.0635176100。
- 19。
Viola R, Vreugdenhil D, Davies HV, Sommerville L:积累L.马铃薯块茎匍匐茎尖的-抗坏血酸(Solanum Tuberosum.l .)。植物生理学报,1998,22(6):514 - 514。
- 20.
Yoneyama T, Yasuda M, Sato S, Takebe M:13CO.2刺激菠菜,抗坏血酸和草酸代谢的研究(Spinacia oleraceal .)。土壤SCI植物NUTR。1997年,43:1147-1151。
- 21.
david MW, Gilot C, Persiau G, Ostergaard J, Han Y, Bauw GC, van Montagu MC:抗坏血酸的生物合成拟南芥细胞悬浮培养。植物理性。1999年,121:535-543。10.1104 / pp.121.2.535。
- 22.
杨志强,杨志强,杨志强:生物合成L.-抗坏血酸(维生素C)酿酒酵母。微生物学杂志。2000,32(4):434 - 434。10.1016 / s0378 - 1097(00) 00155 - 5。
- 23.
德平托MC,托马西楼德加拉L:抗坏血酸的生物合成和抗坏血酸 - 谷胱甘肽周期在烟草亮黄色2.植物生理学生物化学的培养细胞的酶。2000,38:541-550。10.1016 / S0981-9428(00)00773-7。
- 24.
Franceschi VR, NL Tarlyn:L.-抗坏血酸在植物源叶韧皮部积累并运输到库组织。植物营养与肥料学报。2002,30(4):449 - 456。10.1104 / pp.007062。
- 25.
Ziegler H:运输物质的性质。植物生理学百科全书新丛书。编辑:Zimmermann MH, Milburn JA。1975,柏林:斯普林格出版社,1:59 -100。
- 26.
关于酒精酸性硝酸银试剂对抗坏血酸组织化学定位的特异性。生物化学学报,1999,20:105-107。
- 27.
Daie Y:芹菜的分离的韧皮部蔗糖摄取是单饱和的运输系统。足底。1987年,171:474-482。
- 28。
韧皮部负荷的两种途径。植物营养学报。1994,90:699-707。10.1034 / j.1399-3054.1994.900411.x。
- 29。
陈志强,陈志强,何志强:瓜类植物的同化转运。中国生物医学工程学报,1984,35:1575-1581。
- 30.
Alosi MC, Melroy DL, Park RB:稀释、谷胱甘肽和谷胱甘肽还原酶对葫芦果实韧皮部分泌物凝胶化的调控。植物生理学报。1998,21(4):489 - 494。
- 31.
Walz C, Juenger M, Schad M, Kehr J:成熟筛管中存在和活动的完整抗氧化防御系统的证据。植物学报2002,31:189-197。10.1046 / j.1365 - 313 x.2002.01348.x。
- 32.
Fiehn O:代谢网络Cucurbita Maxima韧皮部。植物化学学报。2003,32(6):875-886。10.1016 / s0031 - 9422 (02) 00715 - x。
- 33.
酒精硝酸银试剂对抗坏血酸组织化学定位的特异性研究。重新评价。生物化学学报,2003,22(4):427 - 434。
- 34.
Rautenkranz Aaf,Li L,Mächlerf,Märtinoiae,Oertli JJ:抗坏血性和脱氢血脂酸穿过原生质体和从大麦隔离的液泡膜(大麦芽沙柏)叶。植物生理学报,1994,19(6):591 - 598。
- 35.
Patel KR,Berlyn GP:组织培养中多芽形成的化学研究松coulteri。可以j bot。1983,61:575-585。
- 36.
关键词:基质辅助激光解吸电离飞行时间质谱多肽质谱指纹图谱源后衰变Cucurbita Maxima杜赫。通过二维聚丙烯酰胺凝胶电泳分离。足底。2001年,213:586-593。10.1007 / s004250100523。
- 37.
Siendones E,Gonzalez-Reyes Ja,Santos-Ocana C,Navas P,Cordoba F:肾豆抗坏血酸的生物合成。L.-Galactono-γ-内酯脱氢酶是位于Innner线粒体膜的内在蛋白质。植物理性。1999,10:90:907-912。10.1104 / pp.120.3.907。
- 38.
筛出行为中的元素。植物科学进展,2002,7:126-132。10.1016 / s1360 - 1385(01) 02225 - 7。
- 39.
Viola R,Roberts AG,Haupt S,Gazzani S,Hancock Rd,Marmiroli N,Machray GC,Oparka KJ:马铃薯的结节化涉及来自Applastic的交换机来抵抗韧性的Phloem卸载。植物细胞。2001,13:385-398。10.1105 / TPC.13.2.385。
- 40.
Geigenberger P,Langenberger S,威尔克I,Heineke d,Heldt HW,斯蒂特L:蔗糖是由韧皮部复杂的内蔗糖合酶和糖酵解代谢蓖麻l .幼苗。植物学报。1993,19:446-453。
- 41.
BAISCH G,OHRLEIN R:方便化学酶合成β-嘌呤 - 二磷酸糖(GDP - 岩藻糖 - 类似物)。Bioorg Med Chem。1997年,5:383-391。10.1016 / S0968-0896(96)00258-1。
- 42.
Dubois M, Gilles KA, Hamilton JK, Rebers PA, Smith F:比色法测定糖和有关物质。《肛门化学》1956,28:350-356。
- 43.
关键词:高效液相色谱法L.抗坏血酸和鸟苷5'-diphosphate-L.-半乳糖是植物维生素C途径的关键代谢产物。生物化学学报。2001,29(4):461 - 468。10.1006 / abio.2001.5165。
- 44.
Oba K,Ishikawa S,Nishikawa M,Mizuno H,Yamamoto T:净化和性质L.-半乳糖-γ-内酯脱氢酶是红薯根中抗坏血酸生物合成的关键酶。中国生物医学工程学报。
- 45.
Turgeon R,Gowan E:韧皮植入锦紫苏blumei在缺乏载体介导的从质外体摄取输出糖的情况下。植物生理学报。1999,19(4):444 - 449。
确认
作者希望感谢肯·劳瑞博士,葛兰素史克制药的GDP-礼物L.- [1-14半乳糖。苏格兰环境和农村事务部资助了这项工作。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
RDH承担了DMR协助的生化调查,负责数据准备并协助撰写稿件。SH进行组织化学染色,进行了摄取研究n benthamiana叶盘和制得的数字。RV构思研究并起草了手稿。
作者的原始提交的图像文件
权利和权限
关于这篇文章
引用这篇文章
Hancock,R.D.,McRae,D.,Haupt,S。等等。的合成L.韧皮部中的抗坏血酸。BMC植物杂志3.7(2003)。https://doi.org/10.1186/1471-2229-3-7
收到了:
公认:
发表:
关键词
- 韧皮部链
- 葫芦科物种
- 内酯脱氢酶
- 韧皮部吸收
- 植物储存器官