- 方法论的文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
一种用于植物多基因组编辑的CRISPR/Cas9工具包gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba14gydF4y2Ba,商品编号:gydF4y2Ba327gydF4y2Ba(gydF4y2Ba2014gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
为了加快CRISPR/Cas9 (clustered regularly interspaced short palindromic repeats/ CRISPR-associated protein 9)系统在多种植物上的应用,需要一个带有额外植物可选标记、更多gRNA模块和更简单的方法组装一个或多个gRNA表达盒的工具包。gydF4y2Ba
结果gydF4y2Ba
我们开发了一个基于pGreen或pCAMBIA主干的CRISPR/Cas9二元载体集,以及一个gRNA(guide RNA)模块载体集,作为植物多重基因组编辑的工具。这个工具箱不需要限制酶gydF4y2BaBsagydF4y2Ba我要生成最终的结构窝藏玉米密码子优化gydF4y2BaCas9gydF4y2Ba和一个或多个高效率的grna,只需克隆一步。利用玉米原生质体、转基因玉米株系和转基因技术对该工具包进行了验证gydF4y2Ba拟南芥gydF4y2Ba并显示出高效和特异性。更重要的是,使用这个工具,针对三种突变gydF4y2Ba拟南芥gydF4y2Ba在T1代转基因苗中检测到基因。而且,这种多基因突变可以遗传给下一代。gydF4y2Ba
结论gydF4y2Ba
我们开发了一个工具包,可以促进CRISPR/Cas9系统在多种植物中短暂或稳定的表达,这将有助于植物研究,因为它可以高效地产生具有多基因突变的突变体。gydF4y2Ba
背景gydF4y2Ba
精确、高效的基因靶向或基因组编辑方法对于植物功能基因组分析和基因工程作物的生产具有重要意义。对于大多数研究人员来说,转移DNA (T-DNA)和转座子插入突变仍然是模型植物(如双子叶)感兴趣的基因突变的主要来源gydF4y2Ba拟南芥gydF4y2Ba还有单子叶水稻(gydF4y2Ba栽培稻gydF4y2Ba)[gydF4y2Ba1gydF4y2Ba],[gydF4y2Ba2gydF4y2Ba]. 人们越来越需要携带多个基因突变的植物来解剖具有冗余功能的基因家族成员的功能和分析遗传途径中的上位性关系。然而,目前产生携带多个突变基因的植物的方法需要对单个突变植物进行耗时费力的遗传杂交。此外,T-DNA插入突变体不能为每个感兴趣的基因获得。因此,植物基因组靶向需要廉价、高效和用户友好的新技术。gydF4y2Ba
特定基因组位点的双链断裂(DSBs)可以通过容易出错的非同源端连接(NHEJ)途径在DNA断裂位点引入突变。DSBs还可以通过HR途径导致染色体DNA和外源供体DNA之间的同源重组(HR) [gydF4y2Ba3.gydF4y2Ba].基于目标位点的dsb,序列特异性核酸酶,包括归巢巨核酶、锌指核酸酶和转录激活因子样效应(TALE)核酸酶已成为真核生物靶向基因组编辑的强大技术[gydF4y2Ba3.gydF4y2Ba].gydF4y2Ba
最近,另一项基于dsb的基因组编辑突破性技术CRISPR/Cas系统被开发出来[gydF4y2Ba4gydF4y2Ba],[gydF4y2Ba5gydF4y2Ba].该系统基于细菌和古细菌聚集的规则间隔短回文重复序列(CRISPR)适应性免疫系统,用于清除入侵的病毒和质粒DNA,依赖于CRISPR相关(Cas)蛋白的内切酶活性,由CRISPR rna (crRNAs)指导序列特异性[gydF4y2Ba6gydF4y2Ba]-[gydF4y2Ba11gydF4y2Ba].CRISPR/Cas系统被应用于多种生物中,它来源于gydF4y2Ba酿脓链球菌gydF4y2Ba由3个基因组成,其中1个编码Cas9核酸酶,2个非编码RNA基因:反式激活crRNA (tracrRNA)和前体crRNA (pre-crRNA)。可编程的pre-crRNA包含由相同的直接重复序列间隔的核酸酶引导序列(间隔),与tracrRNA一起加工成成熟的crRNA。这两个RNA基因可以被一个RNA基因取代,使用的是一种工程单引导RNA (gRNA),它包含一个设计的发夹,模仿crRNA-tracrRNA复合物。Cas9与目标DNA的结合特异性是由gRNA-DNA碱基对和靶区下游的一个原间隔区相邻基序(PAM,序列:NGG)决定的。Cas9的两个核酸酶结构域(HNH和RuvC-like)在同一位点(与PAM的三核苷酸[nt]距离)切割一条双链DNA,导致DSB [gydF4y2Ba8gydF4y2Ba]-[gydF4y2Ba11gydF4y2Ba].CRISPR/Cas系统已被用于实现多种生物体的高效基因组编辑,包括细菌、酵母、植物和动物,以及人类细胞系[gydF4y2Ba12gydF4y2Ba]-[gydF4y2Ba27gydF4y2Ba]. 更重要的是,利用这种RNA引导的核酸内切酶技术,实现了多种基因突变及其种系传递[gydF4y2Ba28gydF4y2Ba]-[gydF4y2Ba30.gydF4y2Ba].gydF4y2Ba
在脊椎动物,如斑马鱼、小鼠、大鼠和猴子中,共注射体外转录的gRNA和cas9编码的mRNA到单细胞阶段的胚胎中,可以有效地产生可高效地传递到下一代的多重双等位基因突变的动物[gydF4y2Ba18gydF4y2Ba],[gydF4y2Ba28gydF4y2Ba]-[gydF4y2Ba32gydF4y2Ba].然而,这种方法在植物中是不可行的,因为需要稳定表达CRISPR/Cas9系统的转基因株系来产生一个或多个基因突变的植物。gydF4y2Ba农杆菌属gydF4y2Ba-介导转化是产生转基因植物的常规方法,已经有一些二进制载体通过这种方法将CRISPR/Cas9系统导入植物基因组[gydF4y2Ba15gydF4y2Ba],[gydF4y2Ba20.gydF4y2Ba],[gydF4y2Ba23gydF4y2Ba],[gydF4y2Ba24gydF4y2Ba],[gydF4y2Ba33gydF4y2Ba]-[gydF4y2Ba40gydF4y2Ba].然而,为了加快该系统在多种植物物种正常或复杂条件下的应用(如T-DNA插入突变背景下的基因靶向突变),一个带有额外植物可选择标记、更多gRNA模块的工具包,通常需要更简单的方法来组装一个或多个gRNA表达盒,特别是针对多个基因的靶向突变。我们报道了这种工具包的开发,用于植物的多重基因组编辑。gydF4y2Ba
结果gydF4y2Ba
用于植物多重基因组编辑的CRISPR/Cas9二进制载体集和gRNA模块载体集gydF4y2Ba
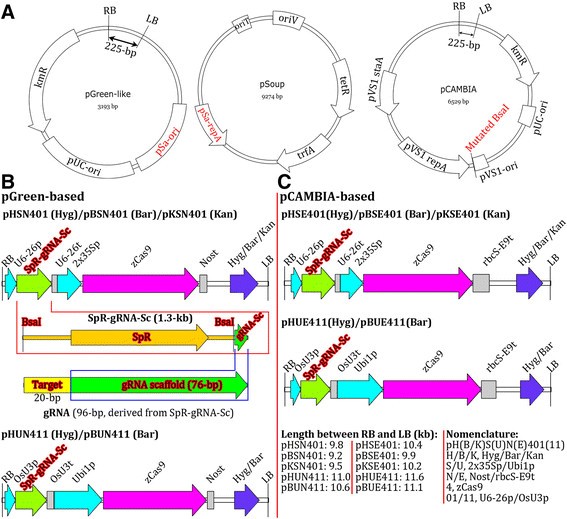
利用两种主干的二元向量;一种是基于pGreen的,另一种是基于pCAMBIA的。pGreen二进制向量是基于先前报道的策略构建的[gydF4y2Ba41gydF4y2Ba]. 类pGreen载体的优点是体积相对较小,可用于原生质体中Cas9和gRNA的瞬时表达,以检测靶位点的有效性。由于载体在原生质体中验证后可直接用于产生转基因植株,因此使用这种基于单一载体的策略瞬时和稳定表达CRISPR/Cas9可以节省时间、精力和金钱。在gydF4y2Ba农杆菌属gydF4y2Ba, pGreen-like载体的繁殖依赖于其pSa来源,它们需要一个辅助质粒提供复制蛋白(RepA)。gydF4y2Ba农杆菌属gydF4y2Ba含pSoup辅助质粒可作为pgreen类载体的宿主[gydF4y2Ba41gydF4y2Ba].在pcambia衍生的二元载体中,带有湿霉素抗性基因作为可选择标记的二元载体来自pCAMBIA1300,带有卡那霉素抗性基因的二元载体来自pCAMBIA2300,带有basta抗性基因的二元载体来自pCAMBIA3300。载体pCAMBIA1300/2300/3300及其衍生物(包括网关兼容的pMDC系列)是一些用于各种植物物种的最广泛的二进制载体[gydF4y2Ba42gydF4y2Ba],[gydF4y2Ba43gydF4y2Ba],一些植物转化方案已经在这些载体的基础上进行了特别优化。因此,基于pcambia的CRISPR/Cas9二进制载体的生成增强了这些载体与一些优化的植物转化协议和/或一些研究者的习惯或偏好的兼容性。每个pcambia衍生载体的一个重要改进是gydF4y2BaBsagydF4y2BaI位点在pVS1区域(这是质粒在gydF4y2Ba农杆菌属gydF4y2Ba)被打乱,以便使…得以使用gydF4y2BaBsagydF4y2BaI位点组装gRNA表达盒(图gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
CRISPR/Cas9二进制向量的物理映射和结构。(一)gydF4y2BapGreen和pCAMBIA骨架的物理图,CRISPR/Cas9二进制载体的来源。pGreen增殖所需的辅助质粒图谱gydF4y2Ba农杆菌属gydF4y2Ba而变异的gydF4y2BaBsagydF4y2Ba表明在pCAMBIA骨架上的I位点。LB/RB, T-DNA左/右边界;pSa-ori,用于复制gydF4y2Ba农杆菌属gydF4y2Ba用相应的复制蛋白(pSa-repA)进行工程;KmR,卡那霉素抗性基因;中复制所需的复制原点gydF4y2Ba大肠杆菌gydF4y2Ba;pVS1-staA、pVS1-ori和pVS1-rep是细胞内复制所需的DNA元件gydF4y2Ba农杆菌属gydF4y2Ba.只留下LB和RB之间的225-bp片段,用于比较pGreen和pCAMBIA骨干的大小。gydF4y2Ba(B, C)gydF4y2Ba给出了RB和LB之间区域的物理图,T-DNA区域的大小以及SpR-gRNA-Sc和最终工作gRNA的结构。gydF4y2BazCas9gydF4y2Ba,gydF4y2Ba玉米gydF4y2Bacodon-optimizedgydF4y2BaCas9gydF4y2Ba;U6-26p,gydF4y2Ba拟南芥U6gydF4y2Ba基因启动子;U6-26t,gydF4y2BaU6-26gydF4y2Ba带有下游序列的终止器;OsU3p、大米gydF4y2BaU3gydF4y2Ba启动子;OsU3t、大米gydF4y2BaU3gydF4y2Ba带有下游序列的终止器;SpR,大观霉素抗性基因;gRNA-Sc gRNA脚手架。gydF4y2Ba
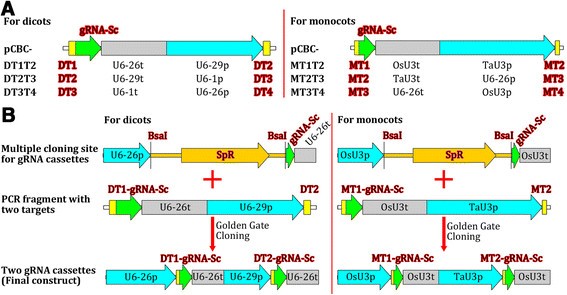
为了将多个gRNA整合到一个单二进制载体中进行多重基因组编辑,我们构建了6个gRNA模块载体,其中3个为双子叶设计,3个为单子叶设计(图)gydF4y2Ba2gydF4y2Ba).使用这些gRNA模块载体,可以很容易地使用金门克隆法组装两个到更多的gRNA表达盒[gydF4y2Ba44gydF4y2Ba],[gydF4y2Ba45gydF4y2Ba]或者吉布森装配法[gydF4y2Ba46gydF4y2Ba].通过使用更合适的Pol III启动子,可以构建额外的gRNA模块来组装更多的gRNA表达盒。因此,gRNA模块向量集具有可扩展性,易于更新。gydF4y2Ba
预制的gRNA模块用于组装2到4个gRNA表达盒。(一)gydF4y2Ba双子叶植物和单子叶植物的gRNA表达模块。U6-29p、U6-26p和U6-1p是三个gydF4y2Ba拟南芥U6gydF4y2Ba基因启动子;对应U6-29t、U6-26t、U6-1tgydF4y2Ba拟南芥U6gydF4y2Ba带有下游序列的基因终止子;OsU3p和TaU3p,水稻和小麦gydF4y2BaU3gydF4y2Ba分别启动子;OsU3t和TaU3t,水稻和小麦gydF4y2BaU3gydF4y2Ba分别具有下游序列的终止子;gRNA-Sc gRNA脚手架;DT1/2/3/4,双子叶植物target-1/2/3/4;MT1/2/3/4,单子叶植物target-1/2/3/4。载体pCBC是将gRNA模块分别插入的克隆载体。gydF4y2Ba(B)gydF4y2Ba使用gRNA模块组装双子叶和单子叶双gRNA表达盒的例子。注:每个PCR片段的两侧有两个gydF4y2BaBsagydF4y2BaI站点(没有显示)。gydF4y2Ba
CRISPR/Cas9工具箱在玉米原生质体中的验证gydF4y2Ba
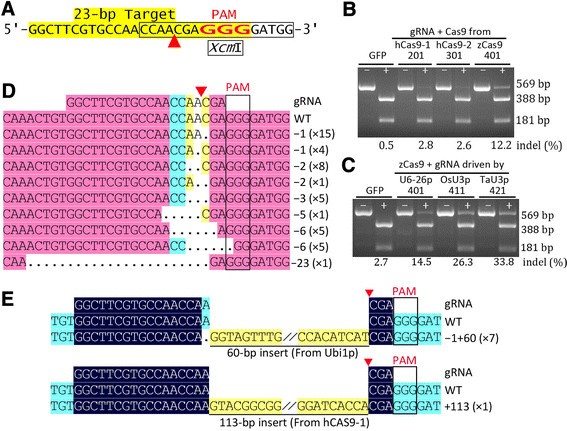
验证了工具箱的有效性,并比较了不同的突变效率gydF4y2BaCas9gydF4y2Ba或用于驱动gRNAs的Pol III启动子,我们生成了两套针对相同玉米基因组DNA位点(gydF4y2BaZmHKT1型gydF4y2Ba).一套由pBUN201-ZT1、pBUN301-ZT1、pBUN401-ZT1组成,各有不同gydF4y2BaCas9gydF4y2Ba序列,包括gydF4y2BahCas9-NLS-3×国旗gydF4y2Ba在pBUN201-ZT1,gydF4y2Ba3×FLAG-NLS-hCas9-NLSgydF4y2Ba在pBUN301-ZT1和gydF4y2Ba3×FLAG-NLS-zCas9-NLSgydF4y2Ba在pBUN401-ZT1。的gydF4y2BahCas9gydF4y2Ba和gydF4y2BazCas9gydF4y2Ba序列是人类密码子和gydF4y2Ba玉米gydF4y2Ba密码子优化gydF4y2BaCas9,gydF4y2Ba分别。另一组包括pBUN401-ZT1、pBUN411-ZT1和pBUN421-ZT1。这些载体的不同在于用于驱动gRNA的Pol III启动子:pBUN401-ZT1中的AtU6-26p, pBUN411-ZT1中的OsU3p和pBUN421-ZT1中的TaU3p。gydF4y2Ba
对于目标站点gydF4y2BaZT1gydF4y2Ba,检测突变等位基因gydF4y2BaXcm公司gydF4y2BaI对推测裂解位点周围PCR片段的消化(图gydF4y2Ba3.gydF4y2Ba一个)。gydF4y2BaXcm公司gydF4y2Ba我分析表明,玉米密码子优化gydF4y2BaCas9gydF4y2Ba比两种人类密码子优化的表现要好得多gydF4y2BaCas9gydF4y2Ba基因(图gydF4y2Ba3.gydF4y2BaB)。gydF4y2BaTaU3gydF4y2Ba启动子的表现略好于gydF4y2BaOsU3公司gydF4y2Ba发起人和gydF4y2BaOsU3公司gydF4y2Ba启动子的表现远好于gydF4y2BaAtU6-26gydF4y2Ba启动子(图gydF4y2Ba3.gydF4y2BaC)。gydF4y2Ba
玉米密码子优化的Cas9和三个Pol-III启动子驱动玉米原生质体gRNA表达的验证。(一)gydF4y2BaZm上目标部位的序列gydF4y2BaHKT1gydF4y2Ba轨迹。PAM,假定的卵裂位点(红色箭头),以及gydF4y2BaXcm公司gydF4y2BaI表示站点(装箱)。gydF4y2Ba(B, C)gydF4y2Ba突变分析gydF4y2BaXcm公司gydF4y2BaPCR片段的消化。Gfp 201 301 401gydF4y2Ba(B)gydF4y2Ba:分别转染pucc - gfp(对照)、pBUN201-ZT1、pBUN301-ZT1和pBUN401-ZT1的玉米原生质体基因组DNA扩增片段。这三个CRISPR/Cas9载体的gRNA相同但不同gydF4y2BaCas9gydF4y2Ba:gydF4y2BahCas9-1gydF4y2Ba/gydF4y2Ba2gydF4y2Ba,人类密码子优化的两种类型gydF4y2BaCas9gydF4y2Ba;gydF4y2BazCas9gydF4y2Ba,gydF4y2Ba玉米gydF4y2Bacodon-optimizedgydF4y2BaCas9gydF4y2Ba.Gfp, 401, 411, 421gydF4y2Ba(C)gydF4y2Ba:分别来自pUC-GFP、pBUN401-ZT1、pBUN411-ZT1和pBUN421-ZT1转染的PCR片段;三个CRISPR/Cas9载体具有相同的zgydF4y2BaCas9gydF4y2Ba和gRNA,但gRNA是由三种不同的Pol-III启动子驱动的。−和+表示PCR片段是否用酶切gydF4y2BaXcm公司gydF4y2BaI.突变效率(% indel)根据残留的PCR未消化片段(+ lanes: 569 bp)与总PCR产物(−lanes)的百分比计算;WT indel值应被视为背景级别。gydF4y2Ba(D, E)gydF4y2Ba从克隆的PCR片段中鉴定的突变等位基因序列的比对gydF4y2BaXcm公司gydF4y2Ba我消化。突变等位基因包括缺失gydF4y2Ba(D)gydF4y2Ba和插入gydF4y2Ba(E)gydF4y2Ba.点、删除基地。高亮显示表示对齐片段的同源程度,只显示感兴趣的对齐区域。说明了indel的类型和相同类型的indel的数量。gydF4y2Ba
为了验证突变事件,我们克隆了PCR产物,并通过克隆PCR和PCR技术对产生的克隆进行了筛选gydF4y2BaXcm公司gydF4y2Ba我消化菌落PCR产物。克隆PCR产物具有抗性的克隆的DNAgydF4y2BaXcm公司gydF4y2BaI消化被测序(图gydF4y2Ba3.gydF4y2Ba有趣的是,我们获得了8个插入突变,其中一个来自gydF4y2BahCas9gydF4y2Ba其中7个来自于泛素启动子,它们可能来自于降解的载体而不是玉米基因组(图)gydF4y2Ba3.gydF4y2BaE).这些结果表明当提供供体基因时,靶向整合的效率相对较高。gydF4y2Ba
CRISPR/Cas9工具箱在转基因玉米中的验证gydF4y2Ba
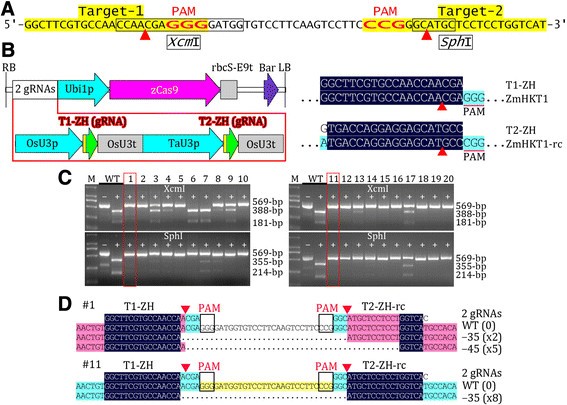
为了检测该工具在单子叶上的靶向突变效率,我们构建了一个pcambia衍生的CRISPR/Cas9二进制载体,该载体包含两个针对同一玉米基因相邻位点的gRNA表达盒,gydF4y2BaZmHKT1型gydF4y2Ba(图gydF4y2Ba4gydF4y2BaA、 (B)。我们通过限制性酶切跨越两个靶位点的PCR片段分析了20个T0转基因株系,发现超过60%的转基因株系对两个靶位点的突变效率约为100%(图gydF4y2Ba4gydF4y2BaC).我们克隆并测序了两个株系的PCR片段,突变效率约为100%,发现两个目标位点之间的序列被删除,如图所示gydF4y2Ba4gydF4y2BaD这些结果表明,该工具包可用于玉米和其他作物的高效靶向突变。gydF4y2Ba
通过玉米基因的目标突变验证该工具包。(一)gydF4y2Ba一个玉米产区的序列gydF4y2BaZmHKT1型gydF4y2Ba显示了两个目标位置。gydF4y2Ba(B)gydF4y2Ba携带双grna表达盒的T-DNA物理图谱。显示了gRNA与其靶基因的比对结果。只显示感兴趣的对齐区域。rc,反补。gydF4y2Ba(C)gydF4y2Ba对20个T0转基因株系进行了突变分析gydF4y2BaXcm公司gydF4y2Ba我或gydF4y2BaSphgydF4y2BaPCR片段的消化。用于测序分析的线用方框表示。gydF4y2Ba(D)gydF4y2Ba从两个具有代表性的T0转基因系克隆的PCR片段中鉴定的突变等位基因序列的比对。突出显示表示对齐片段的同源程度,仅显示对齐的感兴趣区域。表示相同类型的索引数。gydF4y2Ba
验证的CRISPR/Cas9工具包gydF4y2Ba拟南芥gydF4y2Ba用于产生多基因突变的突变体gydF4y2Ba
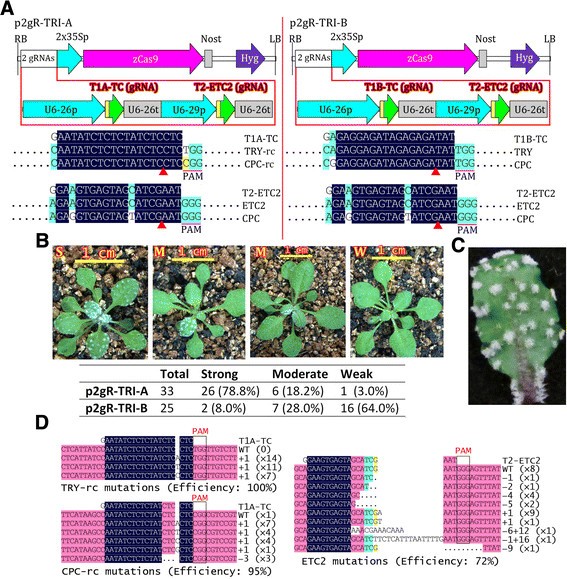
两个向量p2gr - tria和p2gr - trib(图gydF4y2Ba5gydF4y2BaA),每个携带两个gRNAs靶向3个与毛状体发育相关的基因,用于转化gydF4y2Ba拟南芥gydF4y2Ba.这两个载体含有相同的gRNA (T2-ETC2),它们是靶向的gydF4y2BaETC2gydF4y2Ba并有可能gydF4y2Ba中国共产党gydF4y2Ba,一个不太有利的目标(图gydF4y2Ba5gydF4y2BaA).载体也含有不同的gRNAs (T1A-TC或T1B-TC)。T1A-TC中18 bp的靶序列与T1B-TC中18 bp的靶序列是反向互补的。T1A-TC和T1B-TC都靶向相同的两个基因:gydF4y2Ba试一试gydF4y2Ba和gydF4y2Ba中国共产党gydF4y2Ba(图gydF4y2Ba5gydF4y2BaA). T1A-TC gRNA的20-nt靶点与gydF4y2Ba试一试gydF4y2Ba或gydF4y2Ba中国共产党gydF4y2BaT1B-TC与gydF4y2Ba试一试gydF4y2Ba,而T1B-TC与gydF4y2Ba中国共产党gydF4y2Ba(图gydF4y2Ba5gydF4y2BaA).对于p2gr - tria,超过70%的T1转基因植株显示高度丛生的毛状体(图)gydF4y2Ba5gydF4y2BaB,C) as expected forgydF4y2Ba试着中国共产党gydF4y2Ba两倍或gydF4y2Ba试着共产党etc2gydF4y2Ba三重突变植物[gydF4y2Ba47gydF4y2Ba].对于p2gR-TRI-B,只有不到10%的植株表现出预期的表型,说明T1B-TC的表现水平远低于T1A-TC。对p2gR-TRI-B T1转基因株系的突变等位基因进行测序,结果表明,尽管p2gR-TRI-B T1转基因株系的突变效率较高gydF4y2Ba试一试gydF4y2Ba等位基因占90%以上gydF4y2Ba中国共产党gydF4y2Ba同样的T1B-TC gRNA仅占42%(附加文件)gydF4y2Ba1gydF4y2Ba:图S1)。相比之下,两个gydF4y2Ba中国共产党gydF4y2Ba和gydF4y2Ba试一试gydF4y2Ba被相同T1A-TC靶向的gRNA具有相似的突变频率(大于90%),尽管两个靶点之间存在不同的PAMs(图)gydF4y2Ba5gydF4y2BaA, D)。这些结果表明,这两个错配可能解释了T1B-TC表现不佳的原因,尽管这两个错配位于gRNA的5’端。T2-ETC2 gRNA的20-nt靶序列与靶基因发生3次错配时gydF4y2Ba中国共产党gydF4y2Ba(图gydF4y2Ba5gydF4y2BaA),在p2gR-TRI-A转基因系的100多个克隆中没有检测到突变。相比之下,gydF4y2BaETC2gydF4y2Ba相同T2-ETC2的gRNA突变效率为72%(图gydF4y2Ba5gydF4y2BaD) 是的。这些结果表明gydF4y2Ba在足底gydF4y2Ba, CRISPR/Cas9系统具有较高的序列特异性,两次或两次以上的错配会大大降低靶向效率和脱靶效应,特别是当错配位于gRNA的20-nt靶点3 '端附近时。gydF4y2Ba
中对CRISPR/Cas工具包的验证gydF4y2Ba拟南芥gydF4y2Ba.(一)gydF4y2Ba两个pgreen衍生CRISPR/Cas9二元载体的t - dna物理图谱,每个载体携带两个靶向三个的grnasgydF4y2Ba拟南芥gydF4y2Ba基因(gydF4y2Ba试一试gydF4y2Ba,gydF4y2Ba中国共产党gydF4y2Ba和gydF4y2BaETC2gydF4y2Ba).gRNA与其目的基因的比对结果显示。只显示感兴趣的对齐区域。rc,反补。gydF4y2Ba(B)gydF4y2Bap2gr - tria T1转基因株系的代表性表型。S,与的强表型相似gydF4y2Ba试着共产党etc2gydF4y2Ba三重突变体,在叶片和叶柄上具高度丛生的毛状体;M,中度表型,部分叶片或部分叶片显示的表现型gydF4y2Ba试着中国共产党gydF4y2Ba双突变体或三突变体;W,弱或无突变表型的植物。图中显示T1转基因植株总数,T1转基因植株表现为强、中、弱三种表型的植株数,以及占总数的百分比(括号内)。T0种子在潮霉素MS平板上筛选13 d,在土壤中生长10 d后拍照。gydF4y2Ba(C)gydF4y2Ba在叶柄上显示高度丛生的毛状体的离体叶的放大图象,这是类似的表现型gydF4y2Ba试着共产党etc2gydF4y2Ba三突变体。gydF4y2Ba(D)gydF4y2Ba具有代表性的p2gR-TRI-A系靶基因突变序列分析。点、删除基地。高亮显示表示对齐片段的同源程度。说明了indel的类型和相同类型的indel的数量。gydF4y2Ba
在一株转基因植物中有许多不同的突变等位基因(图)gydF4y2Ba5gydF4y2BaD),这表明CRISPR/Cas9在受精卵分裂后起作用。为了证实这些突变在T2植株中传递的可能性,我们检测了5个表型较强的p2gR-TRI-A T1转基因株系的突变传递。由于Cas9和gRNA在T2转基因株系中组成性表达,有时很难确定突变的来源,这些突变可能来自生殖细胞或体细胞。相反,T2分离的非转基因植株的突变必须是T1突变的种系传递的结果。因此,我们将重点放在分离的非转基因T2植株上,以简化突变的种系传递分析。用3对引物对非转基因植株进行PCR反选择,其中2对抗潮霉素基因,1对抗潮霉素基因gydF4y2BaCas9gydF4y2Ba.我们确定了两者的双等位基因突变gydF4y2Ba试一试gydF4y2Ba和gydF4y2Ba中国共产党gydF4y2Ba根据他们聚集的毛状体表型,发现gydF4y2Ba试一试gydF4y2Ba和gydF4y2Ba中国共产党gydF4y2Ba将突变高效传递至T2植株;5个T1系的非转基因T2植株分别为46.2%、100%、82.6%、100%和100%的双等位突变体gydF4y2Ba试一试gydF4y2Ba和gydF4y2Ba中国共产党gydF4y2Ba(表gydF4y2Ba1gydF4y2Ba).我们首先分析了gydF4y2BaETC2gydF4y2Ba对非转基因T2双突变株的突变进行PCR直接测序或对包含PCR产物的不同克隆的DNA测序,然后进行分析gydF4y2Ba试一试gydF4y2Ba和gydF4y2Ba中国共产党gydF4y2Ba突变的gydF4y2Baetc2gydF4y2Ba突变体在分析的第一步被证实(表gydF4y2Ba2gydF4y2Ba).我们发现证实了gydF4y2Ba试着共产党etc2gydF4y2Ba三种突变体很容易被区分开来gydF4y2Ba试着中国共产党gydF4y2Ba双突变体;前者比后者短,叶片向上卷曲(图)gydF4y2Ba6gydF4y2Ba).双等位T2突变体gydF4y2BaETC2gydF4y2Ba在检测的5个品系中,只有2个T1品系分离(表gydF4y2Ba1gydF4y2Ba),证明了种系传递的频率gydF4y2BaETC2gydF4y2BaT2植株的突变量明显低于T2植株gydF4y2Ba试一试gydF4y2Ba和gydF4y2Ba中国共产党gydF4y2Ba突变。这一结果可以用基因突变频率较低来解释gydF4y2BaETC2gydF4y2Ba在T1植物。gydF4y2Ba
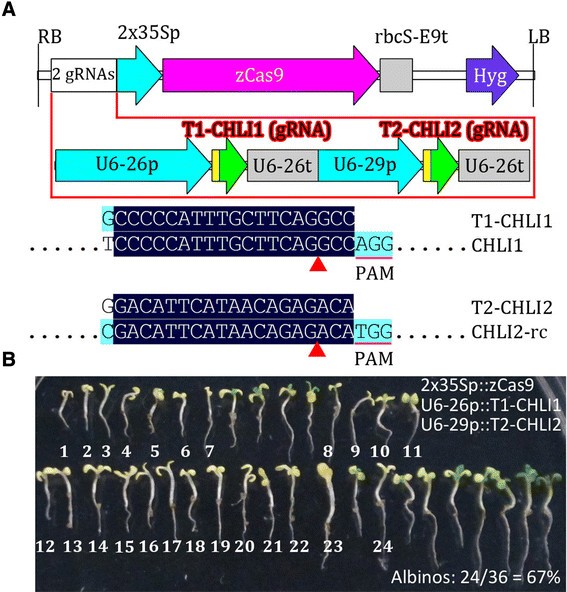
中进一步验证工具箱gydF4y2Ba拟南芥gydF4y2Ba,我们构建了基于pcambia的载体pHSE-2gR-CHLI,携带两个靶向grnagydF4y2BaCHLI1gydF4y2Ba和gydF4y2BaCHLI2gydF4y2Ba(图gydF4y2Ba7gydF4y2Ba),与先前研究中使用的GRNA相同[gydF4y2Ba22gydF4y2Ba].同时中断的gydF4y2BaCHLI1gydF4y2Ba和gydF4y2BaCHLI2gydF4y2Ba导致了白化表型,而gydF4y2Bachli1gydF4y2Ba或gydF4y2Bachli2gydF4y2Ba单个突变体显示浅绿色表型[gydF4y2Ba48gydF4y2Ba].T1转基因比例较高gydF4y2Ba拟南芥gydF4y2Ba幼苗表现出白化表型(24/36 = 67%),比之前报道的(23/60 = 38%),进一步证明该工具包的效果良好gydF4y2Ba拟南芥gydF4y2Ba.通过使用两个或多个gRNAs靶向同一基因的两个或多个靶位点,可以进一步提高突变频率。随着突变效率的提高,体细胞突变可以更有效地传递给下一代。因此,本研究开发的工具包可用于生成gydF4y2Ba拟南芥gydF4y2Ba具有高水平效率和特异性的突变体。gydF4y2Ba
pcambia衍生CRISPR/Cas二进制载体的验证gydF4y2Ba拟南芥gydF4y2Ba.(一)gydF4y2BapCAMBIA衍生载体的T-DNA物理图谱,该载体携带两个靶向两个的gRNAsgydF4y2Ba拟南芥gydF4y2Ba基因(gydF4y2BaCHLI1gydF4y2Ba和gydF4y2BaCHLI2gydF4y2Ba).gRNA与其目的基因的比对结果显示。只显示感兴趣的对齐区域。rc,反补。gydF4y2Ba(B)gydF4y2Ba通过一次筛选获得所有转基因幼苗的表型。T0种子在潮霉素质谱板上筛选7 d,所有抗潮霉素的幼苗移入新鲜质谱板后拍照。对白化苗进行了编号。gydF4y2Ba
讨论gydF4y2Ba
分析具有冗余功能的基因家族成员的功能和分析遗传途径中的上位性关系,往往需要植物突变体具有多基因突变。最近开发的CRISPR/Cas9系统为基因组编辑提供了一种很好的方法[gydF4y2Ba4gydF4y2Ba],[gydF4y2Ba9gydF4y2Ba],[gydF4y2Ba21gydF4y2Ba]. 然而,为了在植物中产生多个基因突变,常常需要用于组装多个gRNA表达盒的资源和方法。在本报告中,我们描述了用于生成gRNA模块和使用预制gRNA模块组装多个gRNA表达盒的方法。这些资源包括二进制载体和gRNA模块载体,能够满足在正常或复杂条件下用于各种植物的大多数要求。这些方法还允许研究人员定制自己的gRNA模块,并组装多个gRNA表达盒进行多重基因组编辑。利用该试剂盒,我们发现CRISPR/Cas9可以同时敲除多个植物基因,根据经济学中的桶效应理论,多个基因突变的效率取决于目标基因的最低突变效率。gydF4y2Ba
在植物中使用CRISPR/Cas9需要二进制载体。为了将20bp的目标序列融合到gRNA支架的5’端,最好使用IIs型限制性内切酶。虽然有一些IIs型限制性内切酶,比如gydF4y2BaAragydF4y2Ba我,gydF4y2Ba论坛gydF4y2Ba我/gydF4y2BaBpigydF4y2Ba我,gydF4y2BaBsagydF4y2Ba我/gydF4y2Ba生态gydF4y2Ba31日我gydF4y2BaBsmgydF4y2BaBI /gydF4y2BaEspgydF4y2Ba3,我gydF4y2BaBspgydF4y2BaMI /gydF4y2BaBfugydF4y2BaAI /gydF4y2BaBvegydF4y2Ba我和gydF4y2BaBtggydF4y2BaZI是商业上可以买到的,很少有这样的酶可以用来线性化常用的二进制向量,如pCAMBIA系列和pPZP系列向量[gydF4y2Ba43gydF4y2Ba],[gydF4y2Ba49gydF4y2Ba],因为在这些带菌者的骨干中存在一个或多个位点。例如,不包括T-DNA区域,pCAMBIA主链包含一个gydF4y2BaBsagydF4y2Ba我,两个gydF4y2Ba论坛gydF4y2Ba我,两个gydF4y2BaBsmgydF4y2BaBI,两个gydF4y2BaBspgydF4y2Ba米,还有四个gydF4y2BaBtggydF4y2Ba子站点。虽然没有gydF4y2BaAargydF4y2BaI位点可以在pCAMBIA骨干中找到,有一个gydF4y2BaAargydF4y2Ba我的网站在gydF4y2Ba酒吧gydF4y2BaPCA3300 T-DNA区域的选择标记基因。幸运的是,尽管gydF4y2BaBsagydF4y2BaI位点位于pVS1复制区域,这是质粒在gydF4y2Ba农杆菌属gydF4y2Ba,没有gydF4y2BaBsagydF4y2BaI位点在常用元素中,如双启动子等gydF4y2BaCaMV 35 sgydF4y2Ba启动子和gydF4y2BaUbi1gydF4y2Ba启动子,或在可选择的标记包括gydF4y2Ba菅直人gydF4y2Ba,gydF4y2BaHyggydF4y2Ba和gydF4y2Ba酒吧gydF4y2Ba.此外,gydF4y2BaBsagydF4y2BaI是最便宜的常用II型限制酶。例如,每个活动单元的价格gydF4y2BaBsagydF4y2Ba我/gydF4y2Ba生态gydF4y2Ba31I仅约为gydF4y2BaAargydF4y2Ba我(Thermo Fisher Scientific and New England Biolabs)。利用gydF4y2BaBsagydF4y2Ba为了将gRNA表达盒组装到pCAMBIA二元载体中,我们破坏了gydF4y2BaBsagydF4y2BapVS1区域的I位。因此,对于我们开发的二进制向量集,没有限制性内切酶但是gydF4y2BaBsagydF4y2BaI是一个或多个gRNAs组装所必需的。gydF4y2Ba
该工具包提供了生成植物CRISPR/Cas9二进制向量的最简单方法。当构建携带1个或2个gRNAs的二元载体时,只需要两个23-nt合成寡聚物(退火到插入物上)或一个PCR片段,以及本报告中描述的任何一个二元载体,就可以建立金门反应。构建携带多个gRNAs的二元载体时,需要两个或多个PCR片段。基于金门克隆法[gydF4y2Ba45gydF4y2Ba]或吉布森装配[gydF4y2Ba46gydF4y2Ba],两个或更多的PCR片段可以很容易地组装成多个gRNA表达盒到任何一个gydF4y2BaBsagydF4y2Bai -线性化二进制向量只需要一个克隆步骤。两种策略可用于组装超过4个gRNA表达盒,即生成更多的gRNA模块,并添加额外的经过验证的Pol III启动子,并将包含大镜霉素耐药基因的gRNA表达盒(第二次)插入已经包含4个gRNA的二进制载体中,然后将额外的gRNA组装到gydF4y2BaBsagydF4y2Ba线性化向量。因此,与gRNA模块向量集组合的二元向量集包括高效、廉价、省时、用户友好、多方面、可扩展的工具包,用于生成携带一个或多个用于多基因靶向突变的gRNAs的CRISPR/Cas9二元向量。gydF4y2Ba
结论gydF4y2Ba
我们开发了一个基于CRISPR/ cas9的二进制向量集和一个gRNA模块向量集,作为植物多重基因组编辑的工具包。我们利用玉米原生质体、玉米转基因株系和玉米种子对试剂盒进行了验证gydF4y2Ba拟南芥gydF4y2Ba结果表明,该转基因株系具有较高的效率和特异性。结合gRNA模块向量集的二进制向量集组成了一个高效、廉价、省时、用户友好、多面、可扩展的工具包,用于生成携带一个或多个gRNAs的CRISPR/Cas9二进制向量,用于多种植物基因的靶向突变。该工具包有助于CRISPR/Cas9在多种植物系统中进行短暂或稳定的表达,可应用于多种植物,尤其适用于高效生成携带多基因突变的突变体。gydF4y2Ba
方法gydF4y2Ba
向量构造gydF4y2Ba
附加文件中提供了矢量构造的详细描述gydF4y2Ba2gydF4y2BaS1:方法。本报告中使用的所有引物都列在附加文件中gydF4y2Ba1gydF4y2BaS1:表。gydF4y2Ba
金门方法构造一个表示一个或两个grna的向量gydF4y2Ba
为了组装一个gRNA,将100 μmol/L的寡聚物1和2等体积混合,在65℃下孵育5分钟,慢慢冷却至室温,得到两端有4-nt 5 '伸出的双链插入物。为了组装两个gRNAs,将两个目标位点分别纳入PCR正、反向引物中。双子叶靶点pCBC-DT1T2和单子叶靶点pCBC-MT1T2扩增片段,分别采用2条较长的引物或4条较短的引物,其中2条正向引物或2条反向引物部分重叠。插入物或纯化的PCR片段(T1T2-PCR),连同本报告中描述的任何一个二进制载体,用于建立限制性连接反应,如别处所述[gydF4y2Ba44gydF4y2Ba),用gydF4y2BaBsagydF4y2BaI和T4连接酶(新英格兰生物实验室)。将反应物在37℃下在热循环器中培养5小时,在50℃下培养5分钟,在80℃下培养10分钟。包括gRNA模块序列、PCR引物、菌落PCR引物和测序引物在内的详细信息可在附加文件中找到gydF4y2Ba3.gydF4y2BaS2:方法。gydF4y2Ba
采用金门克隆或Gibson组装方法生成表达3或4个gRNAs的载体gydF4y2Ba
有两种方法组装了三个以上的grna:金门克隆[gydF4y2Ba45gydF4y2Ba]及吉布森装配[gydF4y2Ba46gydF4y2Ba].在Golden Gate克隆中,纯化两个(T1-PCR和T2T3-PCR2)或三个(T1-PCR、T2-PCR和T3T4-PCR2) PCR片段,并与任何一个CRISPR/Cas9二进制载体混合,建立如上所述的Golden Gate反应。Gibson Assembly将两个(T1T2-PCR和T2T3-PCR)或三个(T1T2-PCR、T2T3-PCR和T3T4-PCR) PCR片段纯化后,与Gibson Assembly Master Mix (New England Biolabs)混合,根据制造商的方案建立反应。凝胶纯化所需大小的片段,作为第二轮PCR扩增的模板。第二轮PCR产物被纯化,并与本报告中描述的任何一种二进制载体混合,建立如上所述的金门反应。详细信息包括gRNA模块序列,PCR引物,菌落PCR引物,测序引物可以在附加文件中找到gydF4y2Ba4gydF4y2Ba:方法S3和附加文件gydF4y2Ba5gydF4y2Ba: S4的方法。融合PCR方法也用于组装超过三个gRNAs;然而,由于持续的非特异性扩增,第二轮PCR的效率有时大大降低。gydF4y2Ba
玉米原生质体的分离与转染gydF4y2Ba
将B73玉米种子浸泡在无菌水中过夜,播种于土壤中,在22℃的生长室中进行16小时光照/8小时黑暗循环4-6天。根据先前描述的方法,从20-30个幼苗的茎和鞘中提取组织用于原生质体分离[gydF4y2Ba50gydF4y2Ba],进行一次修饰,即以100 ×离心的方式收集原生质体微球gydF4y2BaggydF4y2Ba如前所述进行PEG介导的转染3分钟[gydF4y2Ba50gydF4y2Ba].每个样品10 ~ 15 μg质粒DNA与200 μL原生质体(约2 × 10)混合gydF4y2Ba5gydF4y2Ba细胞)。加入新鲜配制的PEG溶液(200 μL),室温避光培养10-20 min。然后加入800 μL W5溶液混合,100 ×离心成球gydF4y2BaggydF4y2Ba将原生质体重悬于1.5 mL W5溶液中,100 ×离心成球gydF4y2BaggydF4y2Ba将原生质体重悬于800 μL W5溶液中,22°C避光培养14 ~ 16 h。每个质粒转染3个重复。gydF4y2Ba
玉米原生质体突变的验证gydF4y2Ba
从同一载体中获得三个转染的原生质体样本,并提取基因组DNA。用巢式PCR从基因组DNA中扩增出包含CRISPR目标位点的DNA片段,该DNA片段由两对基因特异性引物ZT-IDF0/-IDR0和ZT-IDF/-IDR扩增而来(附加文件gydF4y2Ba1gydF4y2Ba:表S1)。对于突变的限制性内切酶切分析,每个PCR产物建立两个限制性内切酶反应:在一个反应中加入相应的限制性内切酶;在另一个反应中,用水代替酶作为阴性对照。在20μL的反应中,将每个反应得到的约500 ng纯化PCR产物消化过夜。与对照组一起,在2.0%溴化乙锭染色的琼脂糖凝胶上分离消化的DNA。将纯化后的PCR产物克隆到克隆载体pCBC中,经克隆PCR和限制性内切酶切鉴定转化子。一些限制酶,如gydF4y2BaXcm公司gydF4y2Ba我和gydF4y2BaSphgydF4y2Ba我,有活动gydF4y2Ba塔克gydF4y2Ba聚合酶链反应混合物。PCR结束后,将酶添加到PCR混合物中过夜消化,然后进行琼脂糖凝胶电泳分析。使用T7引物对耐消化片段进行测序。gydF4y2Ba
转基因玉米的产生及突变分析gydF4y2Ba
将CRISPR/Cas9二进制载体pBUE-2gRNA-ZH转化为gydF4y2Ba农杆菌属gydF4y2Ba应变EHA105,gydF4y2Ba农杆菌属gydF4y2Ba在中国农业大学转基因设施中心对B73玉米未成熟胚进行了-介导法转化。从20株转基因幼苗中提取基因组DNA, PCR片段、引物和反应与上述相同。在限制性酶切分析中,每个反应约500 ng纯化的PCR产物用酶切过夜gydF4y2BaXcm公司gydF4y2Ba我或gydF4y2BaSphgydF4y2BaI在20 μ l的反应体积。将2株具有代表性的转基因苗的PCR产物克隆到克隆载体pCBC中,用T7引物对阳性克隆进行测序分析。gydF4y2Ba
代的转基因gydF4y2Ba拟南芥gydF4y2Ba植物和突变分析gydF4y2Ba
将p2gR-TRI-A和p2gR-TRI-B载体转化为gydF4y2Ba农杆菌属gydF4y2Ba菌株GV3101/pSoup采用冻融法转化,而pHSE-2gR-CHLI转化gydF4y2Ba农杆菌属gydF4y2Ba应变GV3101。gydF4y2Ba拟南芥gydF4y2Ba以Col-0野生型植物为材料,采用花浸法进行转化。采集到的种子在含有25 mg/L潮霉素的MS平板上进行筛选。从土壤中种植的T1转基因植物中提取基因组DNA。采用基因特异性引物TRY-IDF/R、CPC-IDF/R和ETC2-IDF/R进行PCR扩增目标位点周围的片段(附加文件gydF4y2Ba1gydF4y2Ba:表S1)。将纯化后的PCR产物克隆到克隆载体pCBC中,用T7引物对每个PCR片段的阳性克隆DNA进行测序,鉴定突变。为筛选分离的非转基因T2植株,从土壤中培养的T2植株中提取基因组DNA。以野生型基因组DNA为阴性对照,T1转基因植株基因组DNA为阳性对照,采用3对引物(Hyg-IDF/R、Hyg-IDF2/R2、zCas9-IDF/R)进行反选择PCRgydF4y2BazCas9gydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba:表S1)。分析非转基因T2植株的突变,将靶位点周围的片段gydF4y2Ba试一试gydF4y2Ba,gydF4y2Ba中国共产党gydF4y2Ba或gydF4y2BaETC2gydF4y2Ba采用基因特异性引物TRY-IDF0/R0、CPC-IDF0/R0和ETC2-IDF0/R0进行PCR扩增(附加文件gydF4y2Ba1gydF4y2Ba:表S1)。纯化的PCR产物提交测序,测序引物(TRY/CPC/ETC2-seqF)位于PCR片段内(附加文件gydF4y2Ba1gydF4y2Ba:表S1)。测序不良的PCR产物克隆到克隆载体pCBC中,阳性克隆的DNA用T7引物测序。gydF4y2Ba
其他文件gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
在拟南芥中,T-DNA作为插入突变体。植物学报,1999,11:2283-2290。10.1105 / tpc.11.12.2283。gydF4y2Ba
- 2.gydF4y2Ba
Jeon JS, Lee S, Jung h, Jun SH, Jeong DH, Lee J, Kim C, Jang S, Yang K, Nam J, An K, Han MJ, Sung RJ, Choi HS, Yu JH, Choi JH, Cho SY, Cha SS, Kim SI, An G:水稻功能基因组的T-DNA插入突变。植物学报,2000,22:531 - 531。10.1046 / j.1365 - 313 x.2000.00767.x。gydF4y2Ba
- 3.gydF4y2Ba
Gaj T,Gersbach CA,Barbas CF:基于ZFN,TALEN和CRISPR/Cas的基因组工程方法。生物技术趋势。2013年,31:397-405.10.1016/j.tibtech.2013.04.004。gydF4y2Ba
- 4.gydF4y2Ba
潘尼斯:脆的狂热。科学。2013年,341:833-836.10.1126/science.341.6148.833。gydF4y2Ba
- 5.gydF4y2Ba
细菌预示着基因编辑新时代的到来。Elife. 2013, 2: e00563-10.7554/ Elife. 00563。gydF4y2Ba
- 6.gydF4y2Ba
Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S, Romero DA, Horvath P: CRISPR为原核生物提供了获得性抵抗病毒的能力。科学出版社。10.1126 / science.1138140。gydF4y2Ba
- 7.gydF4y2Ba
Horvath P, Barrangou R: CRISPR/Cas,细菌和古细菌免疫系统。科学,2010,327:167-170。10.1126 / science.1179555。gydF4y2Ba
- 8.gydF4y2Ba
Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E:一种可编程的双rna引导DNA内切酶在适应性细菌免疫中的作用。科学出版社,2012。10.1126 / science.1225829。gydF4y2Ba
- 9.gydF4y2Ba
Jinek M, Jiang F, Taylor DW, Sternberg SH, Kaya E, Ma E, Anders C, Hauer M, Zhou K, Lin S, Kaplan M, Iavarone AT, Charpentier E, Nogales E, Doudna JA: Cas9内切酶的结构揭示了rna介导的构像激活。科学通报。2014,343:1247997-10.1126/科学。gydF4y2Ba
- 10.gydF4y2Ba
Nishimasu H, Ran FA, Hsu PD, Konermann S, Shehata SI, Dohmae N, Ishitani R, Zhang F, Nureki O: Cas9 in complex with guide RNA and target DNA的晶体结构。细胞。2014,156:935-949。10.1016 / j.cell.2014.02.001。gydF4y2Ba
- 11.gydF4y2Ba
Sternberg SH, Redding S, Jinek M, Greene EC, Doudna JA: CRISPR rna引导的内切酶Cas9的DNA询问。《自然》,2014,507:62-67。10.1038 / nature13011。gydF4y2Ba
- 12.gydF4y2Ba
Cho SW, Kim S, Kim JM, Kim JS:用Cas9 rna引导的内切酶对人类细胞进行靶向基因组工程。生物技术。2013,31:230-232。10.1038 / nbt.2507。gydF4y2Ba
- 13.gydF4y2Ba
Cong L,Ran FA,Cox D,Lin S,Barretto R,Habib N,Hsu PD,Wu X,Jiang W,Marraffi LA,Zhang F:使用CRISPR/Cas系统的多重基因组工程。科学。2013,339:819-823.10.1126/science.1231143。gydF4y2Ba
- 14.gydF4y2Ba
DiCarlo JE, Norville JE, Mali P, Rios X, Aach J, Church GM:使用CRISPR-Cas系统的酿酒酵母基因组工程。中国生物医学工程学报,2013,31(4):436 -4343。10.1093 / nar / gkt135。gydF4y2Ba
- 15.gydF4y2Ba
冯卓,张斌,丁伟,刘晓,杨德龙,魏鹏,曹峰,朱胜,张飞,毛勇,朱家康:基于CRISPR/Cas的植物基因组高效编辑。细胞Res. 2013, 23: 1229-1232。10.1038 / cr.2013.114。gydF4y2Ba
- 16.gydF4y2Ba
Friedland AE, Tzur YB, Esvelt KM, Colaiacovo MP, Church GM, Calarco JA:通过CRISPR-Cas9系统编辑线虫的可遗传基因组。参考文献:[1]10.1038 / nmeth.2532。gydF4y2Ba
- 17gydF4y2Ba
Hsu PD, Scott DA, Weinstein JA, Ran FA, Konermann S, Agarwala V, Li Y, Fine EJ, Wu X, Shalem O, Cradick TJ, Marraffini LA, Bao G, Zhang F: DNA靶向Cas9核酸酶的特异性。生物技术,2013,31:827-832。10.1038 / nbt.2647。gydF4y2Ba
- 18gydF4y2Ba
Hwang WY, Fu Y, Reyon D, Maeder ML, Tsai SQ, Sander JD, Peterson RT, Yeh JR, Joung JK:使用CRISPR-Cas系统对斑马鱼进行高效的基因组编辑。生物技术,2013,31:227-229。10.1038 / nbt.2501。gydF4y2Ba
- 19.gydF4y2Ba
姜伟,周宏,毕宏,弗洛姆,杨斌,周德平:CRISPR/Cas9/sgRNA介导的拟南芥、烟草、高粱和水稻靶向基因修饰的研究。《核酸研究》,2013年,41:e188-10.1093/nar/gkt780。gydF4y2Ba
- 20.gydF4y2Ba
acta botanica botanica(云南植物研究). Li JF, Norville JE, Aach J, McCormack M, Zhang D, Bush J, Church GM, Sheen J: Multiplex and同源重组介导的拟南芥和benthamiana基因组编辑。生物技术,2013,31:688-691。10.1038 / nbt.2654。gydF4y2Ba
- 21.gydF4y2Ba
Mali P, Yang L, Esvelt KM, Aach J, Guell M, DiCarlo JE, Norville JE, Church GM: rna引导的人类基因组工程通过Cas9。科学,2013,339:823-826。10.1126 / science.1232033。gydF4y2Ba
- 22.gydF4y2Ba
毛勇,张慧,徐宁,张斌,高峰,朱家康:CRISPR-Cas系统在植物基因组工程中的应用。Mol Plant. 2013, 6: 2008-2011。10.1093 / mp / sst121。gydF4y2Ba
- 23.gydF4y2Ba
Nekrasov V, Staskawicz B, Weigel D, Jones JD, Kamoun S:利用Cas9 rna引导的内切酶对模型植物benthamiana进行靶向诱变。生物技术,2013,31:691-693。10.1038 / nbt.2655。gydF4y2Ba
- 24.gydF4y2Ba
单强,王勇,李军,张勇,陈凯,梁智,张凯,刘军,西建军,邱建林,高聪:基于CRISPR-Cas系统的作物基因组定向修饰。生物技术。2013,31:686-688。10.1038 / nbt.2650。gydF4y2Ba
- 25.gydF4y2Ba
沈波,张杰,吴辉,马凯,李忠,张欣,张鹏:Cas9/ rna介导的基因靶向介导转基因小鼠的生成。细胞Res. 2013, 23: 720-723。10.1038 / cr.2013.46。gydF4y2Ba
- 26.gydF4y2Ba
谢凯,杨勇:基于CRISPR-Cas系统的植物基因组编辑。Mol Plant, 2013, 6: 1975-1983。10.1093 / mp / sst119。gydF4y2Ba
- 27.gydF4y2Ba
Yang H,Wang H,Shivalila CS,Cheng AW,Shi L,Jaenisch R:通过CRISPR/Cas介导的基因组工程一步产生携带报告基因和条件等位基因的小鼠。牢房。2013,154:1370-1379。10.1016/j.cell.2013.08.022。gydF4y2Ba
- 28.gydF4y2Ba
李D,邱Z,陈邵Y, Y, Y关,刘米,李Y,高N, L,王陆X, Y,刘M:遗传基因打靶的老鼠和老鼠使用CRISPR-Cas系统。生物技术。2013,31:681-683。10.1038 / nbt.2661。gydF4y2Ba
- 29gydF4y2Ba
李伟,滕峰,李涛,周琦:基于CRISPR-Cas系统的大鼠多基因突变同时产生和种系传递。生物技术。2013,31:684-686。10.1038 / nbt.2652。gydF4y2Ba
- 30.gydF4y2Ba
Wang H, Yang H, Shivalila CS, Dawlaty MM, Cheng AW, Zhang F, Jaenisch R:利用CRISPR/ cas介导的基因组工程一步生成多基因突变小鼠。Cell. 2013, 153: 910-918。10.1016 / j.cell.2013.04.025。gydF4y2Ba
- 31.gydF4y2Ba
利用CRISPR核酸酶系统对斑马鱼基因组进行高效编辑。美国国家科学学会主办。2013年,110:13904 - 13909。10.1073 / pnas.1308335110。gydF4y2Ba
- 32.gydF4y2Ba
陈沈牛Y, B,崔Y, Y,小王,小王L,康Y,赵X,如果W,李W,美联社,周J,郭X, Y Bi, Si C, B,胡董G,王H,周Z,李T,谭T, Pu X,王F,霁年代,周问,黄X,霁W,沙J:代基因改性的猕猴猴通过Cas9 / rna介导的基因定位在一个细胞的胚胎。细胞。2014,156:836-843。10.1016 / j.cell.2014.01.027。gydF4y2Ba
- 33.gydF4y2Ba
关键词:水稻,CRISPR-Cas,定向诱变,基因工程,基因工程细胞Res. 2013, 23: 1233-1236。10.1038 / cr.2013.123。gydF4y2Ba
- 34.gydF4y2Ba
Belhaj K, Chaparro-Garcia A, Kamoun S, Nekrasov V:植物基因组编辑变得容易:使用CRISPR/Cas系统在模型和作物中进行靶向突变。植物学报,2013,9:39-10.1186/1746-4811-9-39。gydF4y2Ba
- 35.gydF4y2Ba
Fauser F, Schiml S, Puchta H:基于CRISPR/ cas的核酸酶和镍酶都可以有效地用于拟南芥的基因组工程。植物学报,2014,79:348-359。10.1111 / tpj.12554。gydF4y2Ba
- 36.gydF4y2Ba
冯卓,毛勇,徐宁,张波,魏鹏,杨德龙,王铮,张臻,郑锐,杨玲,曾玲,刘欣,朱家康:拟南芥CRISPR/ cas诱导基因修饰的多代分析揭示了其遗传、特异性和模式。美国国家科学学会主办。2014年,111:4632 - 4637。10.1073 / pnas.1400822111。gydF4y2Ba
- 37.gydF4y2Ba
Jia H, Wang N:利用Cas9/sgRNA对甜橙进行靶向基因组编辑。公共科学图书馆。2014,9:e93806-10.1371/journal.pone.0093806。gydF4y2Ba
- 38.gydF4y2Ba
关键词:CRISPR/ cas9,拟南芥,基因编辑,遗传公共科学图书馆。2014,9:e99225-10.1371/journal.pone.0099225。gydF4y2Ba
- 39.gydF4y2Ba
Xie K, Zhang J, Yang Y:用于crispr - cas9介导的基因组编辑的高特异性引导RNA间隔的全基因组预测。摩尔工厂。2014,7:923-926。10.1093 / mp / ssu009。gydF4y2Ba
- 40.gydF4y2Ba
关键词:CRISPR/Cas9,水稻,基因编辑,同源性,纯合子植物保护学报,2014,34(1):1 - 7。10.1111 / pbi.12200。gydF4y2Ba
- 41.gydF4y2Ba
Hellens RP、Edwards EA、Leyland NR、Bean S、Mullineaux PM:pGreen:一种用于农杆菌介导的植物转化的多功能和灵活的二元Ti载体。植物分子生物学。2000年,42:819-832。10.1023/A:1006496308160。gydF4y2Ba
- 42.gydF4y2Ba
一种用于植物基因高通量功能分析的门户克隆载体。植物生理学杂志,2003,26(3):431 - 431。10.1104 / pp.103.027979。gydF4y2Ba
- 43.gydF4y2Ba
T-DNA二元载体和系统。植物生理学杂志。2008,37(6):649 - 652。10.1104 / pp.107.113001。gydF4y2Ba
- 44.gydF4y2Ba
Weber E,Engler C,Gruetzner R,Werner S,Marillonnet S:用于多基因结构标准化组装的模块化克隆系统。公共科学图书馆一号。2011年6月:e16765-10.1371/journal.pone.0016765。gydF4y2Ba
- 45.gydF4y2Ba
Engler C, Kandzia R, Marillonnet S:一锅,一步,高通量的精确克隆方法。PLoS One. 2008, 3: e3647-10.1371/journal.pone.0003647。gydF4y2Ba
- 46.gydF4y2Ba
Gibson DG, Young L, Chuang RY, Venter JC, Hutchison CA, Smith HO:多达几百个碱基的DNA分子的酶组装。参考文献:[1]10.1038 / nmeth.1318。gydF4y2Ba
- 47.gydF4y2Ba
拟南芥(arabidopsis thylopsis thylopsis thylopsis thylopsis thylopsis thylopsis thylopsis thylopsis thylopsis thylopsis thylopsis thylopsis thylopsis中国生物医学工程学报,2004,24(1):1 - 5。10.1007 / s11103 - 004 - 0893 - 8。gydF4y2Ba
- 48.gydF4y2Ba
Huang YS, Li HM:拟南芥CHLI2可以替代CHLI1。植物生理学杂志。2009,30(5):649 - 652。10.1104 / pp.109.135368。gydF4y2Ba
- 49.gydF4y2Ba
Hajdukiewicz P, Svab Z, Maliga P:用于植物转化的农杆菌二元载体家族。中国生物医学工程学报,2004,25(4):457 - 461。10.1007 / BF00014672。gydF4y2Ba
- 50.gydF4y2Ba
张颖,苏军,段胜,戴军,刘杰,王鹏,李勇,刘斌,冯丹,王军:水稻绿色组织原生质体瞬时基因表达及光/叶绿体相关过程研究。植物保护学报,2011,30(6):716 - 726。gydF4y2Ba
确认gydF4y2Ba
我们感谢冯张pX3300, Keith Joung pJDS246,郭良齐王pXSN和pXUN,罗杰赫楞pSoup, pMDC99/100/123 m·柯蒂斯,Shu-Hua杨帮助玉米原生质体转染和同事在标出转基因设施中心帮助一代的转基因玉米。我们要感谢Elixigen公司以英语为母语的科学家编辑我们的手稿。国家重点基础研究发展计划项目(no . 2012CB114200);国家自然科学基金项目(no . 31070329);国家转基因研究计划项目(no . 2011ZX08009)。关键词:岩石力学,抗剪强度,抗剪强度gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有相互竞争的利益。gydF4y2Ba
作者的贡献gydF4y2Ba
HLX、LD、ZPW、HYZ、CYH和BL进行了实验并对数据进行了分析。CQJ和WXC构思了该研究,参与了该研究的设计和协调,并起草了论文。所有作者都阅读并批准了原稿。gydF4y2Ba
电子辅料gydF4y2Ba
12870\ 2014\ 327\ MOESM1\ ESM.pdfgydF4y2Ba
附加文件1:图S1:代表性p2gR-TRI-B系靶基因突变的测序分析。表S1。本研究中使用的引物(PDF(945 KB)gydF4y2Ba
作者为图片提交的原始文件gydF4y2Ba
以下是作者提交的图片原始文件的链接。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。gydF4y2Ba
本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。gydF4y2Ba
如欲浏览本许可证的副本,请浏览gydF4y2Bahttps://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
“创作共用公共领域”豁免书(gydF4y2Bahttps://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
兴,霍奇金淋巴瘤。,Dong, L., Wang, ZP.et al。gydF4y2Ba植物多重基因组编辑的CRISPR/Cas9工具箱。gydF4y2BaBMC植物杂志gydF4y2Ba14,gydF4y2Ba327(2014)。https://doi.org/10.1186/s12870-014-0327-ygydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-014-0327-ygydF4y2Ba
关键字gydF4y2Ba
- CRISPR / Cas9gydF4y2Ba
- 基因组编辑gydF4y2Ba
- 多基因突变gydF4y2Ba
- 多种grna的组装gydF4y2Ba