- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发布:GydF4y2Ba
红色和蓝光对叶形解剖学,CO的影响GydF4y2Ba2GydF4y2Ba同化和甜椒的光合电子传输能力(GydF4y2BaCapsicum Annuum.GydF4y2BaL.)幼苗GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba20.GydF4y2Ba文章编号:GydF4y2Ba318.GydF4y2Ba(GydF4y2Ba2020.GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
已知红色(R)和蓝色(B)光波长在生长和发育期间影响许多植物生理过程,特别是光合作用。要了解R和B光如何影响植物光膀胱和光合作用,我们研究了叶子解剖学,叶绿素荧光和光合参数的变化,核糖糖-1,5-双磷酸羧酶/氧酶(Rubisco)和Calvin循环相关酶表达及其活性在甜椒(GydF4y2BaCapsicum Annuum.GydF4y2BaL.)幼苗暴露于四个光质品质:单色白(W,控制),R,B和混合R和B(RB)光,其光合光子通量密度(PPFD)为300μmol/ mGydF4y2Ba2GydF4y2Ba·S。GydF4y2Ba
结果GydF4y2Ba
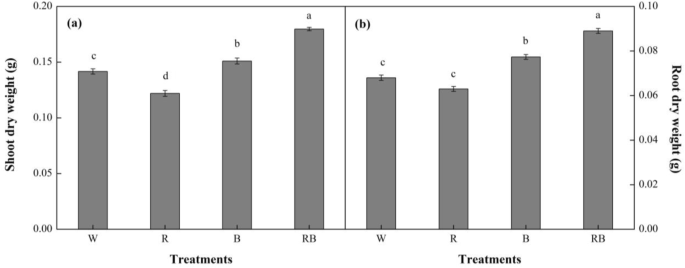
结果表明,在R光下生长的幼苗,其生物量积累、CO含量均较低GydF4y2Ba2GydF4y2Ba与在其他治疗下生长的植物相比,同化和光照二世(PSII)电子运输。这些变化可能是由于灭活照片(PS)。生物质积累和合作GydF4y2Ba2GydF4y2Ba在B-和RB生长的植物中显着富集了同化,特别是后一种治疗。它们的叶子也较厚,光合电子传输能力以及增强光合速率。涉及钙素循环的Rubisco,Fruceose-1,6-双磷酸酶(FBP酶)和甘油醛 - 磷酸脱氢酶(GAPDH)的表达和活性的上调,可能是有助于摩擦的主要酶促因子(核糖糖 -1,5-双磷酸盐)合成也增加。GydF4y2Ba
结论GydF4y2Ba
混合R和B光改变了植物光学发生和光合作用,主要通过其对叶子解剖学,光合电子传输的影响以及关键的钙氏循环酶的表达和活性。GydF4y2Ba
背景GydF4y2Ba
光是影响植物生长和发展的最重要的环境因素之一[GydF4y2Ba1GydF4y2Ba].使用光而不是化学物质来控制植物结构可以减少对环境的影响[GydF4y2Ba2GydF4y2Ba].光通过调节叶绿体和解剖学发育,通过对钙循环中的关键酶活性和基因的相关表达的影响影响幼苗的光合特性。[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba].GydF4y2Ba
光合作用是在地球上为生活中使用生命的绿色发动机,因为它是允许植物等的唯一生物过程,以将光能转化为化学能量[GydF4y2Ba7.GydF4y2Ba].提高光合作用对维持足够的干生物量积累至关重要。众所周知,除了光强和光周期外,光质量,即光的颜色或波长,对植物的生长和光合作用也有重要的影响[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba11.GydF4y2Ba那GydF4y2Ba12.GydF4y2Ba].特定的轻质质量对植物具有精确的影响。例如,蓝色(b)和红色(R)光是植物光合作用期间最有效利用的波长,因为光合色素的吸收光谱主要关注B(400-500nm)和R(600-700nm)光光谱。因此,他们的实用和监管机制一直是研究的重要领域[GydF4y2Ba13.GydF4y2Ba那GydF4y2Ba14.GydF4y2Ba].GydF4y2Ba
少数研究使用了R和B光来检查光质质量对植物的解剖学,光合作用和形态的影响。通常,R光在控制叶绿体,茎和叶柄生长和生殖系统的功能方面发挥着重要作用GydF4y2Ba15.GydF4y2Ba那GydF4y2Ba16.GydF4y2Ba].B光影响植物生长、叶片扩张、光形态建成、气孔开放、光合作用和色素积累[GydF4y2Ba17.GydF4y2Ba那GydF4y2Ba18.GydF4y2Ba].此外,显示在B光下生长的植物具有更高的气孔导率,叶绿素(CHL)GydF4y2Ba一种GydF4y2Ba/GydF4y2BaB.GydF4y2Ba,更高的光系统(PS)活性和光合电子传输能力,核糖-1,5-双磷酸羧酸酯/氧酶(Rubisco)活性和与钙血管循环相关的基因的表达比在R光下生长的植物较高GydF4y2Ba19.GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba].GydF4y2Ba
卡尔文循环发生在光合作用过程中,由发生在叶绿体基质中的不依赖光的氧化还原反应组成,对光合碳的固定起关键作用。碳同化效率受1,5 -二磷酸核酮糖(RuBP)再生速率的影响。Rubisco是植物光合作用中的一种关键酶,它控制二氧化碳和碳固定[GydF4y2Ba21.GydF4y2Ba].这组反应由Rubisco和其他相应的关键酶催化,最终将二氧化碳和水转化为有机糖。根据以往的研究,光质量通过调节这些相关基因的表达来影响光合特性[GydF4y2Ba22.GydF4y2Ba那GydF4y2Ba23.GydF4y2Ba].GydF4y2Ba
还有表明,单色R或B光不能满足正常的植物生长要求,并且没有两个轻质品质之一产生光合效率效率效应[GydF4y2Ba24.GydF4y2Ba].各种研究发现,混合R和B光是一种有效的照明源,其改善了植物发育,并且适当比例的R和B光加速了光合作用和番茄,黄瓜和甜椒的生长。[GydF4y2Ba24.GydF4y2Ba那GydF4y2Ba25.GydF4y2Ba那GydF4y2Ba26.GydF4y2Ba].叶子解剖结构可以通过叶厚度直接影响光捕获,以及Palisade和海绵状叶肉的分化。早些时候的报告显示,当R光补充B光时,叶厚度增加[GydF4y2Ba27.GydF4y2Ba].此外,Klein [GydF4y2Ba28.GydF4y2Ba]和纳氮[GydF4y2Ba26.GydF4y2Ba]发现混合R和B光导致更高的CHLGydF4y2Ba一种GydF4y2Ba那GydF4y2BaB.GydF4y2Ba和总CHL水平,改善的电子传输速率(ETR)和非光化学淬火(NPQ)的早期发作,所有这些都导致光合效率增加。因此,由于它们在叶子水平的有效光合波长[中,混合R和B光现在用于研究研究和商业园艺中GydF4y2Ba29.GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba].尽管有这些成就,受混合R和B光影响的植物的特定光合作用过程仍然很大程度上是未知的。GydF4y2Ba
甜椒的普及(GydF4y2BaCapsicum Annuum.GydF4y2BaL.)对于新鲜市场消费或在即食食品中,过去几十年来,这些辣椒主要在受保护的环境中产生了[GydF4y2Ba31.GydF4y2Ba].混合R和B光对辣椒植物的生长和生理有表观影响[GydF4y2Ba26.GydF4y2Ba那GydF4y2Ba32.GydF4y2Ba那GydF4y2Ba33.GydF4y2Ba].获得了更完整的机械照片,植物适应和响应R和B轻质质量是重要的,因为轻质质量在生长和生理学中起重要作用。此外,更好地了解叶子解剖学,COGydF4y2Ba2GydF4y2Ba影响对R和B光反应的同化和光合电子传输可以提高光合效率,并有助于开发更好的方法来评估植物反应对轻质质量的影响。最近,作为具有高光合效率的光源的发光二极管(LED)已成功地用于科学研究和保护的园艺[GydF4y2Ba34.GydF4y2Ba那GydF4y2Ba35.GydF4y2Ba那GydF4y2Ba36.GydF4y2Ba].我们前期研究发现,适当比例的混合R和B光(R:B = 3:1, RB)可以促进辣椒幼苗的光合作用和生长。本研究旨在研究R和/或B光源对辣椒幼苗光形态建成、光合特性以及卡尔文循环中关键酶的转录和翻译水平的影响。GydF4y2Ba
结果GydF4y2Ba
不同光处理下植物形态及生物量积累GydF4y2Ba
在处理后28天(d)后,单色和混合R和B光对甜椒幼苗形态的影响(d)的视觉概述(d)所示GydF4y2Ba1GydF4y2Ba和补充图。GydF4y2Ba2GydF4y2Ba不同治疗的差异是显着的。与W相比,RB下的植物芽干重(DW)显着增加(GydF4y2BaP.GydF4y2Ba< 0.05),且均高于其他处理,而R光产生的DWs最低(图。GydF4y2Ba2GydF4y2Ba一种)。根DW在所有治疗中显示出类似的趋势(图。GydF4y2Ba2GydF4y2Bab)。GydF4y2Ba
不同光处理下的叶子解剖学GydF4y2Ba
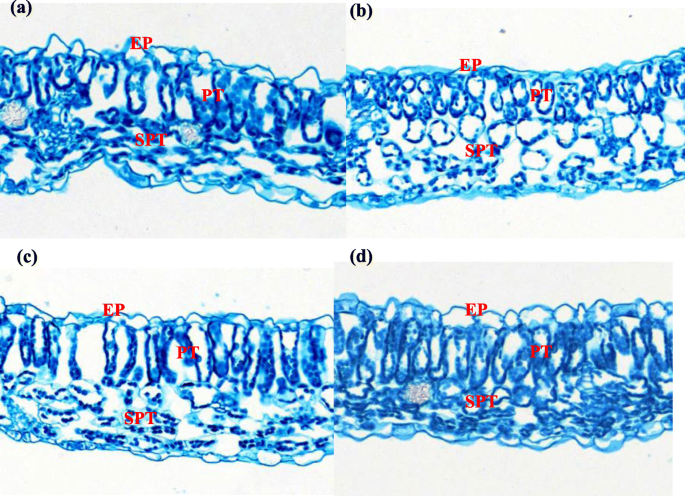
桌子GydF4y2Ba1GydF4y2Ba和图。GydF4y2Ba3.GydF4y2Ba表明R和B光对胡椒叶的解剖结构有显着影响。叶片厚度是Rb下的最高,其次是B和W,而在R光下发现最薄的叶子。此外,与W相比,在RB处理下,塔拉德叶肉组织(Pt),海绵叶蛋白组织(SPT)和上表皮的厚度显着更大(GydF4y2BaP.GydF4y2Ba< 0.05)。这三个参数分别增加了26,19和22%,但r光显着降低。在R下发现更薄的下表皮厚度,而表皮往往在Rb下倾向较厚,尽管它们与W没有显着差异。对PT和SPT比的影响不强(GydF4y2BaP.GydF4y2Ba> 0.05),细胞层最薄。GydF4y2Ba
光合光线和COGydF4y2Ba2GydF4y2Ba-响应曲线GydF4y2Ba
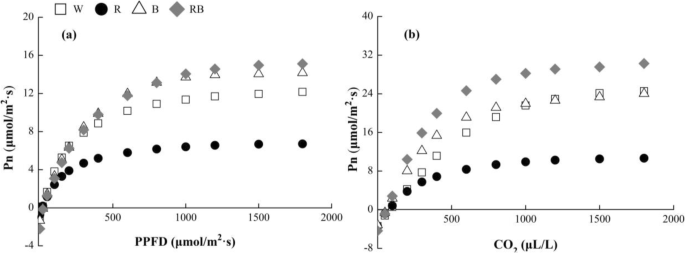
叶片的净光合速率(PN)都随着PPFD的增量而迅速增加(图。GydF4y2Ba4.GydF4y2Baa)和coGydF4y2Ba2GydF4y2Ba浓度(图。GydF4y2Ba4.GydF4y2Bab)在初始阶段,之后,它们的趋势逐渐变得稳定。在Rb下检测到最高的PN-PPFD响应曲线值,然后在B和W下检测,而R产生最低值。此外,不同的光处理为PN-CO产生了类似的趋势GydF4y2Ba2GydF4y2Ba.表观量子效率(AQY),光饱和点(LSP),最大饱和度(PNGydF4y2Ba最大限度GydF4y2Ba),羧化效率(CE)和COGydF4y2Ba2GydF4y2Ba饱和点(CSP)水平和最大RuBP再生速率在RB (GydF4y2BaP.GydF4y2Ba < 0.05) than those under W, whereas, the light compensation point (LCP) and CO2GydF4y2Ba补偿点(CCP)值下降在该处理下(表GydF4y2Ba2GydF4y2Ba和表格GydF4y2Ba3.GydF4y2Ba)。GydF4y2Ba
叶绿素A荧光和叶绿素荧光瞬变在不同的光处理下GydF4y2Ba
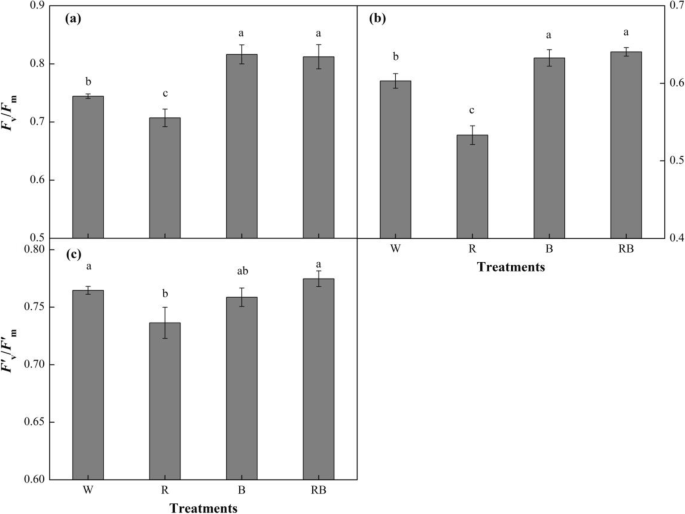
R和B光对辣椒幼苗CHL荧光参数的影响如图2所示。GydF4y2Ba5.GydF4y2Ba.GydF4y2BaFGydF4y2BaV.GydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba表示最大的光转换效率或PS II的最大量子产率,在Rb和B下显着高于W下的效率,并且Rb和B处理之间没有显着差异(图。GydF4y2Ba5.GydF4y2Ba一种)。此外,该参数在r下显着下降(GydF4y2BaP.GydF4y2Ba< 0.05)。GydF4y2BaΦGydF4y2BaPsii.GydF4y2Ba代表PS II的实际转化效率或实际量子产率,并且它显示出与四种光质处理类似的反应(图。GydF4y2Ba5.GydF4y2Bab)。GydF4y2BaFGydF4y2Ba'GydF4y2BaV.GydF4y2Ba/GydF4y2BaFGydF4y2Ba'GydF4y2BamGydF4y2Ba表示效率如何通过开放的光系统II(PSII)反应中心捕获,并且在RB生长的幼苗中增强,其次是W和B,这三种治疗中没有显着差异(GydF4y2BaP.GydF4y2Ba > 0.05) (Fig.5.GydF4y2Bac).但在R光下生长的幼苗显著降低GydF4y2BaFGydF4y2Ba'GydF4y2BaV.GydF4y2Ba/GydF4y2BaFGydF4y2Ba'GydF4y2BamGydF4y2Ba值(GydF4y2BaP.GydF4y2Ba< 0.05), R组与B组间差异无统计学意义。GydF4y2Ba
不同光处理对叶绿素荧光参数的影响:(GydF4y2Ba一种GydF4y2Ba)GydF4y2BaFGydF4y2BaV.GydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba, PSII的最大光化学效率;(GydF4y2BaB.GydF4y2Ba)GydF4y2BaΦGydF4y2BaPsii.GydF4y2Ba,实际PSII光化学效率;(GydF4y2BaCGydF4y2Ba)GydF4y2BaFGydF4y2Ba'GydF4y2BaV.GydF4y2Ba/GydF4y2BaFGydF4y2Ba'GydF4y2BamGydF4y2Ba,光适应下甜椒幼苗PSII的最大光化学效率为处理后28天。数据显示为平均值±se,n = 3.不同的字母表示值之间的显着差异(GydF4y2BaP.GydF4y2Ba< 0.05)。W白光;R,单色R光;B、单色B光;RB,混合的R和B光3:1GydF4y2Ba
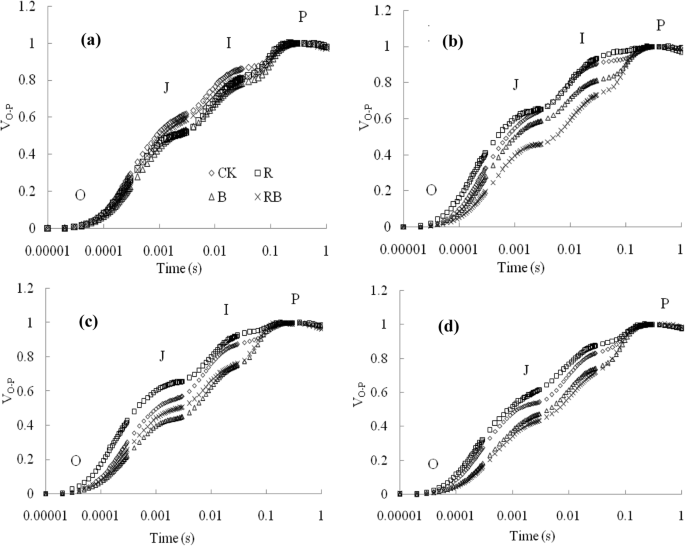
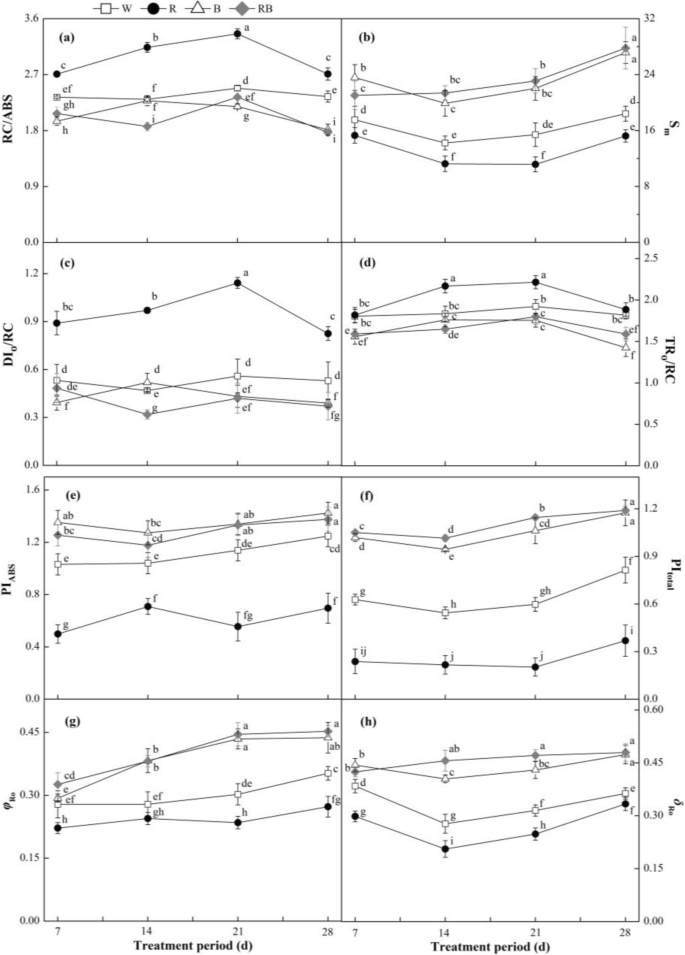
图中显示了典型的多相Chl a荧光瞬态(OJIP)在不同的实验时间点增加。GydF4y2Ba6.GydF4y2Ba广告。通常,结果表明,与r,主要在j和i步骤中,w,b和rb处理减少了ojip曲线的幅度,而它们在r光下较高。治疗中O和P步骤的最大幅度没有明显差异(GydF4y2BaP.GydF4y2Ba > 0.05). In order to further study the mechanisms behind the observed changes, the JIP-test was used for the fluorescence induction transients (Fig.7.GydF4y2Ba啊)。大多数JIP测试参数(例如,反应中心的通用电子载体(SGydF4y2BamGydF4y2Ba),由PSII吸收的光子能节能的可能性,以减少界面电子受体(PI)GydF4y2Ba腹肌GydF4y2Ba),PSII吸收的光子能节能的潜力从减少PSI最终受体(PIGydF4y2Ba全部的GydF4y2Ba),PSI受体侧减少终端电子受体的量子产率(GydF4y2BaΦGydF4y2BaRO.GydF4y2Ba)和来自系统间电子载流子的电子转移到PSI受体端以减少末端电子受体的效率/概率(GydF4y2BaδGydF4y2BaRO.GydF4y2Ba)通过B和Rb与W相比显着升高(GydF4y2BaP.GydF4y2Ba < 0.05), but the R light produced relatively lower values. Additionally, the fraction of PSII Chl一种GydF4y2Ba作为反应中心(RC / ABS)的分子,反应中心中的散热能量(DIGydF4y2BaO.GydF4y2Ba/ rc)和每个活性PSII反应中心的最大被困能量激子(TRGydF4y2BaO.GydF4y2Ba/ rc)在R下的叶片明显大于其他治疗下的叶片(GydF4y2BaP.GydF4y2Ba< 0.05)。GydF4y2Ba
不同轻微处理对JIP试验参数的影响:(GydF4y2Ba一种GydF4y2Ba) RC/ABS,作为反应中心的PSII Chl分子的分数;(GydF4y2BaB.GydF4y2Ba)S.GydF4y2BamGydF4y2Ba、一般反应中心的电子载体;(GydF4y2BaCGydF4y2BaDI)GydF4y2BaO.GydF4y2Ba/ rc,反应中心的耗散能量;(GydF4y2BaD.GydF4y2BaTR.GydF4y2BaO.GydF4y2Ba/RC,每个PSII反应中心的最大捕获能激子;(GydF4y2BaE.GydF4y2Ba)pi.GydF4y2Ba腹肌GydF4y2Ba,PSII吸收的光子能节能的潜力在减少界面电子受体中的减少;(GydF4y2BaFGydF4y2Ba)pi.GydF4y2Ba全部的GydF4y2Ba,PSII吸收的光子能节能潜力以减少PSI最终受体;(GydF4y2BaGGydF4y2Ba)GydF4y2BaΦGydF4y2BaRO.GydF4y2Ba,PSI受体侧减少终端电子受体的量子产率;(GydF4y2BaHGydF4y2Ba)GydF4y2BaδGydF4y2BaRO.GydF4y2Ba,从不同的实验期间转移来自穿系统电子载体的电子来自基于晶体电子载体的电子对甜椒幼苗的末端电子受体。数据显示为平均值±se,n = 3.不同的字母表示值之间的显着差异(GydF4y2BaP.GydF4y2Ba< 0.05)。W白光;R,单色R光;B、单色B光;Rb,混合r和b光为3:1。□w;GydF4y2Ba●GydF4y2Bar;GydF4y2Ba△GydF4y2BaB;GydF4y2Ba◆GydF4y2Barb.GydF4y2Ba
不同光处理对卡尔文循环酶活性的影响GydF4y2Ba
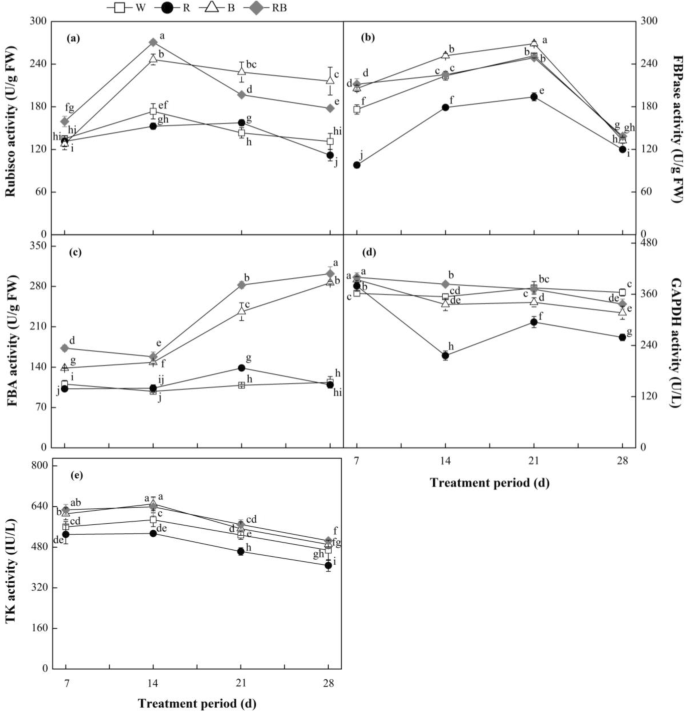
Rubisco,FBPase,Fruceose-1,6-双磷酸醛糖酶(FBA),甘油醛 - 磷酸脱氢酶(GAPDH)和转铁糖醇酶(TK)是Calvin循环中的关键酶。结果表明,Rubisco活性最初增加,然后随着不同光质处理的持续时间增加而增加(图。GydF4y2Ba8.GydF4y2Baa e)。B和RB处理下的Rubisco活性显著高于w处理(GydF4y2BaP.GydF4y2Ba< 0.05),在28 DAT时分别增加65和36%(图。GydF4y2Ba8.GydF4y2Ba)。相比之下,R-生长的植物的活性水平明显低于W-生长的植物。GydF4y2Ba
不同光处理对卡尔文循环相关酶活性的影响:(GydF4y2Ba一种GydF4y2Ba)Rubisco,丝纤果-1,5-双磷酸羧酸酶/氧酶;(GydF4y2BaB.GydF4y2BaFBPase,果糖- 1,6 -二磷酸酶;(GydF4y2BaCGydF4y2Ba)FBA,果糖-1,6-双磷酸醛糖酶;(GydF4y2BaD.GydF4y2Ba)GAPDH,甘油醛 - 磷酸脱氢酶;(GydF4y2BaE.GydF4y2Ba)TK,来自甜椒幼苗的TK,在不同的实验期间。数据显示为平均值±se,n = 3.不同的字母表示值之间的显着差异(GydF4y2BaP.GydF4y2Ba< 0.05)。FW,鲜重;W白光;R,单色R光;B、单色B光;Rb,混合r和b光为3:1。□w;GydF4y2Ba●GydF4y2Bar;GydF4y2Ba△GydF4y2BaB;GydF4y2Ba◆GydF4y2Barb.GydF4y2Ba
不同光处理下,辣椒幼苗FBPase活性显著升高。FBPase活性在21dat达到最高水平,随后几天下降(图)。GydF4y2Ba8.GydF4y2Bab)。在B光下的植物中的这种酶的活性仍然明显高于7至21日(GydF4y2BaP.GydF4y2Ba< 0.05),但在28 DAT时W与B间无显著差异(GydF4y2BaP.GydF4y2Ba > 0.05). Significantly lower activities were observed under R light than those under other treatments during the experimental period. The FBA activities in plants treated with W and R light increased slowly during the experimental period (Fig.8.GydF4y2Bac),而RB和B处理在14 d后酶活性迅速增加,说明RB和B处理的酶活性高于W和R处理。所有处理下植株的GAPDH活性均有所下降,但W和RB光处理缓解了下降趋势(图2)。GydF4y2Ba8.GydF4y2Bad)。在实验期间的所有治疗中,TK活性在实验期间类似,除了在R处理下的GAPDH和TK活性明显低于其他处理(图。GydF4y2Ba8.GydF4y2Bae)。GydF4y2Ba
不同光处理下的基因表达GydF4y2Ba
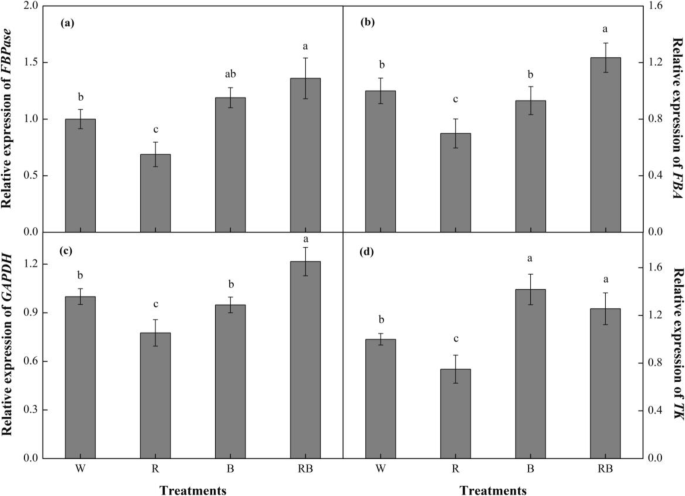
RT-PCR方法用于分析相对表达水平GydF4y2BaFBAGydF4y2Ba那GydF4y2BaFBPase.GydF4y2Ba那GydF4y2BaGAPDH.GydF4y2Ba和GydF4y2BaTK.GydF4y2Ba辣椒幼苗暴露于28天的辣椒幼苗后参与钙氏循环的基因。数字GydF4y2Ba9.GydF4y2BaA-D表明,根据所提供的轻质品质和类似的变化模式,这些基因的转录水平显着变化GydF4y2BaFBAGydF4y2Ba那GydF4y2BaFBPase.GydF4y2Ba和GydF4y2BaGAPDH.GydF4y2Ba在不同的治疗中。通常,与W相比,RB下的幼苗显示出这三种基因的表达水平显着增加,而暴露于R光导致基因转录减少。另外,相对表达水平GydF4y2BaTK.GydF4y2Bab处理后,RB和W的表达水平依次升高,但R的表达水平最低GydF4y2BaTK.GydF4y2Ba水平。GydF4y2Ba
不同光处理对(GydF4y2Ba一种GydF4y2Ba)GydF4y2BaFBAGydF4y2Ba;(GydF4y2BaB.GydF4y2Ba)GydF4y2BaFBPase.GydF4y2Ba;(GydF4y2BaCGydF4y2Ba)GydF4y2BaGAPDH.GydF4y2Ba;(GydF4y2BaD.GydF4y2Ba)GydF4y2BaTK.GydF4y2Ba在治疗后28天的甜椒幼苗。数据显示为平均值±se,n = 3.不同的字母表示值之间的显着差异(GydF4y2BaP.GydF4y2Ba< 0.05)。W白光;R,单色R光;B、单色B光;RB,混合的R和B光3:1GydF4y2Ba
讨论GydF4y2Ba
在光控制的生长过程中,据称,光感受器通过感知和解释入射光并转换信号来调节光响应核基因。在光谱中,R和B波长可以强烈影响植物光合作用,生理代谢和形态作为主要光谱波长[GydF4y2Ba37.GydF4y2Ba那GydF4y2Ba38.GydF4y2Ba那GydF4y2Ba39.GydF4y2Ba].在这项研究中,甜椒幼苗的光致作用和光合特性受到轻质质量的显着影响。生物质是幼苗质量的重要指标。在这项研究中,RB下的幼苗DW显着大于其他治疗,这表明这一频谱是最佳的,因为它通过增加CHL促进了植物发育并推动了光合作用GydF4y2Ba一种GydF4y2Ba幼苗中的总CHL含量[GydF4y2Ba33.GydF4y2Ba那GydF4y2Ba40GydF4y2Ba].以往的研究也发现,混合R和B光可以提高许多其他植物的鲜重(FW)和DW,如菊花、陆地棉和番茄[GydF4y2Ba41.GydF4y2Ba那GydF4y2Ba42.GydF4y2Ba那GydF4y2Ba43.GydF4y2Ba].与其他治疗相比,RB的辣椒幼苗的生物质显着增加,这可能是由于叶面积(LA)的扩大(LA)[GydF4y2Ba44.GydF4y2Ba和叶片解剖结构的变化。GydF4y2Ba
光通过PT和SPT时被叶绿体吸收,这两种组织都是重要的光合组织。在我们的研究中,RB处理大大增加了PT、SPT以及上、下表皮厚度,导致叶片更厚,这与Arena等的研究结果一致[GydF4y2Ba45.GydF4y2Ba]和刘等人。[GydF4y2Ba46.GydF4y2Ba].垂直细长的Pt细胞最小化光散射,这使得更深入地渗透到叶绿体中,而通过散射光来增强光捕获[GydF4y2Ba47.GydF4y2Ba].这种改善了光合结构,应该增加光捕获和吸光度能力,并有助于更好的光合光线驯化。此外,叶厚度在确定叶绿体发展的空间可用性方面发挥着关键作用[GydF4y2Ba48.GydF4y2Ba].RB处理增加了叶片厚度,增强了叶绿体超微结构[GydF4y2Ba49.GydF4y2Ba].结果表明,较大的La和叶片,以及Pt和Spt细胞厚度改善了胡椒幼苗的光截取。这可能是RB能够提高光合效率的另一个重要原因。此外,如Macedo等人所暗示的,可以将记录在R光下记录的较薄叶片作为对植物发育和代谢过程的辐射胁迫的反应。[GydF4y2Ba50.GydF4y2Ba].GydF4y2Ba
能够在光能和CO中的增量下做出良好的能力GydF4y2Ba2GydF4y2Ba植物被光和有限公司反映GydF4y2Ba2GydF4y2Ba- 响应曲线,它为基于光捕获和CO的机制提供了有趣的意见GydF4y2Ba2GydF4y2Ba固定。在本研究中,PN-PPFD在不同的轻质质量下显着低于PN-COGydF4y2Ba2GydF4y2Ba.这可能是由于COGydF4y2Ba2GydF4y2Ba浓度限制。AQY和CE值显示了光线和CO的初始斜坡GydF4y2Ba2GydF4y2Ba分别响应曲线。它们代表了获得低能级光能和CO的能力GydF4y2Ba2GydF4y2Ba植物。我们的结果证实了先前的研究[GydF4y2Ba51.GydF4y2Ba]显示混合R和B光促进了AQY和CE,并且这些增加导致了PN的升高GydF4y2Ba最大限度GydF4y2Ba并最大化rubp再生率。RB灯导致AQY,CE,PN的显着增加GydF4y2Ba最大限度GydF4y2Ba最大的鞋面再生率。这表明混合R和B光对增加光合作用的协同效应[GydF4y2Ba52.GydF4y2Ba].在RB下反映植物能力的LSP值也显着高于RB。这表明RB改善了叶子利用混合光品质的能力。此外,RB下LCP和CCP值显着降低,这表明该处理改善了光合性能和光能利用效率。这些结果表明,混合R和B光通过叶子的化学能量转化为非常有效,因为这一比例的可见光具有迄今为止的量子率最高GydF4y2Ba2GydF4y2Ba与其他光处理相比固定[GydF4y2Ba53.GydF4y2Ba].GydF4y2Ba
光质素质可以通过影响不同类型的叶绿体蛋白和光系统电子传输的形成来调节光合作用[GydF4y2Ba54.GydF4y2Ba].CHL荧光可以部分反映植物的光合能力[GydF4y2Ba55.GydF4y2Ba]及PSII光化学效率(GydF4y2BaΦGydF4y2BaPsii.GydF4y2Ba)可用于揭示植物的生理状态[GydF4y2Ba56.GydF4y2Ba].我们的结果表明,有减少GydF4y2BaΦGydF4y2BaPsii.GydF4y2Ba在暴露于RB处理后的胡椒幼苗。GydF4y2BaFGydF4y2BaV.GydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba表示PSII反应中心捕获的激发能的最大效率,在rb处理幼苗中观察到的显著较高的值表明在该处理下对光抑制的抗性被上调[GydF4y2Ba57.GydF4y2Ba].此外,高GydF4y2BaFGydF4y2Ba'GydF4y2BaV.GydF4y2Ba/GydF4y2BaFGydF4y2Ba'GydF4y2BamGydF4y2Ba和GydF4y2BaΦGydF4y2BaPsii.GydF4y2Ba结果表明,混合R和B光提高了PSII的开放性和电子传递效率,即更多的电子被吸收、捕获和运输。GydF4y2Ba
CHL荧光瞬变的J步骤,I步和IP阶段之间存在相关关系,醌电子受体的氧化还原状态(QGydF4y2Ba一种GydF4y2Ba),PSI电子受体侧的塑性醌和最终受体[GydF4y2Ba58.GydF4y2Ba那GydF4y2Ba59.GydF4y2Ba].R.处理的叶片增加了J-和I步的发现表明,PSII的供体和受体侧的电子传输被抑制。因此,CO.GydF4y2Ba2GydF4y2Ba激发能量在PSI和PSII之间的分布不平衡降低了同化作用。与其他处理相比,单色B光和混合R和B光在实验期间诱导了所有OJIP步骤的降低,这改变了PSII的供体和受体两侧,并影响了电子传递[GydF4y2Ba60.GydF4y2Ba].这些变化维持了供体和受体两侧的电子传递。此外,我们发现RB增加了SGydF4y2BamGydF4y2Ba,pi.GydF4y2Ba腹肌GydF4y2Ba,pi.GydF4y2Ba全部的GydF4y2Ba那GydF4y2BaΦGydF4y2BaRO.GydF4y2Ba和GydF4y2BaδGydF4y2BaRO.GydF4y2Ba,降低RC/ABS、DIGydF4y2BaO.GydF4y2Ba/ rc和trGydF4y2BaO.GydF4y2Ba/ rc(图。GydF4y2Ba7.GydF4y2Ba)较少受到光化学和非光化学氧化还原反应的损害,增强了电子传输的能力,加速了ATP合成和RUBP再生[GydF4y2Ba61.GydF4y2Ba].GydF4y2Ba
在C3植物中,Calvin循环是CO的主要途径GydF4y2Ba2GydF4y2Ba同化(GydF4y2Ba62.GydF4y2Ba].Rubisco是Calvin循环和其他Calvin循环酶中的代表性和独特的酶,包括FBPase,FBA,GADPH和TK,在调节该途径时发挥重要作用[GydF4y2Ba63.GydF4y2Ba那GydF4y2Ba64GydF4y2Ba].光作为一种重要的环境信号,在植物生长过程中激发基因表达并调节相关酶的活性。光如何调节光合作用中酶的表达和活性已被一些研究证实[GydF4y2Ba52.GydF4y2Ba那GydF4y2Ba65GydF4y2Ba].这些研究都得到了本研究的证实。B-和rb处理的植物Rubisco活性显著高于其他光处理的植物。说明B或RB在卡尔文循环中均能促进碳同化和RuBP再生。研究还发现,在R光下,随着Rubisco活性的减少和Calvin循环中大多数基因转录水平的降低,光合速率降低。这一结果与之前的观察结果一致,并暗示CO的抑制作用GydF4y2Ba2GydF4y2Ba卡尔文循环中的羧化作用和PSII由于Rubisco激活酶活性受损而减慢,Rubisco激活酶去除了与Rubisco结合的抑制剂,这可能是CO减少的原因GydF4y2Ba2GydF4y2Ba与其他光处理相比,r生长幼苗的同化率[GydF4y2Ba36.GydF4y2Ba那GydF4y2Ba66GydF4y2Ba].此外,根据先前的研究,气孔因素调节差别摩擦的可用性,以及COGydF4y2Ba2GydF4y2Ba可以参与调整基因表达,因为在检查的基因的表达水平与气孔导度的变化之间存在高相关性[GydF4y2Ba36.GydF4y2Ba].GydF4y2Ba
FBA和FBPase活动直接影响光合效率和碳积累[GydF4y2Ba67GydF4y2Ba].此外,先前的研究表明,TK活性的显着降低导致RUBP再生的显着降低,并显着抑制了植物光合速率[GydF4y2Ba68GydF4y2Ba].在我们的研究中,除了用于的B和Rb下这些酶的活动和其相关基因的相对表达GydF4y2BaFBAGydF4y2Ba和GydF4y2BaTK.GydF4y2Ba,被显着升高,促进了RUBP再生并增加了PN [GydF4y2Ba67GydF4y2Ba那GydF4y2Ba68GydF4y2Ba].叶绿体GAPDH是光合作用期间碳还原过程中涉及的关键酶[GydF4y2Ba69GydF4y2Ba]和更大的GydF4y2BaGAPDH.GydF4y2Ba在本研究中RB光下的表达水平可能是由于对碳通量的需求增加[GydF4y2Ba70GydF4y2Ba],表明保持运动GydF4y2BaGAPDH.GydF4y2Ba在碳还原过程中的表达可能是RB光下促进光合作用的重要因素[GydF4y2Ba71GydF4y2Ba].FBA和TK活动的变化以及在所有治疗中的表达都没有呈正相关,表明转录性丰度与De Novo蛋白质合成有关,因为在翻译欧莱西·al的平移水平下的深刻调节。[GydF4y2Ba72GydF4y2Ba].此外,基因表达和活性的不同模式可能与除光质以外的监管因素相关,但这需要进一步调查。GydF4y2Ba
结论GydF4y2Ba
光质量是调节植物光形态建成和光合特性的重要环境因子。综上所述,甜椒的生长发育和光合作用受到光品质的精确控制和遗传调控。结果表明,R光下幼苗的光合作用受到光合电子传递能力下降的抑制,从而导致CO的降低GydF4y2Ba2GydF4y2Ba同化。这导致了卡尔文周期相关基因表达及其相关酶活性的下调。然而,使用单色B和B R和混合光,尤其是后者,可以提高PSII反应中心的活动和提高光合作用和卡尔文cycle-related酶的表达和活动,包括二磷酸核酮糖羧化酶、FBPase GAPDH,可能是主要酶的因素导致RuBP合成。因此,混合R和B光可能为甜椒幼苗的生长提供更适宜的光照条件。GydF4y2Ba
方法GydF4y2Ba
植物材料和气候条件GydF4y2Ba
该实验于2016年6月至2016年10月,在中国太阳能温室(CSG)和山东农业大学园艺研究中心的人工气候会议(浙江省浙江秋水环境有限公司),P. R.中国。浸没甜椒(GydF4y2BaCapsicum Annuum.GydF4y2Bal .简历。将山东济南威利种子有限公司的红旗健种子,在55°C的温度下浸泡15分钟,在4°C的冷水中浸泡24小时。种子播种在50个槽(54.0 × 30.0 × 4.4 cm)填满泥炭(Floragard Seed 2, Floragard Co., Oldenburg, Germany)和蛭石(2:1,v/v)混合物的塞盘中。所有幼苗每天都用山崎半强度辣椒营养液浇水。三周后,当它们的第二片真叶完全张开时,幼苗被移栽到塑料花盆(长8厘米,宽8厘米,深10厘米,每个花盆一棵幼苗),容器中含有相同的基质,并用全强度营养液浇水。然后,共选择480株幼苗,转入ACC培养,同时接受4种光质处理28 d。每个光质处理在同一ACC中重复3次,每个重复40株。分别在7、14、21和28 DAT的每个复制点随机取样5株植物,进行形态学和生化分析。在受控环境中有通风,所以一氧化碳GydF4y2Ba2GydF4y2Ba水平与CO相同GydF4y2Ba2GydF4y2Ba外面的大气水平。相对湿度(RH)保持在70±10%,光周期12 h,日间温度26±1℃,夜间温度18±1℃。GydF4y2Ba
轻松治疗GydF4y2Ba
所有混合的LED都有均匀的R和B光谱,由中国广东广东智英光电科技有限公司设计。ACC中的培养架是钢框架结构,LED光源放置在顶部。通过银色遮光材料彼此彼此绝缘。植物在以下光条件下生长:单色B光以457nm,R光或混合R和B光(3:1,Rb:75%R,波长为657nm和25%b,波长为457nm的光)在657nm处具有最大强度。有一种多波长W光处理作为控制(补充图。GydF4y2Ba1GydF4y2Ba)。在冠层水平处表示为PPFD的光强度设定为300μmol/ mGydF4y2Ba2GydF4y2Ba·S,使用量子传感器(Li-250,Li-Cor Inc.,Lincoln,Ne,USA)测量,并通过调节LED从檐篷的距离来维护。LED远离树冠约为10厘米。光谱仪(UNISPEC-SC光谱分析系统,PP Systems Inc.,Haverhill,MA,USA)用于测量LED的光谱光子磁通密度分布(SPD)。GydF4y2Ba
生物量分析GydF4y2Ba
将五种幼苗(包括叶片和根)从每次复制中除去每次处理,并在28 DAT中处理,并在105℃下在烘箱中干燥30分钟。将烘箱温度变为75℃,将植物干燥至恒定重量。然后,使用电子平衡测量叶片和根的DWS(精确度:±0.1g,Sartorius Co.,Sartorius Co.,汉堡,德国)。GydF4y2Ba
叶子解剖学GydF4y2Ba
在每个重复处理的相同位置上,测量了五棵辣椒幼苗完全展开的第二片叶子的叶片解剖结构[GydF4y2Ba46.GydF4y2Ba]在28日。从主静脉旁边的中央叶片取出5mm×5mm的叶片,用福尔马林 - 乙酸 - 酒精(FAA)固定剂固定,在醇和二甲苯系列中脱水,嵌入石蜡中,横截面厚度为10μm,并用红色固体染色。在透射光学显微镜(DP71,DOP71,DOKYO,JAPAN)下测量整个叶片的总厚度和上表皮,下表皮,PT和SPT的厚度。使用数码相机(Camedia C4040,Olympus Inc.,Tokyo,Japan)收集图像,并通过Analysis 5.0(东京,日本Olympus Inc.)进行分析。GydF4y2Ba
光合光线和COGydF4y2Ba2GydF4y2Ba-Response曲线GydF4y2Ba
在09:00至下午14:00之间,光合光响应曲线和CO的测量GydF4y2Ba2GydF4y2Ba利用便携式光合系统机(LI-6400XT, Li-COR, Lincoln, NE, USA)在28 DAT时绘制了完全展开的第二个叶片的-响应曲线。该测量技术基于Pan等人所描述的改进方法[GydF4y2Ba52.GydF4y2Ba].叶室温度为26±1GydF4y2Ba∘GydF4y2BaC,空气相对湿度为65±5%,流速为300μmol/ s。在1800,1500,1200,000,800,600,400,300,200,150,100,50,200和0μmol/ m的不同梯度PPFD系列下进行光响应曲线的测量。GydF4y2Ba2GydF4y2Ba·S。当CO.GydF4y2Ba2GydF4y2Ba-响应曲线测量,光强和COGydF4y2Ba2GydF4y2Ba叶比色蛋白的浓度设定为1000μmol/ mGydF4y2Ba2GydF4y2Ba·s和400 μmol/mol,分别作用30 min。当达到稳定状态后,COGydF4y2Ba2GydF4y2Ba响应是由CO的衡量GydF4y2Ba2GydF4y2Ba搅拌器在梯度CI值系列下的400,300,200,100,50,100,00,00,300,400,600,800,1000,1200,1500和1800μmol·coGydF4y2Ba2GydF4y2Ba/ mol。叶室每次调整其新的微气候时,花室花费120〜180秒。根据先前的报告,对每个曲线进行三次测量,这适用于非线性回归方程[GydF4y2Ba73GydF4y2Ba那GydF4y2Ba74GydF4y2Ba],使LCP,LSP,PNGydF4y2Ba最大限度GydF4y2Ba,CCP,CSP和最大RUBP再生率。光响应曲线的起始斜率是AQY,以及CO的曲线的起始斜率GydF4y2Ba2GydF4y2Ba回应是行政长官。GydF4y2Ba
叶绿素荧光和叶绿素荧光瞬变GydF4y2Ba
使用便携式脉冲调制荧光计(FMS-II,Hansatech Instruments Ltd.,King's Lynn,Norfolk,UK)进行CHL荧光测量。每种复制的五种幼苗的第二个完全扩展的叶片每种治疗都是深色适应20分钟,而且GydF4y2BaFGydF4y2BaO.GydF4y2Ba(原始荧光收率)和GydF4y2BaFGydF4y2BamGydF4y2Ba(最大荧光产量)的测定。然后,将叶片置于自然光下1 h,测定叶片的光合速率GydF4y2BaFGydF4y2Ba'GydF4y2BaO.GydF4y2Ba那GydF4y2BaFGydF4y2Ba'GydF4y2BamGydF4y2Ba和GydF4y2BaFGydF4y2BaS.GydF4y2Ba在800μmol/ m的激活光下制造值GydF4y2Ba2GydF4y2Ba·S。饱和脉冲强度为3000μmol/ mGydF4y2Ba2GydF4y2Ba·S和持续时间为0.8秒,GydF4y2BaFGydF4y2Ba'GydF4y2BaO.GydF4y2Ba和GydF4y2BaFGydF4y2Ba'GydF4y2BamGydF4y2Ba分别表示被光照叶片的最小和最大荧光产量,用饱和脉冲法测量。GydF4y2BaFGydF4y2BaS.GydF4y2Ba表示稳定的荧光产率。使用PSII的最大光化学效率GydF4y2BaFGydF4y2BaV.GydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba = (FGydF4y2BamGydF4y2Ba-GydF4y2BaFGydF4y2BaO.GydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba,使用实际PSII光化学效率使用(GydF4y2BaΦGydF4y2BaPsii.GydF4y2Ba)=(GydF4y2BaFGydF4y2Ba'GydF4y2BamGydF4y2Ba-GydF4y2BaFGydF4y2BaS.GydF4y2Ba/GydF4y2BaFGydF4y2Ba'GydF4y2BamGydF4y2Ba利用(1)计算光适应下PSII的最大光化学效率GydF4y2BaFGydF4y2Ba'GydF4y2BaV.GydF4y2Ba/GydF4y2BaFGydF4y2Ba'GydF4y2BamGydF4y2Ba)=(GydF4y2BaFGydF4y2Ba'GydF4y2BamGydF4y2Ba-GydF4y2BaFGydF4y2Ba'GydF4y2BaO.GydF4y2Ba/GydF4y2BaFGydF4y2Ba'GydF4y2BamGydF4y2Ba.GydF4y2Ba
用于植物效率分析仪(Handy Pean,Hansatech Instruments Ltd.,King's Lynn,UK)用于测量第二叶上的Ojip。使用磨砂机的方法来计算JIP测试公式和词汇表[GydF4y2Ba75GydF4y2Ba那GydF4y2Ba76GydF4y2Ba].以下导数参数由Lin等人确定[GydF4y2Ba61.GydF4y2Ba]和miao等人。[GydF4y2Ba30.GydF4y2Ba]:rc / abs,sGydF4y2BamGydF4y2Ba,迪GydF4y2BaO.GydF4y2Ba/ rc,trGydF4y2BaO.GydF4y2Ba/ rc,piGydF4y2Ba腹肌GydF4y2Ba,pi.GydF4y2Ba全部的GydF4y2Ba那GydF4y2BaΦGydF4y2BaRO.GydF4y2Ba和GydF4y2BaδGydF4y2BaRO.GydF4y2Ba.GydF4y2Ba
Calvin循环酶活性GydF4y2Ba
分别在7、14、21和28 DAT取样,选取前15个处理的第2片叶片进行酶活性测定。叶片组织(0.5 g)均质于4 mL冰冷提取缓冲液中:(25 mM Hepes (KGydF4y2Ba+GydF4y2Ba),pH 7.5,10 mm mgsoGydF4y2Ba4.GydF4y2Ba、5 mM二硫苏糖醇(DTT)、1 mM钠GydF4y2Ba2GydF4y2BaEDTA, 1 mM苯基甲烷磺酰氟(PMSF), 5% (w/v)不溶性聚乙烯吡咯烷酮(PVP)和0.05% (v/v) Triton X-100。匀浆用平纹布过滤,4℃,14,000×g离心5分钟。上清液作为酶提取液进行酶活性测定[GydF4y2Ba77GydF4y2Ba].GydF4y2Ba
聘请上海市上海延吉生物科技有限公司,中国上海延吉生物科技有限公司)被采用了鲁米斯科(EC 4.1.1.39),FBPase(EC 3.13.11),FBA(EC 4.1.2.13),GAPDH(EC 1.2.1.12)和TK(EC 2.2.1.1)的活动,以及这些酶的提取方法基于RAO和Terry进行修饰[GydF4y2Ba78GydF4y2Ba王等人。[GydF4y2Ba36.GydF4y2Ba].将冷冻叶样品(0.5g)与砂浆和杵在液氮中的细粉接地后,将粉末放入离心管中并萃取到预冷萃取缓冲液(5mL)中。在4℃的温度下以12,000×g在12,000×g下将酶提取溶液的离心。Calvin循环酶的活性测定用上清液。之后,使用微孔板吸光度读者(Bio-Tek Elx800,Bio-Tek Instruments,Winooski,VT,USA)用于根据制造商的说明确定450nm的吸光度下的Calvin循环酶的活性。GydF4y2Ba
基于Bradford进行每种酶提取溶液的蛋白质浓度的测量[GydF4y2Ba79GydF4y2Ba].测量结果显示为U / G蛋白质。GydF4y2Ba
基因表达GydF4y2Ba
使用快速RNA分离试剂盒,按照供应商说明书(华悦洋生物技术有限公司,北京,中国)提取总RNA。应用ReverTra Ace qPCR RT-Kit (Toyobo Bio-Technology, Co., Ltd., Osaka, Japan)进行逆转录。采用Real-time PCR,以18S rRNA为内参进行基因表达分析。热循环程序在94°C温度下循环一次2 min,在94°C温度下循环40次10 s, 60°C温度下循环20 s, 72°C温度下循环30 s。使用Livak和Schmittgen所描述的方法分析相对基因表达[GydF4y2Ba80GydF4y2Ba].用于实时PCR分析PS复合物的基因的实时PCR分析的特定基因引物如补充表所示GydF4y2Ba1GydF4y2Ba.GydF4y2Ba
数据分析GydF4y2Ba
实验完全随机设计。显示的值是三个重复的平均值±标准偏差(SD)。采用单向方差分析(ANOVA)来分析数据,通过邓肯的多个范围测试测试手段之间的差异(GydF4y2BaP.GydF4y2Ba< 0.05)。这些图表使用Origin (Microcal Software Inc., Northampton, MA, USA)创建。GydF4y2Ba
可用性数据和材料GydF4y2Ba
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。GydF4y2Ba
缩写GydF4y2Ba
- r:GydF4y2Ba
-
红色的GydF4y2Ba
- B:GydF4y2Ba
-
蓝色的GydF4y2Ba
- W:GydF4y2Ba
-
白色GydF4y2Ba
- RB:GydF4y2Ba
-
红色和蓝色的混合光GydF4y2Ba
- PPFD:GydF4y2Ba
-
光合光子磁通密度GydF4y2Ba
- 排名:GydF4y2Ba
-
叶绿素GydF4y2Ba
- ETR:GydF4y2Ba
-
电子运输速率GydF4y2Ba
- NPQ:GydF4y2Ba
-
Non-photochemical淬火GydF4y2Ba
- 引领:GydF4y2Ba
-
发光二极管GydF4y2Ba
- 洛杉矶:GydF4y2Ba
-
叶面积GydF4y2Ba
- CSG:GydF4y2Ba
-
中国太阳能温室GydF4y2Ba
- ACC:GydF4y2Ba
-
人造气候室GydF4y2Ba
- D:GydF4y2Ba
-
一天GydF4y2Ba
- DAT:GydF4y2Ba
-
治疗后的一天GydF4y2Ba
- RH:GydF4y2Ba
-
相对湿度GydF4y2Ba
- SPD:GydF4y2Ba
-
光谱光子磁通密度分布GydF4y2Ba
- DW:GydF4y2Ba
-
干重GydF4y2Ba
- FAA:GydF4y2Ba
-
福尔马林 - 乙酸 - 酒精GydF4y2Ba
- EP:GydF4y2Ba
-
表皮细胞GydF4y2Ba
- PT:GydF4y2Ba
-
塔拉德叶肉组织GydF4y2Ba
- SPT:GydF4y2Ba
-
海绵叶肉组织GydF4y2Ba
- PN:GydF4y2Ba
-
净光合速率GydF4y2Ba
- LCP:GydF4y2Ba
-
光补偿点GydF4y2Ba
- LSP:GydF4y2Ba
-
光饱和点GydF4y2Ba
- PN.GydF4y2Ba最大限度GydF4y2Ba:GydF4y2Ba
-
光饱和最大GydF4y2Ba
- CCP:GydF4y2Ba
-
CO.GydF4y2Ba2GydF4y2Ba补偿点GydF4y2Ba
- CSP:GydF4y2Ba
-
CO.GydF4y2Ba2GydF4y2Ba饱和点GydF4y2Ba
- 尔:GydF4y2Ba
-
表观量子效率GydF4y2Ba
- CE:GydF4y2Ba
-
羧化效率GydF4y2Ba
- FGydF4y2BaV.GydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba:GydF4y2Ba
-
PSII的最大光化学效率GydF4y2Ba
- ΦGydF4y2BaPsii.GydF4y2Ba:GydF4y2Ba
-
实际PSII光化学效率GydF4y2Ba
- FGydF4y2Ba'GydF4y2BaV.GydF4y2Ba/GydF4y2BaFGydF4y2Ba'GydF4y2BamGydF4y2Ba:GydF4y2Ba
-
光适应下PSII的最大光化学效率GydF4y2Ba
- OJIP:GydF4y2Ba
-
CHL.GydF4y2Ba一种GydF4y2Ba荧光瞬态GydF4y2Ba
- RC / ABS:GydF4y2Ba
-
psii chl的分数GydF4y2Ba一种GydF4y2Ba作为反应中心的分子GydF4y2Ba
- S.GydF4y2BamGydF4y2Ba:GydF4y2Ba
-
反应中心的一般电子载体GydF4y2Ba
- 迪GydF4y2BaO.GydF4y2Ba/ rc:GydF4y2Ba
-
反应中心的耗散能量GydF4y2Ba
- TR.GydF4y2BaO.GydF4y2Ba/ rc:GydF4y2Ba
-
每个活性PSII反应中心的最大捕获能量激子GydF4y2Ba
- PI.GydF4y2Ba腹肌GydF4y2Ba:GydF4y2Ba
-
PSII吸收的光子能节能的潜力与跨系统电子受体的减少GydF4y2Ba
- PI.GydF4y2Ba全部的GydF4y2Ba:GydF4y2Ba
-
PSII吸收的光子能节能到PSI最终受体的减少的潜力GydF4y2Ba
- ΦGydF4y2BaRO.GydF4y2Ba:GydF4y2Ba
-
PSI受体侧末端电子受体还原的量子产率GydF4y2Ba
- δGydF4y2BaRO.GydF4y2Ba:GydF4y2Ba
-
来自系统间电子载流子的电子转移到PSI受体端以减少末端电子受体的效率/概率GydF4y2Ba
- rubp:GydF4y2Ba
-
丝纤维-1,5-双磷酸盐GydF4y2Ba
- Rubisco:GydF4y2Ba
-
核酮糖1 5 5-bisphosphate,羧化酶/加氧酶GydF4y2Ba
- FBPase:GydF4y2Ba
-
的特性,6-bisphosphataseGydF4y2Ba
- FBA:GydF4y2Ba
-
的特性,6-bisphosphate醛缩酶GydF4y2Ba
- GAPDH:GydF4y2Ba
-
甘油醛 - 磷酸脱氢酶GydF4y2Ba
- TK:GydF4y2Ba
-
Transketolase.GydF4y2Ba
- 德勤:GydF4y2Ba
-
dithiothreitol.GydF4y2Ba
- PMSF:GydF4y2Ba
-
苯甲磺酰磺酰氟GydF4y2Ba
- PVP:GydF4y2Ba
-
聚乙烯吡咯烷酮GydF4y2Ba
参考GydF4y2Ba
- 1。GydF4y2Ba
Kopsell da,Kopsell de。影响植物叶黄素/玉米黄质的遗传与环境因素。农业食品工业高科技。2008; 19(2):44-6。GydF4y2Ba
- 2。GydF4y2Ba
Abidi F,Girault T,Douillet O,Guillemain G,Sintes G,Laffaire M,Ben-Ahmed H,Smiti S,Huché-ThélierL,LEDUC N.蓝光效应对玫瑰光合作用和光学发生。植物BIOL。2013; 15(1):67-74。GydF4y2Ba
- 3.GydF4y2Ba
刘小燕,焦新林,常廷田,郭世荣,徐志刚。不同led蓝红光子通量比下樱桃番茄幼苗光合作用及叶片发育56 Photosynthetica。2018;(4):1212 - 7。GydF4y2Ba
- 4.GydF4y2Ba
Kreslavski VD,Shirshikova Gn,Lyubimov Vy,Shmarev N,Boutanaev Am,Kosobryukhov Aa,Schmitt Fj,Friedrich T,Allakhverdiev Si。红光对光合参数和氧化剂/抗氧化平衡的影响GydF4y2Ba拟南芥天然GydF4y2Ba对紫外线a的反应。中国光化学学报(英文版);2012;GydF4y2Ba
- 5。GydF4y2Ba
Gutu A,Nesbit Ad,Alverson AJ,Palmer JD,Kehoe DM。翻译引发因子3在光合基因表达的浅色调节中的独特作用。Proc Natl Acad SCI U S A. 2013; 110(40):16253-8。GydF4y2Ba
- 6。GydF4y2Ba
Albrecht-Borth V,Kauss D,风扇D,Hu Y,Collance D,Marri S,Liebers M,Apel K,Pfannschmidt T,Chow Ws,Pogson BJ。光合驯化需要一种新型蛋白酶雪胞蛋白4,对拟南芥的更高的光强度需要。植物理性。2013; 163(2):732-45。GydF4y2Ba
- 7.GydF4y2Ba
Rabinowitch E,Govindjee P. Wiley,纽约,1969年。GydF4y2Ba
- 8.GydF4y2Ba
Neff Mm,Fankhauser C,Chory J. Light:时间和地点的指标。基因开发。2000; 14(3):257-71。GydF4y2Ba
- 9.GydF4y2Ba
yamazaki J.是附加米叶片光合仪器的调节涉及的轻质质量吗?Photosynth Res。2000; 105(1):63-71。GydF4y2Ba
- 10。GydF4y2Ba
景X,龚B,王H,魏米,石QH,刘Sq,李氏,锂·施su,血糖耐受粉状耐药型不同光质组合调控。植物理性生物化学。2018; 124:77-87。GydF4y2Ba
- 11.GydF4y2Ba
Kami C,Lorrain S,Hornitschek P,Fankhauser C.光调植物生长和发育。Curr Top Dev Biol。2010; 91:29-66。GydF4y2Ba
- 12.GydF4y2Ba
在拟南芥遮荫过程中,光质量介导的叶柄伸长涉及木葡聚糖内转葡萄糖基酶/水解酶对细胞壁的修饰。植物杂志。2010;154(2):978 - 90。GydF4y2Ba
- 13。GydF4y2Ba
王俊,卢伟,童晓燕,杨春华。生菜叶片形态、光合性能、叶绿素荧光、气孔发育(GydF4y2Ba摘要以GydF4y2BaL.)暴露于红光的不同比率到蓝光。前植物SCI。2016; 250(7):1-10。GydF4y2Ba
- 14。GydF4y2Ba
杨Z,他,Mou S,王X,陈D,胡X,Chen L,Bai J.植物生长和辣椒幼苗在不同的光周期和蓝色LED的光子通量比下的辣椒幼苗发育。Trans Chin Soc Agric Eng。2017; 33(17):173-80。GydF4y2Ba
- 15.GydF4y2Ba
不同光源对不结球大白菜生长的影响GydF4y2Ba芸苔CameStris.GydF4y2BaL.)。j农业sci。2012; 4(4):262-73。GydF4y2Ba
- 16。GydF4y2Ba
Rehman M,Ullah S,Bao Y,Wang B,Peng D,Liu L.发光二极管:室内植物是否有效光源?环境污染res int。2017; 24(32):24743-52。GydF4y2Ba
- 17.GydF4y2Ba
Johkan M,Shoji K,GoTo F,Hashida S,Yoshihara T.蓝色发光二极管光照射幼苗的幼苗质量和生长在红叶莴苣中移植后。Hortsci。2010; 45(12):1809-14。GydF4y2Ba
- 18.GydF4y2Ba
Savvides A,Fanourakis D,Van ieperen W.跨越黄瓜叶片轻质品质的液压和气孔导电的协调。J Exp Bot。2012; 63(3):1135-43。GydF4y2Ba
- 19.GydF4y2Ba
Muneer S,Kim EJ,Park Js,Lee Jh。绿色,红色和蓝色发光二极管对莴苣叶片不同光强度下多素复合蛋白和光合活性的影响(GydF4y2Ba摘要以GydF4y2BaL.)。int j mol sci。2014; 15(3):4657-70。GydF4y2Ba
- 20。GydF4y2Ba
杨X,徐H,邵升,王R,李吨,王Y.番茄叶片光合容量对不同LED光波长的响应。Environ Exp Bot。2018; 150:161-71。GydF4y2Ba
- 21。GydF4y2Ba
在不同藻类中RuBisCO酶的硅分析中。国际生物学杂志。2014;3:11-7。GydF4y2Ba
- 22。GydF4y2Ba
Kim DG, Lee C, Park SM, Choi YE。利用小球藻调控适宜生育期的光波长,提高生物产量和脂肪酸甲酯产量。Bioresour抛光工艺。2014;159:240-8。GydF4y2Ba
- 23。GydF4y2Ba
结果表明,SBPase活性降低影响转基因烟草植株的生长发育。植物学报2006;29:48-58。GydF4y2Ba
- 24。GydF4y2Ba
Hogewoning SW,Trouwborst G,Maljaars H,Poorter H,Ieperen WV,Harbinson J. Blue Light剂量 - 叶片光合作用,形态和化学成分的响应GydF4y2BaCucumis sativusGydF4y2Ba在红色和蓝光的不同组合下成长。J Exp Bot。2010; 61(11):3107-17。GydF4y2Ba
- 25。GydF4y2Ba
李伊,Xin GF,魏米,施QH,杨FJ,王XF。番茄幼苗叶片在受到不同光质的情况下碳水化合物积累和蔗糖代谢反应。SCI Hortic。2017; 225:490-7。GydF4y2Ba
- 26。GydF4y2Ba
Naznin MT,Lefsrud M,Gravel V,Azad Mok。添加了红色LED的蓝色光,增强了生菜,菠菜,羽衣甘蓝,罗勒和甜椒在受控环境中的生长特征,颜料含量和抗氧化能力。植物(巴塞尔)。2019; 8(4):93。GydF4y2Ba
- 27。GydF4y2Ba
Schuerger AC, Brown CS, Stryjewski EC。辣椒植株解剖特征(GydF4y2BaCapsicum Annuum.GydF4y2BaL.)在补充蓝色或远红光的红色发光二极管下生长。Ann Bot。1997年; 79:273-82。GydF4y2Ba
- 28。GydF4y2Ba
张志强,张志强,张志强,等。干旱条件下光品质对甜椒叶片生理特性的影响。植物物理学报。2018;30(4):287-96。GydF4y2Ba
- 29。GydF4y2Ba
风扇XX,XU ZG,Liu XY,Tang Cm,Wang LW,Han XL。光强度对红色和蓝光组合生长的年轻番茄植物生长和叶发育的影响。SCI Hortic。2013; 153:50-5。GydF4y2Ba
- 30.GydF4y2Ba
Miao Y,Wang X,Gao L,Chen Q,Qu M.蓝光比红光更为必要,用于维持光线叶片中的照片II和I和光合电子传输能力。J Intent agr。2016; 15(1):87-100。GydF4y2Ba
- 31。GydF4y2Ba
Jovicich E,Vansickle JJ,Cantliffe DJ,Stoffella PJ。温室生长的彩色辣椒:佛罗里达州蔬菜生产的盈利替代品?霍尔特技术。2005; 15(2):355-69。GydF4y2Ba
- 32。GydF4y2Ba
Massa G,Graham T,Haire T,Flemming C,Newsham G,Wheeler R.发光二极管透过叶组织的七种不同作物。Hortsci。2015; 50(3):501-6。GydF4y2Ba
- 33。GydF4y2Ba
唐ZQ,Yu JH,谢JM,Lyu JF,Dawuda M,Liao WB,Wu Y,Hu LL。辣椒的生理生长激复(GydF4y2Ba辣椒年L。GydF4y2Ba),以补充红光/蓝光的转录组分析显示。农学。2019;9:139。GydF4y2Ba
- 34。GydF4y2Ba
刘H,傅y,胡D,Yu J,Liu H.绿色,黄色和紫色辐射对生物量,光合作用,光合作用,光合作用,光合莴苣的可溶性糖含量“拆除”。SCI Hortic。2018; 236:10-7。GydF4y2Ba
- 35。GydF4y2Ba
陈志强,王志强,王志强,等。LED夜间光照对番茄幼苗生长和叶片损伤的影响。Sci Hortic。2016;198:363-9。GydF4y2Ba
- 36。GydF4y2Ba
王H,顾M,Cui JX,Shi K,周YH,Yu J.轻质质量对CO的影响GydF4y2Ba2GydF4y2Ba同化,叶绿素荧光猝灭,钙素循环基因的表达和碳水化合物积累GydF4y2BaCucumis sativusGydF4y2Ba.j photochem photobiol b biol。2009; 96(1):30-7。GydF4y2Ba
- 37。GydF4y2Ba
MA LG,Li JM,Qu LJ,Janet H,Chen ZL,Zhao Hy,Deng XW。拟南芥的光控制需要对基因组表达和细胞途径进行协调调节。植物细胞。2001; 13(12):2589-607。GydF4y2Ba
- 38。GydF4y2Ba
吴Q,苏Nn,沉WB,Cui J.分析光合活动和生长GydF4y2BaSolanum lycopersicumGydF4y2Ba暴露于不同光质的幼苗。acta physiol植物。2014; 36(6):1411-20。GydF4y2Ba
- 39。GydF4y2Ba
黄A,黄A,吴TK, Marondedze C, Gehring C, Ooi BS。生长和发展GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba在单波长的红色和蓝色激光下。Sci众议员2016;6(1):33885。GydF4y2Ba
- 40。GydF4y2Ba
GAO S,Liu X,Liu Y,Cao B,Chen Z,Xu K.威尔士洋葱的光合特性和叶绿体超微结构(GydF4y2Ba葱属瘘管GydF4y2BaL.)在不同的LED波长下生长。BMC植物BIOL。2020; 20:78。GydF4y2Ba
- 41。GydF4y2Ba
Kim HH,Goins Gd,Wheeler RM,Sager JC。莴苣的气孔导电在不同的轻质品质下生长或暴露于不同的光质。Ann Bot。2004; 94(5):691-7。GydF4y2Ba
- 42。GydF4y2Ba
发光二极管对陆地棉生长和形态发生的影响GydF4y2Bagossypium hirsutumGydF4y2BaL.)植物体外。植物细胞组织器官邪教。2010; 103(2):155-63。GydF4y2Ba
- 43。GydF4y2Ba
刘米,徐z,杨y,冯y。不同光谱灯的影响GydF4y2Baoncidium.GydF4y2BaPLBS诱导,增殖和植物再生。植物细胞组织器官邪教。2011; 106(1):1-10。GydF4y2Ba
- 44。GydF4y2Ba
王玲,李义,xin gf,魏米,mi qh,杨qc。不同比例红蓝光对番茄幼苗生长和光合作用的影响。Chin J Appl Ecol。2017; 28(5):1595-602(中文)。GydF4y2Ba
- 45。GydF4y2Ba
Arena C,Tsonev T,Dodva D,De Micco V,Michelozzi M,Brunetti C,Centritto M,Fineschi S,Velikova V,Loreto F.轻质质量对单调的生长,光合作用,叶形解剖学和挥发性等异单的影响 -发出草本植物(GydF4y2BaSolanum lycopersicumGydF4y2BaL.)和异戊二烯的树(GydF4y2Ba法国梧桐胶GydF4y2BaL.)。Environ Exp Bot。2016; 130:122-32。GydF4y2Ba
- 46。GydF4y2Ba
刘XY,郭SR,XU ZG,娇XL。作者:张莹莹,王玮,王玮,王玮,王玮,王玮,王玮,王玮,王玮,王玮,王玮,王玮Hortscience。2011; 46(2):217-21。GydF4y2Ba
- 47。GydF4y2Ba
叶片解剖使光和一氧化碳的获取更加平等GydF4y2Ba2GydF4y2Ba叶绿体之间。新植物。1999; 143(1):93-104。GydF4y2Ba
- 48。GydF4y2Ba
光合光适应是否需要改变叶片解剖结构?植物学报。2003;26(4):505-12。GydF4y2Ba
- 49。GydF4y2Ba
苗艳,侯丽,陈强,曲敏,高玲。蓝光通过调节黄瓜叶绿体超微结构、光合特性和养分积累缓解‘红光综合征’。Sci Hortic。2019;257年。GydF4y2Ba
- 50。GydF4y2Ba
Macedo AF,Leal-Costa MV,Tavares ES,Lage Cls,Esquibel Ma。光质质量对叶片生产和发展的影响GydF4y2Ba在体外GydF4y2Ba- 植物植物GydF4y2BaAlterneranthera BrasilianaGydF4y2Bakuntze。Environ Exp Bot。2011; 70:43-50。GydF4y2Ba
- 51。GydF4y2Ba
Li C,Chang S,Khalil-Ur-Rehman M,Xu Z,Tao J.用补充发光二极管照射叶子轴线灯对葡萄光合作用的影响。Aust J葡萄酒R. 2017; 23(1):58-65。GydF4y2Ba
- 52。GydF4y2Ba
潘涛,王莹,王丽,丁杰,曹勇,秦刚,闫丽,席琳,张杰,邹志强。CO2浓度和光照对番茄生长和叶片气体交换的影响。杂志。2020;168:694 - 708。GydF4y2Ba
- 53。GydF4y2Ba
Sytar O,Zivcak M,Neugart S,Toutounchi PM,Brestoury M.在不同颜色色调下的年轻幼苗的预防改变了酚类化合物的积累GydF4y2BacGydF4y2Ba叶在后期生长阶段。Environ Exp Bot。2019年; 165:30-8。GydF4y2Ba
- 54。GydF4y2Ba
Shin Ks,Murthy Hn,Heo JW,Hahn EJ,Paek Ky。光质对体外培养犬植物植物生长发育的影响。acta physiol植物。2008; 30(3):339-43。GydF4y2Ba
- 55。GydF4y2Ba
Maxwell K,约翰逊GN。叶绿素荧光 - 一种实用指导。J Exp Bot。2000; 51(345):659-68。GydF4y2Ba
- 56。GydF4y2Ba
Kumar KS, Dahms HU, Lee JS, Kim HC, Lee WC, Shin KH。用叶绿素a荧光评估藻类对有毒金属和除草剂的光合反应。生态毒理学环境科学。2014;104:51-71。GydF4y2Ba
- 57。GydF4y2Ba
Kalaji HM,Schansker G,Brestic M,Bussotti F,Calatayud A,Ferroni L,Goltsev V,Guidi L,Jajoo A,Li P,Losciale P,Mishra VK,Misra An,Nebauer SG,Pancaldi S,Penella C,Pollastini M那S.uresh K, Tambussi E, Yanniccari M, Zivcak M, Cetner MD, Samborska IA, Stirbet A, Olsovska K, Kunderlikova K, Shelonzek H, Rusinowski S, Bąba W. Frequently asked questions about chlorophyll fluorescence, the sequel. Photosynth Res. 2017;132(1):13–66.
- 58。GydF4y2Ba
Lazárd。多相叶绿素荧光升高在激动光的高强度下测量。Funct植物Biol。2006; 33(1):9-30。GydF4y2Ba
- 59。GydF4y2Ba
Schansker G,Tóthsz,Strasser Rz。豌豆叶片和二溴喹啉治疗豌豆饲料揭示了照相中的作用在CHL A荧光升高中Ojip。Biochim Biophys。2005; 1706(3):250-61。GydF4y2Ba
- 60.GydF4y2Ba
本Hameds,Lefi E,Chaieb M.磷浓度对Psii和Co的光化学稳定性的影响GydF4y2Ba2GydF4y2Ba同化GydF4y2BaPistacia Vera.GydF4y2Ba土地GydF4y2BaPistacia atlanticaGydF4y2Badesf。植物理性生物生物。2019; 142:283-91。GydF4y2Ba
- 61.GydF4y2Ba
林志,钟强,陈超,阮强,陈智,尤欣。缺氮条件下茶叶的co2同化与光合电子传递。机器人钉。2016;57(1):1 - 12。GydF4y2Ba
- 62.GydF4y2Ba
Michelet L, Zaffagnini M, Morisse S, Sparla F, Francia F, Danon A, Marchand CH, Fermani S, Trost P, Lemaire SD。卡尔文-本森循环的氧化还原调节:有旧有新。植物科学学报2013;4:470。GydF4y2Ba
- 63。GydF4y2Ba
Kono T,Mehrotra S,Endo C,Kizu N,Matusda M,Kimura H,Mizohata e,Inoue T,Hasunuma T,Yokota A.甲基型古代甲基植物中的Rubisco介导的碳代谢途径。NAT Communce。2017; 8:14007。GydF4y2Ba
- 64。GydF4y2Ba
桑托斯BMD, Balbuena TSGydF4y2Ba桉树尿尿GydF4y2Ba在高气氛co下种植GydF4y2Ba2GydF4y2Ba浓度:蛋白质组学的观点。J蛋白质组。2017;150:252-7。GydF4y2Ba
- 65。GydF4y2Ba
李志刚,李志刚。植物核光合作用基因的光调控。植物学报,2003;22(5):417-52。GydF4y2Ba
- 66。GydF4y2Ba
水分胁迫与核酮糖- 1,5-二磷酸羧化酶日活性的关系GydF4y2Ba尼科尼亚塔哈瓦姆GydF4y2Ba选择低CO条件下生存的基因型GydF4y2Ba2GydF4y2Ba浓度。植物理性生物化学。1993年; 31:113-20。GydF4y2Ba
- 67。GydF4y2Ba
Raines Ca.Repvin周期重新审视。光合作用res。2003; 75(1):1-10。GydF4y2Ba
- 68。GydF4y2Ba
反义烟草转化体中质体转酮醇酶活性的轻微降低对光合作用和苯丙酸代谢具有显著影响。植物细胞。2001;13(3):535 - 51。GydF4y2Ba
- 69。GydF4y2Ba
”主席Chernyad II。水分胁迫对植物光合作用的影响及细胞分裂素的保护作用。生物化学学报。2005;41(2):133-47。GydF4y2Ba
- 70。GydF4y2Ba
Ingram J,Bartels D.植物中脱水耐受的分子基础。ANN Rev Plant Physiol Plant Mol Biol。1996; 47:377-403。GydF4y2Ba
- 71。GydF4y2Ba
胡丽,廖伟,达uda MM,于俊,吕建军GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba: 不GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba提高了小白菜幼苗的耐弱光性。BMC Plant Biol. 2017;17:22。GydF4y2Ba
- 72。GydF4y2Ba
Oelze ML, Muthuramalingam M, Vogel MO, Dietz KJ。逆行高光适应反应中转录调节和新生蛋白合成之间的联系GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba.BMC基因组学。2014; 15:1。GydF4y2Ba
- 73。GydF4y2Ba
Farquhar Gd,Caemmerer SV,Berry Ja。光合作用的生化模型GydF4y2Ba2GydF4y2BaC3种叶片中的同化。Planta。1980; 149(1):78-90。GydF4y2Ba
- 74。GydF4y2Ba
Dubois JJ,Fiscus El,Booker Fl,Flowers MD,Reid CD。优化光合作用Farquhar-Von Caemmerer-Berry模型参数的统计估计。新植物。2007; 176(2):402-14。GydF4y2Ba
- 75。GydF4y2Ba
Strasser RJ,Tsimilli-Michael M,强S,Goltsev V.同时记录提示和延迟荧光和820nm的干燥过程中的反射变化和复合植物的再水合后GydF4y2BaHaberlea rhodopensis.GydF4y2Ba.Acta botanica sinica(云南植物研究),2010;GydF4y2Ba
- 76。GydF4y2Ba
叶绿素荧光瞬态分析[j]。叶绿素a荧光。2004;321-362。GydF4y2Ba
- 77。GydF4y2Ba
4植物中nadp -苹果酸脱氢酶的研究GydF4y2BaFlaveria bidentisGydF4y2Ba(骨髓细胞和束鞘细胞中活性的肥厚抑制和光合作用的后果)。植物理性。1997年; 113(4):1153-65。GydF4y2Ba
- 78。GydF4y2Ba
叶志强,王志强,王志强,等。甜菜叶片光合作用和碳分配的研究进展。植物营养与肥料学报。植物杂志。1989;90(3):814 - 9。GydF4y2Ba
- 79。GydF4y2Ba
利用蛋白质-染料结合原理的一种快速、灵敏的微量蛋白质定量方法。肛门。1976;72(2):248 - 54。GydF4y2Ba
- 80。GydF4y2Ba
Livak KJ, Schmittgen TD。使用实时定量PCR和2−ΔΔCT方法分析相关基因表达数据。方法。2001;25(4):402 - 8。GydF4y2Ba
致谢GydF4y2Ba
我们承认研究团队的所有成员在该领域的援助和实验室工作。我们感谢国际科学编辑(GydF4y2Bahttp://www.internationalscienceediting.com.GydF4y2Ba)编辑此稿件。GydF4y2Ba
资金GydF4y2Ba
中国农业研究系统(CARS-23-C04),中国自然科学基金(31401921),山东省自然科学基金(ZR2014-CQ029),科技创新团队,中国农业科学基金(31401921)支持这项工作- 适量园艺优势团队(SYL2017YSTD07)和国家重点研发计划(2016年FB0302403)。资金机构没有参与数据的设计,收集,分析和解释,以及写作稿件。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
贡献GydF4y2Ba
WM构思和设计的研究。XGF进行了实验并分析了数据。LY分析了数据并写了稿件。LC,SQH和YFJ修改了这篇论文。所有作者都读过并批准了稿件。GydF4y2Ba
通讯作者GydF4y2Ba
伦理宣言GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
附加信息GydF4y2Ba
出版商的注意事项GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.Creative Commons公共领域奉献豁免(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
李,Y.,Xin,G.,Liu,C.GydF4y2Baet al。GydF4y2Ba红色和蓝光对叶形解剖学,CO的影响GydF4y2Ba2GydF4y2Ba同化和甜椒的光合电子传输能力(GydF4y2BaCapsicum Annuum.GydF4y2BaL.)幼苗。GydF4y2BaBMC植物BIOL.GydF4y2Ba20,GydF4y2Ba318(2020)。https://doi.org/10.1186/s12870-020-02523-z.GydF4y2Ba
已收到GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-020-02523-z.GydF4y2Ba
关键字GydF4y2Ba
- 甜椒(GydF4y2BaCapsicum Annuum.GydF4y2BaL.)GydF4y2Ba
- 轻质质量GydF4y2Ba
- 解剖学GydF4y2Ba
- 光合作用GydF4y2Ba
- CO.GydF4y2Ba2GydF4y2Ba同化GydF4y2Ba